颅内巨大动脉瘤是指瘤体最大径≥2.5 cm的动脉瘤,较少见,约占颅内动脉瘤的3%~6%[1],因其体积巨大而造成的占位效应、瘤内血栓形成、粥样硬化斑块、宽瘤颈、不规则瘤体等因素,使其疗效远不如普通动脉瘤,这一直是神经外科医生面临的巨大挑战。治疗方法中神经介入技术发展迅猛,但仍难以有效解除占位效应,随访复发率高[2]。血管旁路移植技术操作难度大,风险高,移植血管通畅率受术者经验影响较大[3]。显微手术作为巨大动脉瘤主流的治疗方法,术式成熟,然而其最佳治疗方法尚无定论。现将我科10年内收治的22例经显微手术治疗的前循环巨大动脉瘤患者资料进行回顾性分析,旨在探讨通过良好的术前评估及术中监测,结合个体化的治疗策略,进一步提高显微手术治疗巨大动脉瘤的疗效。
1 资料和方法 1.1 一般资料选择2006年5月至2016年5月间收治的经显微手术治疗的前循环巨大动脉瘤患者22例。其中男性12例、女性10例,年龄16~72岁,中位年龄43岁。首发临床表现:(1)突发头痛或意识障碍9例(40.9%);(2)颅内压增高表现6例(27.3%),包括慢性头痛、恶心、呕吐等;(3)神经功能障碍4例(18.2%),其中动眼神经麻痹3例、视力视野障碍1例;(4)缺血症状2例(9.1%),其中偏瘫1例、偏瘫伴失语1例;(5)癫疒间1例(4.5%)。所有病例中,破裂动脉瘤9例,未破裂动脉瘤13例。对9例颅内动脉瘤破裂者进行Hunt-Hess分级,Ⅰ级1例、Ⅱ级2例、Ⅲ级5例、Ⅳ级1例; 未破裂动脉瘤Hunt-Hess分级均为0级。
1.2 影像学资料所有患者均行CT检查,经三维CT血管造影(3D-CTA)或三维数字减影血管造影(3D-DSA)明确诊断,病情许可情况下均完善MRI检查。其中有1例3D-DSA和3D-CTA均不显影,4例3D-DSA显影较淡、3D-CTA显示动脉瘤呈不规则形态,再行MRI检查示瘤内不规则信号,提示有明显血栓形成。结合术中所见及CT、MRI表现,根据动脉瘤所在部位分类:颈内动脉海绵窦段动脉瘤1例,颈内动脉眼动脉段动脉瘤4例,颈内动脉后交通段动脉瘤3例,颈内动脉分叉部动脉瘤2例,大脑中动脉瘤9例,大脑前动脉瘤1例,前交通动脉瘤2例。动脉瘤大小:中位直径3.1 cm,范围为2.6~4.2 cm。
1.3 手术时机9例破裂动脉瘤患者中,8例Hunt-Hess分级在Ⅰ~Ⅲ级的患者在入院后3 d内行急诊(早期)手术, 1例Hunt-Hess分级Ⅳ级患者在入院后16 d (晚期)手术。其余13例患者中早期手术(3 d内)6例,中期手术(4~14 d)3例,晚期手术(>14 d)4例。
1.4 手术方法对所有患者做详细的术前评估,预估术中载瘤动脉闭塞或狭窄可能性较高的病例,行3D-DSA、经颅多普勒超声(transcranial Doppler, TCD)等评价侧支代偿情况,对较复杂的病例借助3D-CTA在计算机中模拟手术入路及术中动脉瘤形态,模拟设计夹闭方案,挑选特殊动脉瘤夹或多动脉瘤夹组合夹闭,选择最优路径及夹闭方式。个体化地选择手术方案。术中尽可能使用微血管多普勒超声(microvasualr Doppler, MVD)对载瘤动脉、分支血管及瘤体进行监测,结合Yasargil逐步夹闭法,做到动脉瘤完全夹闭,且能保证载瘤动脉通畅。本组颈内动脉海绵窦段及眼动脉段动脉瘤病例中有4例能配合进行严格的Matas试验7~13 d,TCD探测对侧颈内动脉代偿大于70%,再行手术。开颅手术入路采用翼点或扩大翼点入路,1例前动脉巨大动脉瘤采用经前部纵裂入路。对于颈内动脉眼动脉段动脉瘤,常规暴露同侧颅外段颈内动脉备用。手术方式:直接夹闭5例,动脉瘤切开、瘤壁塑形12例,动脉瘤切除加脑血管重建2例,动脉瘤孤立术2例,颈内动脉颅外段结扎1例。术中监测:15例采用MVD行术中监测。
1.5 疗效评估以出院为评估终点,采用Glasgow预后评分法(GOS)对所有患者进行疗效评估。术后随访3~118个月。
1.6 统计学处理应用SPSS 13.0软件进行统计学分析。将所有患者以中位年龄为界分为低年龄组与高年龄组,根据性别分为男、女组,以瘤体中位直径为界分为小体积组与大体积组,根据Hunt-Hess分级分为低级别组(0~Ⅱ级)与高级别组(Ⅲ~Ⅴ级),根据动脉瘤是否破裂分为破裂瘤组与未破裂瘤组,根据是否行术中MVD分为MVD组与未行MVD组。采用t检验比较各组出院时GOS评分的差异。检验水准(α)为0.05。
2 结果 2.1 手术情况所有患者均顺利完成显微手术,手术时间为1.5~6.2 h,中位手术时间3.6 h。出血量为150~1 800 mL,中位出血量570 mL。出院时恢复良好、恢复正常生活(GOS 5分)的有14例,轻度病残(GOS 4分)5例,重度病残(GOS 3分)2例,死亡(GOS 1分)1例。除死亡病例外,其余21例患者在出院前或短期(3个月)随访时完成3D-CTA复查,结果显示动脉瘤消失。15例术中行MVD的患者术后3D-CTA结果显示载瘤动脉通畅,无狭窄及闭塞。7例未行MVD的患者中有3例术后CT显示不同程度的脑梗死,1例死亡。
2.2 随访结果21例生存患者术后随访3~118(39±30)个月。3D-CTA或3D-DSA结果显示动脉瘤均消失,无复发。3例轻度残疾偏瘫患者出院6个月后肌力恢复正常,1例重度残疾卧床患者经康复治疗1年后生活能够自理。GOS评估恢复良好者17例,轻度残疾2例,重残1例,死亡1例。本组病例致死率为9.1%(2/22),致残率为13.6%(3/22)。
2.3 预后影响因素分析以出院时GOS评分为标准进行预后影响因素分析,结果显示是否行MVD对预后影响有统计学意义(P=0.036),而年龄(P=1.324)、性别(P=2.346)、动脉瘤大小(P=0.856)、Hunt-Hess分级(P=0.196)、动脉瘤是否破裂(P=0.172)对预后影响无统计学意义。见表 1。
|
|
表 1 显微手术治疗前循环巨大动脉瘤的预后影响因素分析 Tab 1 Factors influencing prognosis of the anterior circulation giant aneurysms treated by microsurgery |
2.4 典型病例
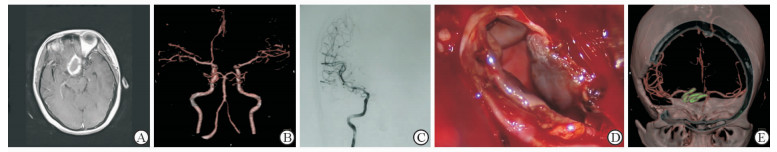
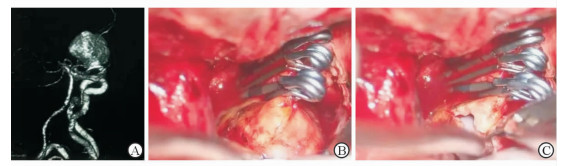
病例1,43岁女性,首发症状为视力视野障碍。MRI提示鞍区占位(图 1A),T1像环形高信号内为等信号影,较为特殊。行3D-CTA及3D-DSA均未见动脉瘤影(图 1B、1C)。术中发现为1例罕见的血栓性动脉瘤,切开瘤壁后可见瘤内巨大血栓(图 1D)。术中采用3枚动脉瘤夹夹闭患者瘤颈,术后3D-CTA提示瘤颈夹闭满意(图 1E),载瘤动脉通畅。患者术后视力视野改善,能够正常生活。病例2,52岁男性,因突发头痛起病。入院时Hunt-Hess分级Ⅲ级。急诊行3D-CTA提示颈内动脉巨大动脉瘤,瘤体形态欠规则(图 2A)。考虑瘤内有血栓。完善术前准备及评估后行动脉瘤夹闭术。术中切开瘤体可见瘤壁局部有钙化及部分血栓形成,质地坚硬,采用多动脉瘤夹夹闭瘤颈(图 2B、2C)。出院时患者有轻度偏瘫,随访3个月时肌力恢复正常。
|
图 1 1例43岁女性患者的影像学表现及术中所见 Fig 1 Imaging results and operation procedure of a 43-year-old female |
|
图 2 1例52岁男性患者的影像学表现及术中所见 Fig 2 Imaging results and operation procedure of a 52-year-old male |
3 讨论
颅内巨大动脉瘤只占颅内动脉瘤很小一部分,可发生于颅内任何部位。常见的好发部位是颈内动脉床突上段、大脑中动脉和椎基底动脉。巨大动脉瘤很少见,绝大部分动脉瘤在长大到直径2.5 cm之前就已经出现各种症状。除动脉瘤破裂外,随着动脉瘤不断长大,占位效应越来越明显,压迫周围脑组织及颅神经导致相应的神经功能障碍;瘤内血流速度减慢、形成涡流致使附壁血栓形成,局部瘤壁钙化;血栓脱落栓塞了远端血管导致脑梗死[4]。这些病理特点决定了颅内巨大动脉瘤临床表现的多样化。本组病例首发症状多样,可见出血、缺血、颅内高压、神经功能障碍、癫疒间等起病。
CTA及DSA是诊断颅内动脉瘤必不可少的检查手段。尤其是3D-CTA及3D-DSA,能在三维空间内任意旋转,模拟手术入路,为术者制定个体化的手术方案提供帮助。本组所有病例均行3D-CTA或3D-DSA检查,术者能在工作站上用软件模拟手术入路及角度,增加了术者对动脉瘤空间形态的了解,为个体化地夹闭动脉瘤、切开塑形等操作提供了必要的形态学信息。DSA检查时如发现巨大动脉瘤,可同时行球囊闭塞试验,了解侧支代偿情况,判断动脉瘤是否能在术中孤立。如代偿不良,则需在术前行Matas试验,帮助患者增加侧支代偿。但是,巨大动脉瘤瘤内往往有血栓,血栓性巨大动脉瘤在DSA或CTA上的表现往往会小于实际动脉瘤的大小,瘤内血栓巨大者可不显影。单凭CTA或DSA检查容易误诊或漏诊。此时CT及MRI检查必不可少,能提供大部分所需的信息,尤其是动脉瘤内血栓的大小、瘤壁的粥样硬化斑块及钙化情况、瘤体与穿通血管的关系等。本组有1例动脉瘤3D-CTA及3D-DSA均不显影,结合MRI和CT表现诊断为颈内动脉眼动脉段动脉瘤,术中证实为血栓性巨大动脉瘤。
巨大动脉瘤相比普通动脉瘤更易破裂。2003年发表的国际多中心大样本研究表明:动脉瘤体积越大,发生破裂的概率越高;巨大动脉瘤年出血率3%,5年累积出血概率达到40%,一旦出血,死亡率达50%[5]。日本2012年的研究也表明巨大动脉瘤年破裂率超过33%,尤其是瘤体上含有子囊者,更易发生破裂[6]。本组病例中破裂动脉瘤占40.9%(9/22),预后不良的3例均为蛛网膜下隙出血起病。其中死亡的1例为Hunt-Hess分级较高(Ⅳ级)的高龄患者,术后因严重的脑血管痉挛合并肺部感染死亡。因此,对巨大动脉瘤采取积极的治疗措施是十分必要的。
动脉瘤夹闭术是一种公认的治疗颅内巨大动脉瘤的有效方法。动脉瘤夹闭后,不仅出血概率极大降低,占位效应也能同时得到有效改善。有报道采用手术治疗的巨大动脉瘤患者,术后恢复良好者占61%~87%,围手术期死亡率和致残率只有5%~22%[7]。本组治疗效果与之相仿。前循环动脉瘤因手术空间相对较大,相比后循环动脉瘤可更倾向采取手术治疗。巨大动脉瘤相比普通动脉瘤手术,困难点在于体积巨大、瘤颈暴露困难、瘤内常有血栓等。术中关键技术主要有:(1)临时阻断技术。阻断动脉瘤内血流,降低动脉瘤内压力,使瘤周空间增大,便于分离及暴露动脉瘤颈及瘤周解剖关系。结合亚低温、巴比妥疗法等技术,辅助电生理监测等手段,可以延长安全的阻断时间,使术者获得更好的手术暴露。对于床突旁动脉瘤,可常规暴露颈内动脉颅外段,以备术中临时阻断。(2)瘤壁穿刺抽吸,切开取栓。在临时阻断载瘤动脉后仍然不能使动脉瘤充分塌陷的情况下,需穿刺抽吸动脉瘤内血液,使动脉瘤体积缩小。如瘤壁钙化、瘤内血栓形成,需要切开动脉瘤,切除瘤内血栓,重塑瘤颈和载瘤动脉。如强行在这类动脉瘤的瘤颈上使用动脉瘤夹,常难以做到完全夹闭瘤颈,或出现载瘤动脉狭窄。本组有12例采用动脉瘤壁切开血栓切除、动脉瘤夹闭+载瘤动脉塑形术,均获得良好暴露及动脉瘤的夹闭效果。(3)多瘤夹、特殊动脉瘤夹的使用。巨大动脉瘤瘤颈常较宽,且常有分支血管从瘤体上发出,经常需要载瘤动脉塑形。常规动脉瘤夹难以满足要求。带窗夹、超长夹、特殊角度夹等的单独及组合使用常能保证在瘤颈良好夹闭的同时,使载瘤动脉获得满意塑形,穿支动脉得到有效保护,减少术后并发症的发生。(4)双极电凝电缩动脉瘤。Yasargil[8]发明使用双极电凝电缩动脉瘤体的方法,能使巨大的、分叶的动脉瘤塑形成相对容易良好夹闭的形状,再逐步夹闭。这种方法在本组病例中也得到了广泛使用,效果良好。(5)血管重建技术。对于一些载瘤动脉迂曲冗长、无明显瘤颈的特殊病例,可以行动脉瘤切除,端端吻合重建载瘤动脉。具备一定的血管重建技术对于此类病例的处理非常重要。本组2例大脑中动脉巨大动脉瘤切除瘤体后行载瘤动脉端端吻合,术后血管通畅,效果良好。(6)术中监测技术。MVD监测是一个公认的快速、简便易行、无创、可靠的术中监测技术[9]。虽然MVD不能直接提供瘤颈、瘤体残留的信息,但可以通过载瘤动脉、瘤体内血流的变化,间接得到这些信息。敏感性和特异性分别可达98.0%和98.4%[10],可以为术中动脉瘤夹位置的调整提供客观依据。在动脉瘤夹闭、塑形过程中,常需反复多次使用MVD监测动脉瘤体及载瘤动脉、分支动脉,不断调整瘤夹位置,达到在完全夹闭动脉瘤的同时,使分支动脉塑形完好,载瘤动脉通畅。本组病例中,与未行MVD组比较,术中行MVD组出院时GOS评分较高。结合以往报道的MVD临床应用体会[11],我们认为MVD技术是简便又可靠的颅内巨大动脉瘤手术监测手段。
动脉瘤孤立术与切除术等手术方式也是有效治疗方法,但因载瘤动脉牺牲,在部分患者中会导致严重并发症,现已较少单独使用。常需在术前评估侧支循环代偿情况。本组有2例侧支循环代偿良好病例行动脉瘤孤立术,另2例动脉瘤切除后行载瘤动脉端端吻合,均未发生严重并发症。武琛等[12]、石祥恩等[13]尝试采用血管旁路移植手术重建脑血管,辅助巨大动脉瘤孤立或切除术,取得一定的效果。脑血管重建术将是未来处理复杂的颅内动脉瘤的发展方向。
介入治疗近年来迅速发展,但仍然无法代替显微手术解决巨大动脉瘤的占位效应,而且目前仍然难以做到完全闭塞巨大动脉瘤的瘤体,随访发现复发率较高;对于瘤颈较宽者,面临的困难不亚于手术治疗[14]。介入治疗费用明显高于显微手术[15],高昂的介入费用常常阻碍患者选择介入治疗。随着材料技术的发展,覆膜支架已能放置到颈内动脉海绵窦段。该部位的巨大动脉瘤难以暴露夹闭,孤立动脉瘤需要良好的Willis环代偿,对于代偿不良的患者往往需要颅内外血管旁路移植等复杂手术。因此覆膜支架技术对代偿不良的颈内动脉海绵窦段巨大动脉瘤治疗有一定优越性[16]。血流转向装置与密网支架的单独或重叠使用可起载瘤动脉内血流导向作用,降低动脉瘤再破裂风险,术后随访发现巨大动脉瘤体也有缩小趋势,且术后并发症少,在复杂及巨大的颅内动脉瘤的治疗中也取得了良好的效果[17-18],代表着未来的发展方向。
总之,颅内前循环巨大动脉瘤的治疗需要详细的术前评估和个体化的治疗方案。术者的经验与技巧配合良好的术中监测是保证满意的显微手术治疗效果的基础。
| [1] | LAWTON M T, SPETZLER R F. Surgical strategies for giant intracranial aneurysms[J]. Acta Neurochir Suppl, 1999, 72: 141–156. |
| [2] | CHALOUHI N, TJOUMAKARIS S, GONZALEZ L F, DUMONT A S, STARKE R M, HASAN D, et al. Coiling of large and giant aneurysms:complications and long-term results of 334 cases[J]. AJNR Am J Neuroradiol, 2014, 35: 546–552. DOI: 10.3174/ajnr.A3696 |
| [3] | KALANI M Y, ZABRAMSKI J M, HU Y C, SPETZLER R F. Extracranial-intracranial bypass and vessel occlusion for the treatment of unclippable giant middle cerebral artery aneurysms[J]. Neurosurgery, 2013, 72: 428–436. DOI: 10.1227/NEU.0b013e3182804381 |
| [4] | CANTORE G, SANTORO A, GUIDETTI G, DELFINIS C P, COLONNESE C, PASSACANTILLI E. Surgical treatment of giant intracranial aneurysms:current viewpoint[J]. Neurosurgery, 2008, 63(4 Suppl 2): 279–289. |
| [5] | WIEBERS D O, WHISNANT J P, HUSTON J, MEISSNER I, BROWN R D Jr, PIEPGRAS D G, et al. Unruptured intracranial aneurysms:natural history, clinical outcome, and risks of surgical and endovascular treatment[J]. Lancet, 2003, 362: 103–110. DOI: 10.1016/S0140-6736(03)13860-3 |
| [6] | UCAS Japan Investigators, MORITA A, KIRINO T, HASHI K, AOKI N, FUKUHARA S, HASHIMOTO N, et al. The natural course of unruptured cerebral aneurysms in a Japanese cohort[J]. N Engl J Med, 2012, 366: 2474–2482. DOI: 10.1056/NEJMoa1113260 |
| [7] | GREGORY V, JOSEPH Z, PETER N. Surgical management of giant posterior communicating artery aneurysms[J]. Neurosurgery, 2012, 71(1 Suppl Operative): 43–51. |
| [8] | YASARGIL M G. Anterior cerebral and communicating artery aneurysms[M]//YASARGIL M G. Microneurosurgery Ⅱ. New York:Georg Thieme Verlag, 1984:165-213. |
| [9] | DURAND A, PENCHET G, THINES L. Intraoperative monitoring by imaging and electrophysiological techniques during giant intracranial aneurysm surgery[J]. Neurochirurgie, 2016, 62: 14–19. DOI: 10.1016/j.neuchi.2015.03.005 |
| [10] | SIASIOS I, KAPSALAKI E Z, FOUNTAS K N. The role of intraoperative micro-Doppler ultrasound in verifying proper clip placement in intracranial aneurysm surgery[J]. Neuroradiology, 2012, 54: 1109–1118. DOI: 10.1007/s00234-012-1023-y |
| [11] | 吴江, 张世明, 王中, 虞正权, 周幽心, 李向东, 等. 脑动脉瘤夹闭术中微血管多普勒监测分析[J]. 中华神经外科杂志, 2013, 29: 516–518. |
| [12] | 武琛, 许百男, 孙正辉, 姜金利, 余新光, 周定标. 颅内外血管搭桥治疗复杂动脉瘤及搭桥血管闭塞的防治[J]. 中华外科杂志, 2011, 49: 70–73. |
| [13] | 石祥恩, 张永力, 刘方军, 孙玉明, 周忠清, 钱海, 等. 颌内动脉搭桥治疗颅内巨大动脉瘤[J]. 中华神经外科杂志, 2013, 29: 37–40. |
| [14] | HA S W, JANG S J. Clinical analysis of giant intracranial aneurysms with endovascular embolization[J]. J Cerebrovasc Endovasc Neurosurg, 2012, 14: 22–28. DOI: 10.7461/jcen.2012.14.1.22 |
| [15] | FAMILIARI P, MALDANER N, KURSUMOVIC A, RATH S A, VAJKOCZY P, RACO A, et al. Cost comparison of surgical and endovascular treatment of unruptured giant intracranial aneurysms[J]. Neurosurgery, 2015, 77: 733–741. DOI: 10.1227/NEU.0000000000000917 |
| [16] | TAN H Q, LI M H, LI Y D, FANG C, WANG J B, WANG W, et al. Endovascular reconstruction with the Willis covered stent for the treatment of large or giant intracranial aneurysms[J]. Cerebrovasc Dis, 2011, 31: 154–162. DOI: 10.1159/000321735 |
| [17] | COLBY G P, LIN L M, CAPLAN J M, JIANG B, MICHNIEWICZ B, HUANG J, et al. Flow diversion of large internal carotid artery aneurysms with the surpass device:impressions and technical nuance from the initial North American experience[J]. J Neurointerv Surg, 2016, 8: 279–286. DOI: 10.1136/neurintsurg-2015-011769 |
| [18] | KALLMES D F, HANEL R, LOPES D, BOCCARDI E, BONAF A, CEKIRGE S, et al. International retrospective study of the pipeline embolization device:a multicenter aneurysm treatment study[J]. AJNR Am J Neuroradiol, 2015, 36: 108–115. DOI: 10.3174/ajnr.A4111 |
 2016, Vol. 37
2016, Vol. 37


