2. 中国科学院上海药物研究所受体结构与功能重点实验室, 上海 201203;
3. 中国科学院上海药物研究所分析化学研究室, 上海 201203
2. Key Laboratory of Receptor Research, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Department of Analytical Chemistry, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
流行病学调查数据显示,脑卒中(stroke,俗称脑中风)已成为我国60岁以上人群的第二大致死病因[1]。依据病理性质该疾病亚型可分为缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中是最常见的类型,占全部脑卒中患者的70%~87%[2]。缺血性脑卒中因局部脑组织区域急性血液供应障碍(一般情况下由血栓引起)造成脑神经细胞损伤或死亡[3],该疾病具有高致残率和高致死率的特征。使用药物溶解血栓,及时恢复血流灌注被认为是治疗缺血性脑卒中的有效方法[4]。然而临床研究表明,缺血性脑卒中患者即使恢复血流,预后依然不良[5]。研究表明脑缺血后再灌注会导致严重的脑水肿和出血性转化,使组织细胞发生缺血性损伤[6]。缺血再灌注损伤的机制包括自由基损伤、炎症反应、Ca2+超载以及谷氨酸神经毒性损伤等[7],从代谢物水平上解读缺血再灌注损伤的病理机制还需进行更深入的研究。
核磁共振(nuclear magnetic resonance, NMR)分析技术能够得到复杂生物样品体系中大量代谢物的定量信息,应用十分广泛[8-11]。本实验室前期应用NMR技术研究了大鼠脑缺血再灌注3 h时皮质、海马及纹状体组织中代谢物水平的变化,结果表明缺血端组织出现能量代谢紊乱和氧化应激加重[12]。陈曦等[13]应用NMR技术研究脑缺血再灌注大鼠模型,发现大鼠血清中谷氨酰胺、牛磺酸、乳酸、酪氨酸的水平升高,脂类、N-乙酰天冬氨酸、乙酰乙酸、胆碱的水平降低。Wang等[14]运用大脑中动脉闭塞法(middle cerebral artery occlusion, MCAO)制备脑缺血再灌注大鼠模型,通过NMR定量技术分析再灌注早期(0、0.5、1、3、6 h)脑脊液中各代谢物水平变化趋势,结果显示缺血引起脑脊液中糖酵解加剧,三羧酸循环受损,氨基酸、脂类以及核苷酸的代谢异常,这些代谢异常的程度随时间延长而变化,反映出缺血再灌注造成神经损伤的时间相关性分子机制。脑卒中发生后通常会出现皮质运动控制区的兴奋性改变[15],有研究提出MCAO模型引起梗死缺血的主要部位是大脑皮质组织[16],目前针对大脑皮质缺血再灌注损伤在分子水平上的时间相关性研究鲜有报道。
本研究中,我们制备了MCAO大鼠左脑局部缺血模型,在缺血2 h再灌注3 h、6 h和24 h 3个时间点分别收集模型组(MCAO组)和假手术组(SHAM组)大鼠左脑皮质组织,以基于NMR的代谢物组分析方法研究缺血再灌注损伤导致代谢物水平变化与再灌注时间的相关性,以期为临床上纠正代谢紊乱、减缓损伤进展提供基础理论指导。
1 材料和方法 1.1 仪器、试剂和动物超低温探头的Bruker AVANCE Ⅲ600MHz超导NMR仪,Eppendorf 5424R离心机,Eppendorf 5804R离心机,Bertin*Precellys 24多功能样品均质器,FD-1A-55型冷冻干燥机,-80℃超低温冰箱。
D2O (99.9%氘代)购于西格玛奥德里奇(上海)贸易有限公司,三氯甲烷(HPLC级)、甲醇(HPLC级)、Na2HPO4·12H2O (分析纯)和NaH2PO4·2H2O (分析纯)均购于国药集团化学试剂有限公司。
42只SPF级雄性SD大鼠(体质量250~300 g)由上海斯莱克实验动物有限责任公司提供[动物合格证编号为SCXK (沪)2012-0002],根据体质量将大鼠随机分配到SHAM组(18只)和MCAO组(24只),在实验的3个时间点(3、6、24 h) SHAM组和MCAO组各有6只和8只,每组大鼠体质量均呈均衡分布。所有大鼠于中国科学院上海药物研究所实验动物房内适应性饲养3 d,每天12 h光照/12 h黑夜交替,温度(24±2)℃,自由进食饮水。本动物实验符合上海药物研究所实验动物管理与使用委员会的伦理要求。
1.2 实验过程依照文献[17]方法制备MCAO模型。MCAO组大鼠左脑缺血2 h后,拔出栓线并结扎颈外动脉断端,恢复脑血流灌注,然后将大鼠回笼监护,手术结束后,按体质量肌注抗生素氨苄青霉素钠(2.5 mg/kg)防止感染;SHAM组手术步骤同MCAO组,但仅将颈外动脉结扎并剪断,不进行栓线阻塞大脑中动脉操作,同样肌注抗生素。缺血再灌注24 h时,MCAO组有2只大鼠死亡,故该组在24 h时剩余6只。
分别于再灌注后3、6、24 h断头处死大鼠,立刻解剖并收集左脑皮质组织,迅速置于液氮中速冻,运用甲醇/氯仿/水混合溶剂[18]萃取获得组织中水溶性代谢物。萃取操作程序如下:400 μL甲醇、400 μL氯仿、285 μL水与大脑皮质组织(湿质量约100 mg)在匀浆管(内预置5颗直径为2 mm的匀浆珠)中混合,静置3 min,用均质器在5 000 r/min条件下震荡20×4 s,在4℃环境中静置5 min后,于4℃以13 253×g转速离心10 min,取上层水相层放入15 mL离心管中。上述萃取操作重复3次,收集水相层冷冻抽干得到水溶性代谢物粉末。在进行NMR数据采集前,水溶性组织萃取物中加入550 μL重水配置的磷酸盐缓冲液(Na2HPO4·12H2O/NaH2PO4·2H2O,0.2 mol/L,pH 7.4),将样品pH值变化控制在较小的范围内,涡旋振荡2 min后离心(10 281×g,4℃,10 min),将上清液(500 μL)移入直径为5 mm的NMR管中。
1.3 NMR数据采集25℃室温条件下,在带有超低温探头的600 MHz NMR谱仪上,使用zgpr脉冲序列采集脑组织水溶性代谢物萃取液样品的一维NMR谱图,采样参数为弛豫延迟时间10 s,数据点128 K,谱宽10 kHz,自由诱导衰减累加64次。随机在每组中选取1~2个样本采集二维TOCSY谱图(脉冲序列为mlevphpr)以辅助代谢物谱峰归属,采样数据点f2维为1 024,f1维为256,谱宽9.6 kHz,扫描次数64次。
1.4 数据分析与统计学处理将所有的一维NMR氢谱在进行傅里叶变换前乘以0.3 Hz线宽窗函数。使用MestReNova 8.1(Mestrelab Research S.L.)软件对谱图进行手动调相、基线校正并参考肌酸甲基基团(3.043)的化学位移进行定标并行峰对齐操作。
以3×10-9的宽度将一维NMR氢谱谱图中化学位移9.36~0.60区域划分为2 920个积分区段。谱图积分数据中去掉水峰(化学位移5.38~4.68)、来自萃取剂的残留甲醇(化学位移3.40~3.32)和乙醇(化学位移1.21~1.17,化学位移3.69~3.65)的积分。将归属得到的代谢物谱峰积分进行加和得到各代谢物的积分值,将每个代谢物的积分值与内参代谢物肌酸的积分值相除得到相对积分比(Ir),SHAM组各代谢物在同一时间点的左脑相对积分比变化差异无统计学意义,故以SHAM组左脑的各代谢物在同一时间点相对积分比的平均值(I)作为基线对照。将MCAO组大鼠左脑相对积分比和SHAM组大鼠左脑相对积分比,分别与该平均值(I)相除,以比值(Ir/I)的均值作为代谢物相对积分值,并采用student’s t检验对MCAO组左脑和SHAM组左脑代谢物的相对积分值做统计学分析,检验水准(α)为0.05,最后制作每个代谢物相对积分值的时间变化轨迹图。
2 结果 2.1 大鼠脑皮质组织代谢物谱峰水溶性代谢物萃取液的一维NMR氢谱谱峰归属依据人类代谢组数据库(Human Metabolome Database,HMDB; www.hmdb.ca )里的谱图数据、二维NMR图谱,以及通过查阅文献[19]指认大鼠脑皮质组织水溶性代谢物萃取液的NMR信号。可确定信号归属的代谢物谱峰指认详见图 1和表 1。
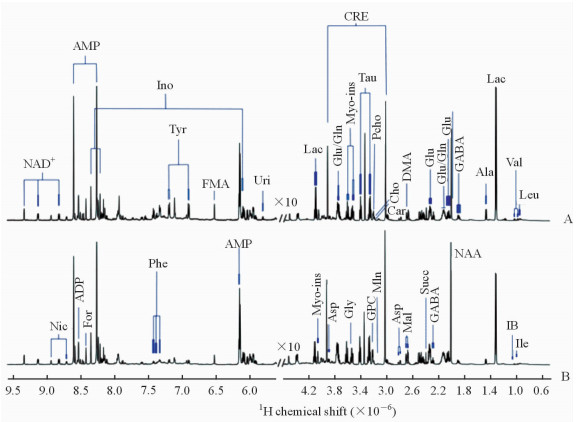
|
图 1 大鼠左脑皮质组织水溶性代谢物萃取液的代表性一维NMR氢谱 Fig 1 Two typical 1D 1H NMR spectra of aqueous metabolite extracts in the left cortex tissues of rats |
|
|
表 1 大鼠左脑皮质水溶性代谢物萃取液一维NMR氢谱中代谢物的归属 Tab 1 Resonance assignments of metabolites in 1D 1H NMR spectra of aqueous extracts in the left cortex tissues of rats |
2.2 脑缺血再灌注诱导的大鼠脑皮质组织代谢物水平组间变化
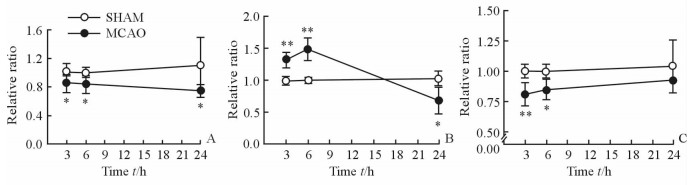
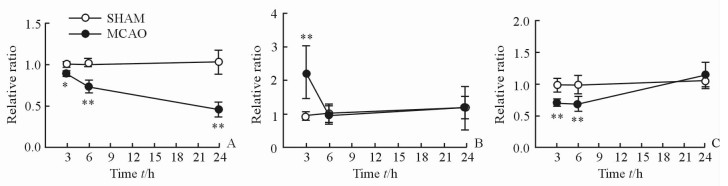
采用student’s t检验方法对MCAO大鼠左脑和SHAM组大鼠左脑皮质代谢物相对定量水平进行统计学分析,发现组间差异具有统计学意义的能量代谢相关代谢物为一磷酸腺苷(AMP)、苹果酸(Mal)、延胡索酸(FMA)、苯丙氨酸(Phe)、酪氨酸(Tyr)、丙氨酸(Ala)、乳酸(Lac)、肉毒碱(Car)、尿嘧啶(Uri),见图 2; 支链氨基酸为亮氨酸(Leu)、异亮氨酸(Ile)、缬氨酸(Val),见图 3; 抑制性氨基酸为γ-氨基丁酸(GABA)、甘氨酸(Gly), 见图 4; 兴奋性氨基酸为天冬氨酸(Asp)、谷氨酰胺(Gln)、谷氨酸(Glu),见图 5; 细胞状态相关代谢物为N-乙酰天冬氨酸(NAA)、胆碱(Cho)、甘油磷酰胆碱(GPC),见图 6。
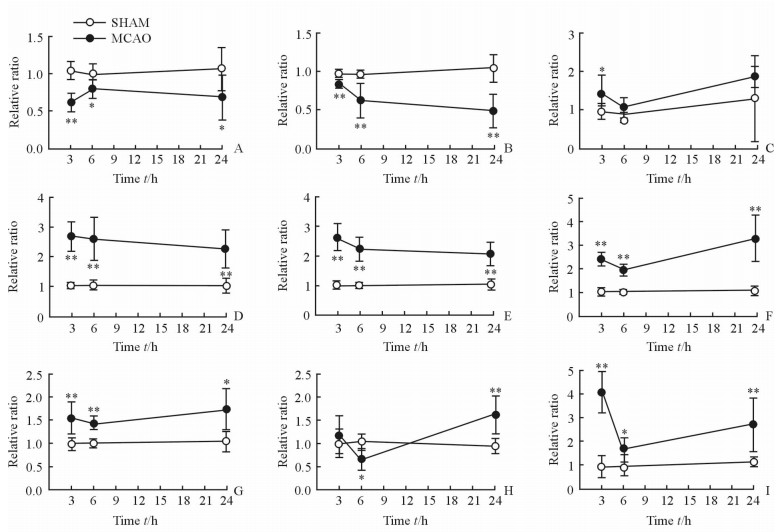
|
图 2 大鼠左脑皮质能量代谢相关代谢物水平变化轨迹图 Fig 2 Time trajectory plots of metabolite levels related to energy metabolism in the left cortex tissues of rats |
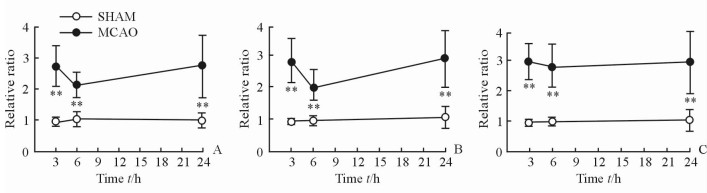
|
图 3 大鼠左脑皮质支链氨基酸水平变化轨迹图 Fig 3 Time trajectory plots of branched-chain amino acid levels in the left cortex tissues of rats |
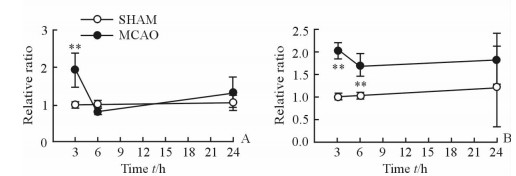
|
图 4 大鼠左脑皮质抑制性氨基酸水平变化轨迹图 Fig 4 Time trajectory plots of inhibitory amino acid levels in the left cortex tissues of rats |
|
图 5 大鼠左脑皮质兴奋性氨基酸水平变化轨迹图 Fig 5 Time trajectory plots of excitatory amino acid levels in the left cortex tissues of rats |
|
图 6 大鼠左脑皮质细胞状态相关代谢物水平变化轨迹图 Fig 6 Time trajectory plots of metabolite levels related to the cell states in the left cortex tissues of rats |
3 讨论
脑卒中可引发脑功能障碍,造成患者语言、行为等功能缺陷或丧失[20]。尽管一些溶栓制剂已经用于治疗急性缺血性脑卒中,但是由于溶栓制剂如组织纤溶酶原激活物的治疗窗窄且不良反应较大[21],仅有不足5%的患者适用此类药物[22]。大多数患者因缺血再灌注造成的严重神经细胞损伤得不到有效的治疗而导致身体机能以及认知功能发生障碍[23]。基于NMR分析技术能够得到复杂生物样品体系中大量代谢物的定量信息等优点,应用该技术分析脑缺血再灌注损伤过程中代谢物水平随时间变化轨迹,有可能为缓解缺血再灌注损伤提供新的治疗思路。
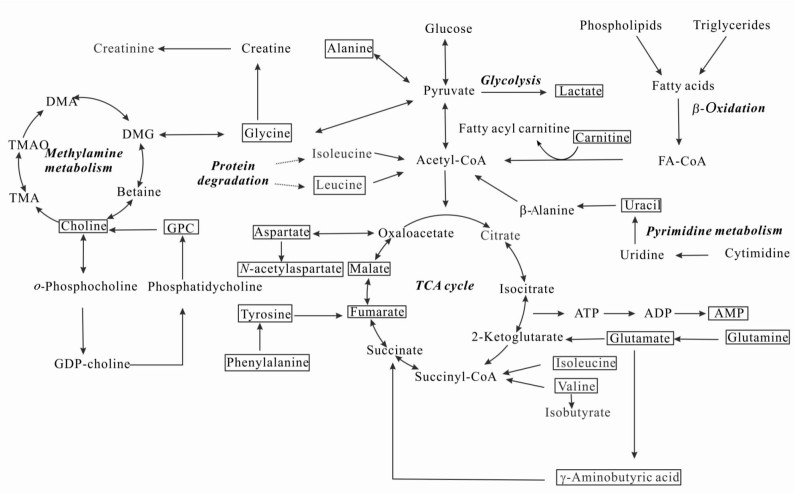
3.1 能量代谢脑组织在供氧充足的情况下,葡萄糖通过有氧氧化途径生成三磷酸腺苷,然后三磷酸腺苷分解为一磷酸腺苷同时释放能量,这是机体的主要供能方式。本研究发现在3个观察时间点(3、6、24 h) MCAO大鼠左脑皮质中一磷酸腺苷的含量低于SHAM组,且其他能量代谢相关物质包括延胡索酸、苯丙氨酸、乳酸、尿嘧啶等,如图 7所示都直接或间接地参与到机体能量代谢过程中,再灌注3个时间点MCAO组大鼠左脑皮质组织中这些化合物的含量较SHAM组左脑皮质升高,表明缺血再灌注的早期已经出现能量不足的现象。
|
图 7 MCAO大鼠脑皮质缺血再灌注损伤扰乱的代谢通路 Fig 7 Metabolic pathways disturbed by ischemia-reperfusion injury in the left cortex of MCAO rats |
当血氧供应不足时, 葡萄糖则通过低效率的无氧糖酵解来实现供能,此时丙酮酸通过无氧途径转化为乳酸[24],本研究发现再灌注3 h时MCAO大鼠左脑中乳酸的含量较SHAM组左脑皮质中升高,再灌注6 h时乳酸的含量较3 h时有下降趋势,6 h时一磷酸腺苷的含量较再灌注3 h时有升高趋势,可能源于机体的自身调节,增加了供氧供能,三羧酸循环增强,而且延胡索酸作为三羧酸循环的中间体因消耗在再灌注6 h时的含量较3 h时有所下降;再灌注24 h时,机体对于损伤的调节能力有限,供氧依然不足,一磷酸腺苷含量降低,无氧酵解增加导致乳酸含量再次升高。由于脑皮质组织缺血缺氧导致的三羧酸循环能力下降,能量供应不足,此时需蛋白质分解来供能,蛋白质分解出的苯丙氨酸在羟化酶的作用下转化为酪氨酸[25],进而分解为延胡索酸[26],导致延胡索酸的含量在MCAO组左脑再灌注24 h时较6 h时上升。MCAO组左脑中苯丙氨酸和酪氨酸的含量在3个观察时间点均持续下降。机体缺血缺氧时丙氨酸可通过转化为丙酮酸盐[27]而参与到无氧糖酵解过程中,因而在再灌注6 h时的含量较3 h时含量下降。
与此同时,由于能量代谢的需要,三羧酸循环的下降导致脂类β-氧化的增加,肉毒碱作为脂类β-氧化过程中的载体物质,其含量变化反映β-氧化过程的强弱。尿嘧啶在三磷酸腺苷的参与下合成二磷酸尿苷和三磷酸尿苷[28],其含量也随机体能量代谢改变而产生相应的变化。
3.2 氨基酸代谢支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)[29]水平在再灌注3、6、24 h时,MCAO组左脑皮质组织中的相对含量高于SHAM组,是因为再灌注初期缺血导致的能量不足,蛋白质发生降解,释放出这类供能氨基酸并间接参与三羧酸循环,随着机体自身调节能量供应,在MCAO组左脑皮质再灌注6 h时支链氨基酸含量较再灌注3 h时下降,之后由于机体自身调节减弱,三羧酸循环减少,这类氨基酸的含量在再灌注24 h时较再灌注6 h上升。
3.3 抑制性氨基酸和兴奋性氨基酸代谢γ-氨基丁酸和甘氨酸作为哺乳动物中枢神经系统主要的抑制性神经递质[30],它们累积并储存于神经末梢的突出囊泡内。γ-氨基丁酸及甘氨酸与相应的受体结合,维持神经细胞内外渗透压平衡,以保护神经细胞。本研究中由于大鼠机体自身调节作用使得缺血后再灌注造成的神经细胞损伤有所减缓,所以再灌注6 h时γ-氨基丁酸和甘氨酸的含量较3 h时下降。而后因自身调节能力下降,再灌注造成的神经细胞损伤加剧,机体释放相应的γ-氨基丁酸和甘氨酸减少神经细胞损伤,导致再灌注24 h时γ-氨基丁酸和甘氨酸的含量较6 h时上升。
天冬氨酸在人体内可由草酰乙酸转化而来,具有调节神经细胞代谢的功能,在缺血再灌注过程中随三羧酸循环能力下降而含量相应降低。谷氨酸是脑内普遍存在的兴奋性氨基酸,在谷氨酸脱氢酶的作用下进入三羧酸循环[31]。神经元中谷氨酸可在谷氨酰胺合成酶的作用下合成谷氨酰胺。本研究中,皮层组织在缺血再灌注的过程中谷氨酰胺在6 h时的含量较3 h升高,24 h含量下降,而谷氨酸含量在3个时间点均出现相应上升,表明缺血缺氧导致神经元代谢紊乱,谷氨酸与谷氨酰胺平衡被打破。
3.4 细胞代谢N-乙酰天冬氨酸是脑内神经细胞密度和活力的一个标记物,由神经细胞线粒体合成并由神经细胞胞体分泌[32]。本研究显示MCAO组左脑皮质组织中N-乙酰天冬氨酸的含量在3个观察时间点均低于SHAM组且处于持续下降状态,表明机体通过自身调节虽可减缓缺血再灌注导致神经细胞损伤的进程,但不能阻止该损伤。因哺乳动物中N-乙酰天冬氨酸的合成与能量代谢相关,再灌注损伤导致能量不足影响N-乙酰天冬氨酸的合成也是N-乙酰天冬氨酸持续下降的原因之一[33]。
胆碱是合成磷酯酰胆碱的重要成分[34],胆碱合成磷酯酰胆碱需要消耗能量,MCAO组大鼠左脑皮质胆碱含量在再灌注6 h时低于再灌注3 h时,可能是因为再灌注6 h时能量不足的状态有所缓解,胆碱消耗增加,合成磷脂酰胆碱增多。随着机体自身调节作用减弱,能量不足现象加剧,胆碱合成磷脂酰胆碱的效率下降,再灌注24 h时胆碱含量高于再灌注6 h时。甘油磷酯酰胆碱分解释放胆碱,是磷酯酰胆碱的下游产物[35],同时具有重要的膜保护作用,促进细胞膜的再生功能[36],在再灌注24 h时含量升高可能是机体用来保护皮质组织中的细胞膜。
综上所述,脑缺血再灌注后24 h内,脑皮质能量代谢、氨基酸代谢、神经细胞代谢等在不同时间点受到不同程度的扰动,如何调控这些代谢紊乱将为减缓缺血性卒中脑损伤提供新的临床治疗思路。
| [1] | LIU L, WANG D, WONG K S, WANG Y. Stroke and stroke care in China:huge burden, significant workload, and a national priority[J]. Stroke, 2011, 42: 3651–3654. DOI: 10.1161/STROKEAHA.111.635755 |
| [2] | MOZAFFARIAN D, BENJAMIN E J, GO A S, ARNETT D K, BLAHA M J, CUSHMAN M, et al. Executive summary:heart disease and stroke statistics-2015 update:a report from the American Heart Association[J]. Circulation, 2015, 131: 434–441. DOI: 10.1161/CIR.0000000000000157 |
| [3] | RUAN L, HUANG H S, JIN W X, CHEN H M, LI X J, GONG Q J. Tetrandrineattenuated cerebral ischemia/reperfusion injury and induced differential proteomic changes in a MCAO mice model using 2-D DIGE[J]. Neurochem Res, 2013, 38: 1871–1879. DOI: 10.1007/s11064-013-1093-1 |
| [4] | STOLL G, KLEINSCHNITZ C, NIESWANDT B. Molecular mechanisms of thrombus formation in ischemic stroke:novel insights and targets for treatment[J]. Blood, 2008, 112: 3555–3562. DOI: 10.1182/blood-2008-04-144758 |
| [5] | BRODERICK J P, PALESCH Y Y, DEMCHUK A M, YEATTS S D, KHATRI P, HILL M D, et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke[J]. N Engl J Med, 2013, 368: 893–903. DOI: 10.1056/NEJMoa1214300 |
| [6] | MOLINA C A, ALVAREZ-SABIN J. Recanalization and reperfusion therapies for acute ischemic stroke[J]. Cerebrovasc Dis, 2009, 27(Suppl 1): 162–167. |
| [7] | 骞秀芳. 脑缺血再灌注损伤机制的研究概况[J]. 基层医学论坛, 2015, 19: 3113–3115. |
| [8] | TANGH, WANGY. Metabonomics:a revolution in progress[J]. 生物化学与生物物理进展, 2006, 33: 401–417. |
| [9] | APPERLEY D C, HARRIS R K, LARSSON T, MALMSTROM T. Quantitative nuclear magnetic resonance analysis of solid formoterol fumarate and its dihydrate[J]. J Pharm Sci, 2003, 92: 2487–2494. DOI: 10.1002/jps.10500 |
| [10] | LUTZ N W, BÉRAUD E, COZZONE P J. Metabolomic analysis of rat brain by high resolution nuclear magnetic resonance spectroscopy of tissue extracts[J]. J Vis Exp, 2014(91): 51829. |
| [11] | LI Z, WELBECK E, YANG L, HE C, HU H, SONG M, et al. A quantitative H nuclear magnetic resonance (qHNMR) method for assessing the purity of iridoids and secoiridoids[J]. Fitoterapia, 2015, 100: 187–194. DOI: 10.1016/j.fitote.2014.12.001 |
| [12] | 张天舒, 阮志, 刘霞, 黄瑾, 张乃霞. MCAO大鼠脑缺血再灌注损伤机制的核磁共振代谢组学研究[J]. 中国药科大学学报, 2016, 47: 188–198. |
| [13] | 陈曦, 杨永霞, 王淑美, 王战红, 苏智斌, 李建生, 等. 基于NMR代谢组学研究脑脉通复方提取物对大鼠脑缺血再灌注模型的影响[J]. 中草药, 2012, 43: 97–102. |
| [14] | WANG Y, WANG Y, LI M, XU P, GU T, MA T, et al. H NMR-based metabolomics exploring biomarkers in rat cerebrospinal fluid after cerebral ischemia/reperfusion[J]. Mol Biosyst, 2013, 9: 431–439. DOI: 10.1039/c2mb25224d |
| [15] | DI LAZZARO V, PELLEGRINO G, DI PINO G, CORBETTO M, RANIERI F, BRUNELLI N, et al. Val66Met BDNF gene polymorphism influences human motor cortex plasticity in acute stroke[J]. Brain Stimul, 2015, 8: 92–96. DOI: 10.1016/j.brs.2014.08.006 |
| [16] | SAKATANI K, ⅡZUKA H, YOUNG W. Somatosensory evoked potentials in rat cerebral cortex before and after middle cerebral artery occlusion[J]. Stroke, 1990, 21: 124–132. DOI: 10.1161/01.STR.21.1.124 |
| [17] | RUAN Z, WANG H M, HUANG X T, FU Y, WU J, YE C Y, et al. A novel caffeoyl triterpene attenuates cerebral ischemic injury with potent anti-inflammatory and hypothermic effects[J]. J Neurochem, 2015, 133: 93–103. DOI: 10.1111/jnc.2015.133.issue-1 |
| [18] | BECKONERT O, KEUN H C, EBBELS T M D, BUNDY J, HOLMES E, LINDON J C, et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts[J]. Nat Protocols, 2007, 2: 2692–2703. DOI: 10.1038/nprot.2007.376 |
| [19] | YANG M, WANG S, HAO F, LI Y, TANG H, SHI X. NMR analysis of the rat neurochemical changes induced by middle cerebral artery occlusion[J]. Talanta, 2012, 88: 136–144. DOI: 10.1016/j.talanta.2011.10.022 |
| [20] | FENG J, ISERN N G, BURTON S D, HU J Z. Studies of secondary melanoma on C57BL/6J mouse liver using H NMR metabolomics[J]. Metabolites, 2013, 3: 1011–1035. DOI: 10.3390/metabo3041011 |
| [21] | MORETTI A, FERRARI F, VILLA R F. Neuroprotection for ischaemic stroke:current status and challenges[J]. Pharmacol Ther, 2015, 146: 23–34. DOI: 10.1016/j.pharmthera.2014.09.003 |
| [22] | WARDLAW J M, MURRAY V, BERGE E, DEL ZOPPO G, SANDERCOCK P, LINDLEY R L, et al. Recombinant tissue plasminogen activator for acute ischaemic stroke:an updated systematic review and meta-analysis[J]. The Lancet, 379: 2364–2372. DOI: 10.1016/S0140-6736(12)60738-7 |
| [23] | CEULEMANS A G, ZGAVC T, KOOIJMAN R, HACHIMI-IDRISSI S, SARRE S, MICHOTTE Y. The dual role of the neuroinflammatory response after ischemic stroke:modulatory effects of hypothermia[J]. J Neuroinflammation, 2010, 7: 74. DOI: 10.1186/1742-2094-7-74 |
| [24] | FERON O. Pyruvate into lactate and back:from the Warburg effect to symbiotic energy fuel exchange in cancer cells[J]. Radiother Oncol, 2009, 92: 329–333. DOI: 10.1016/j.radonc.2009.06.025 |
| [25] | FERNSTROM J D, FERNSTROM M H. Tyrosine, phenylalanine, and catecholamine synthesis and function in the brain[J]. J Nutr, 2007, 137(6 Suppl 1): 1539S–1547S. |
| [26] | MATTHEWS D E. An overview of phenylalanine and tyrosine kinetics in humans[J]. J Nutr, 2007, 137(6 Suppl 1): 1549S–1575S. |
| [27] | FEKSA L, CORNELIO A, VARGAS C, DE SOUZA WYSE A, DUTRA-FILHO C, WAJNER M, et al. Alanine prevents the inhibition of pyruvate kinase activity caused by tryptophan in cerebral cortex of rats[J]. Metab Brain Dis, 2003, 18: 129–137. DOI: 10.1023/A:1023811019023 |
| [28] | ANDERSON C M, PARKINSON F E. Potential signalling roles for UTP and UDP:sources, regulation and release of uracilnucleotides[J]. Trends Pharmacol Sci, 1997, 18: 387–392. DOI: 10.1016/S0165-6147(97)90667-2 |
| [29] | LYNCH C J, ADAMS S H. Branched-chain amino acids in metabolic signalling and insulin resistance[J]. Nat Rev Endocrinol, 2014, 10: 723–736. DOI: 10.1038/nrendo.2014.171 |
| [30] | ROMEI C, RAITERI M, RAITERI L. GABA transporters mediate glycine release from cerebellum nerve endings:roles of Ca2+channels, mitochondrial Na+/Ca2+ exchangers, vesicular GABA/glycine transporters and anion channels[J]. Neurochem Int, 2012, 61: 133–140. DOI: 10.1016/j.neuint.2012.05.005 |
| [31] | NISSEN J D, PA JEĘCKA K, STRIDH M H, SKYTT D M, WAAGEPETERSEN H S. Dysfunctional TCA-cycle metabolism in glutamate dehydrogenase deficient astrocytes[J]. Glia, 2015, 63: 2313–2326. DOI: 10.1002/glia.v63.12 |
| [32] | LIN A Q, SHOU J X, LI X Y, MA L, ZHU X H. Metabolic changes in acute cerebral infarction:findings from proton magnetic resonance spectroscopic imaging[J]. Exp Ther Med, 2014, 7: 451–455. |
| [33] | DEMOUGEOT C, MARIE C, GIROUD M, BELEY A. N-acetylaspartate:a literature review of animal research on brain ischaemia[J]. J Neurochem, 2004, 90: 776–783. DOI: 10.1111/j.1471-4159.2004.02583.x |
| [34] | HOLLENBECK C B. An introduction to the nutrition and metabolism of choline[J]. Cent Nerv Syst Agents Med Chem, 2012, 12: 100–113. DOI: 10.2174/187152412800792689 |
| [35] | TAYEBATI S K, AMENTA F. Choline-containing phospholipids:relevance to brain functional pathways[J]. Clin Chem Lab Med, 2013, 51: 513–521. |
| [36] | ZABLOCKI K, MILLER S P, GARCIA-PEREZ A, BURG M B. Accumulation of glycerophosphocholine (GPC) by renal cells:osmotic regulation of GPC:choline phosphodiesterase[J]. Proc Natl Acad Sci USA, 1991, 88: 7820–7824. DOI: 10.1073/pnas.88.17.7820 |
 2016, Vol. 37
2016, Vol. 37


