2. 上海市浦东新区周浦医院药剂科, 上海 201318
2. Department of Pharmacy, Zhoupu Hospital of Shanghai Pudong New District, Shanghai 201318, China
近年来基因治疗已发展为一种非常有前景的治疗方式。基因治疗是将外源性正常基因导入靶细胞,纠正或补偿因基因缺陷、异常引起的疾病,达到治疗目的。外源基因的导入必须借助一定的方法或载体[1],而良好的基因载体要求材料具有较好的生物相容性、无免疫原性及体内可降解性[2]。
多肽类载体是指各种细胞穿透肽,主要为各种人体必需的氨基酸。多肽类载体在基因治疗中因其具有高效传递、低毒性和易制备的特点而在过去20多年中成为研究热点[3]。研究发现,多肽类载体中的精氨酸表面富集的正电荷可有效地吸附带负电荷的基因物质,形成粒径小、结构稳定而可被细胞摄取的载体/基因复合物,从而成为一种能跨膜转运基因物质的载体[4-6]。
纳米复合物通过细胞内吞作用进入细胞后被内吞体吞噬,进而与溶酶体融合,而基因药物在进入溶酶体后容易被溶酶体中的酶降解,因此,基因物质只有在内吞体和溶酶体中逃逸出来才能发挥作用[7]。研究发现,组氨酸因“质子海绵效应”而具有内吞体逃逸的能力[8],因此本研究采用精氨酸与组氨酸相连的序列连接方式,以达到复合物高效转染、有效逃逸出内吞体的目的。
目前国内非病毒基因载体的研究主要集中于不可生物降解的合成或天然材料,可生物降解的基因载体的研究仍处于起步阶段[9-10]。硫辛酸(lopoic acid, LA)是一种具有分子内五元环二硫键结构和末端羧基的两亲性物质。其分子内二硫键可在半胱氨酸条件下聚合形成具有内部空腔的交联大分子物质,与细胞膜的脂质双分子层亲和力强,具有较好的包载脂溶性药物的作用;且其二硫键可在细胞还原性条件下裂解,为药物在肿瘤部位的有效释放提供条件[11-12]。本研究在聚精氨酸-聚组氨酸(R6H3)的组氨酸末端氨基上修饰LA,并通过LA二硫键的交联形成聚合大分子载体,同时选择人胚肾细胞系HEK293细胞作为实验对象,探讨LA修饰的聚精氨酸载体的DNA转染能力,旨在寻找一种转染能力强、生物相容性好、毒性低的基因载体。
1 材料和方法 1.1 主要仪器及试剂Zeta sizer ZS90粒度测定仪(Malvern公司,英国);JEM-2010透射电镜(JEOL公司,日本);全自动酶标仪(Thermo公司, 美国);荧光显微镜(Leica公司,德国);FACSCalibur流式细胞仪(BD公司,美国),GloMax 20/20发光检测仪(Promega公司,美国);L-组氨酸盐酸盐、L-精氨酸和LA[生工生物工程(上海)股份有限公司];pEGFP、pGL3质粒(上海英为信生物科技有限公司);bPEI (相对分子质量25 000;Sigma公司,美国);BCA蛋白浓度测定试剂盒(Thermo公司,美国);DMEM培养液、胎牛血清(Gibco公司,美国),其他试剂均为分析纯。
1.2 还原性LA修饰的交联聚精氨酸组氨酸(disulfide cross-linked lipoic acid modified polyarginine peptide and histidine, LHRss)多肽的合成与表征(L-R6)(RRRRRR)和H3(HHH)肽及LA在使用芴甲氧羰基保护的前提下用固相多肽合成法合成,并用反相高效液相色谱法(HPLC)进行纯化。采用半胱氨酸盐酸盐进行交联合成LHRss:将LA修饰的聚精氨酸组氨酸(LHR)多肽溶于甲醇中,加入10 mg/mL的半胱氨酸盐酸盐,在室温下聚合12 h,N2吹干甲醇;产物用去离子水经透析膜(截留相对分子质量为3 500)纯化12 h、冻干,去除多余单体。为了优化LHRss的合成,本实验选择4种不同摩尔分数的半胱氨酸(2.5%、5.0%、10.0%、20.0%),所得产物分别命名为LHRss1、LHRss2、LHRss3、LHRss4。用核磁共振氢谱(1H NMR;600 MHz)和凝胶色谱(GPC)进行产物分析。
1.3 LHRss/pDNA纳米复合物的合成与表征取2 μg pDNA (pGL3)和LHRss以不同氮磷比(N/P)自组装形成LHRss/pDNA纳米复合物(图 1),取适量复合物溶于1 mL磷酸盐缓冲液(PBS;19 mmol/L, pH 7.4)中,室温下孵育30 min。用Zeta sizer ZS90粒度测定仪测定纳米复合物的粒径和电位。

|
图 1 LHRss/pDNA纳米复合物示意图 Fig 1 Diagrammatic sketch of LHRss/pDNA nanocomplex |
1.4 LHRss3/pDNA纳米复合物的凝胶阻滞电泳分析
多肽的结合能力用琼脂糖凝胶测定。选择粒径电位分布较为均匀的LHRss3作为研究对象,制备N/P值为0、0.1、1、2.5、5、10、15、20的LHRss3/pGL3纳米复合物,孵育30 min后,将含1 μg pDNA的多肽加入含1%琼脂糖凝胶的TAE缓冲液的孔中,100 V条件下电泳30 min,在紫外光下显像。
1.5 LHRss/pDNA纳米复合物的细胞摄取能力的测定用HEK293细胞(美国ATCC)测定LHRss/pDNA纳米复合物的细胞摄取能力。细胞培养液为含有青霉素、链霉素和10%胎牛血清的DMEM培养液,在5% CO2、37℃培养箱中培养。取HEK293细胞按3×105/孔的密度接种于12孔板,培养24 h后更换为无血清培养液。之后每孔加入含0.75 nmol YOYO-1标记的pDNA (pGL3)的纳米复合物(N/P=40)。培养4 h后去除培养液,消化、离心,并将细胞重悬于300 μL PBS中,用流式细胞仪检测细胞摄取情况。以N/P值为10的bPEI-25K/pGL3进行同样处理作为对照。
1.6 LHRss/pDNA纳米复合物的基因转染情况检测取HEK293细胞按1×105/孔的密度接种于48孔板,培养24 h,转染前更换为无血清培养液。每孔加入含0.5 μg pDNA (pEGFP或pGL3)的不同N/P值的纳米复合物。培养4 h后,换成含10%胎牛血清的培养液。pEGFP转染细胞48 h后,消化细胞并悬浮于300 μL PBS中,用流式细胞仪检测细胞的荧光强度。而pGL3转染细胞48 h后用PBS冲洗,加入200 μL裂解缓冲液(Promega公司,美国)处理30 min;取20 μL细胞裂解物,加入100 μL底物,用GloMax 20/20发光检测仪检测荧光素酶活性。以N/P值为10的bPEI-25K/pDNA (pEGFP或pGL3)进行同样处理作为对照。
1.7 LHRss/pDNA纳米复合物的细胞毒性实验采用CCK-8法评价LHRss/ pGL3纳米复合物对HEK293细胞的细胞毒性。取HEK293细胞按1×104/孔的密度接种于96孔板,孵育24 h。每孔加入不同N/P值的复合物多肽,孵育24 h后更换为含10% CCK-8溶液的新鲜培养液,继续孵育1 h。用酶标仪检测每孔在450 nm处的光密度(D)值。取未经处理的细胞作为对照,并将其存活率记为100%。细胞存活率计算公式:细胞存活率(%)=(D实验组-D空白组) / (D对照组-D空白组) ×100%。
1.8 统计学处理应用SPSS 18.0软件进行统计学分析。数据以x±s表示,组间比较采用方差分析(ANOVA)。检验水准(α)为0.05。
2 结果 2.1 LHRss3多肽的1H NMR和GPC检测结果取合成的多肽类载体LHR溶于D2O中,利用600 MHz 1H NMR检测,选取交联程度较为合适的LHRss3进行分析,图 2为合成的LHRss3的谱图,其中化学位移约为4.8的是D2O溶剂峰;峰a、b、c、e、d、f、l归属于LA部分;峰d、h归属于精氨酸亚甲基;峰j、k来源于组氨酸的咪唑基。不同LHRss的合成条件及相对分子质量如表 1所示,随着半胱氨酸比例的增加,LHRss的相对分子质量逐渐增大,表明复合物多肽成功合成。

|
图 2 LHRss3的1H NMR谱图 Fig 2 1H NMR spectrum of LHRss3 |
|
|
表 1 不同LHRss的合成条件及相对分子质量 Tab 1 Synthesis conditions and relative molecular mass of LHRss at different cross-linked degrees |
2.2 不同交联度条件下不同N/P值复合物的粒径与zeta电位
不同交联度纳米复合物的粒径随着N/P值的增大而降低,当N/P值大于2.5时,LHR/pGL3及不同交联度的LHRss/pGL3纳米复合物的粒径均小于300 nm;当N/P值为20、40时,LHRss1~3/pGL3纳米复合物的平均粒径最好,在70~100 nm之间(图 3A),差异具有统计学意义(P < 0.05)。不同交联度纳米复合物多肽的zeta电位则随着N/P值的增大而增加(图 3B),可能是由于N/P值的增加,导致载体表面的正电荷增加,其包载DNA的能力也随之增强。当N/P≥40时,LHRss3/pGL3及LHRss4/pGL3纳米复合物的zeta电位在30~40 mV之间,符合包载要求。综合粒径、电位的结果可以看出LHRss3在N/P=40时具有较好的粒径电位分布。

|
图 3 不同N/P值LHRss/pGL3复合物的粒径和zeta电位 Fig 3 The size (A) and zeta potential (B) of LHRss/pGL3 nanocomplexes at different N/P ratios |
2.3 不同N/P值LHRss3/pGL3纳米复合物的凝胶阻滞电泳
当N/P值为0.1~2.5时,pGL3不能与LHRss3有效结合,可在电场作用下观察到清晰的条带;而当N/P值为5时未见明显的条带,提示pGL3在电场作用下未发生迁移,表明此时LHRss3能较好地包载pGL3(图 4)。
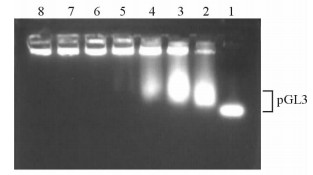
|
图 4 不同N/P值时LHRss3/pGL3复合物的琼脂糖凝胶阻滞电泳图 Fig 4 Agarose gel electrophoresis retardation diagram of LHRss3/pGL3 nanocomplexes at different N/P ratios |
2.4 LHRss/pDNA纳米复合物的细胞摄取能力
利用流式细胞仪观察HEK293细胞对LHRss/YOYO-1 pGL3/pGL3的摄取能力,结果(图 5)显示,HEK293细胞对不同交联度的纳米复合物均具有较好的摄取效率。HEK293细胞对LHRss2/pGL3、LHRss3/pGL3的摄取高于bPEI-25K和LHR,其中LHRss3/pGL3复合物的平均荧光强度约为LHR/pGL3复合物的3.98倍(P < 0.05)。LHRss1/pGL3、LHRss2/pGL3、LHRss3/pGL3和LHRss4/pGL3复合物的平均荧光强度分别是LHR/pGL3复合物的1.28、3.71、3.98、1.22倍。

|
图 5 HEK293细胞对LHRss/pGL3复合物的摄取情况 Fig 5 Cellular uptake of LHRss/pGL3 nanocomplexes by HEK293 cells |
2.5 LHRss/pDNA纳米复合物的基因转染情况
荧光显微镜下观察LHRss/pEGFP纳米复合物的基因转染情况(图 6A),可见单体LHR组细胞的荧光强度较弱,而随着交联度的增加,LHRss/pEGFP复合物作用的细胞的荧光强度逐渐增强,LHRss3/pEGFP组与LHRss4/pEGFP组细胞的荧光强度与bPEI-25K相近。BCA法考察蛋白表达情况,结果显示所合成的纳米载体具有较高的转染效率;其中,在不同N/P条件下时,LHRss3/pGL3组细胞的荧光素酶表达量高于未交联的LHR/pGL3,差异具有统计学意义(P < 0.05,图 6B)。

|
图 6 LHRss/pDNA复合物的体外基因转染效率 Fig 6 In vitro transfection efficiency of LHRss/pDNA nanocomplexes |
2.6 LHRss/pDNA纳米复合物的细胞毒性
与bPEI-25K相比,LHR和不同交联度LHRss空白载体的细胞毒性均较低(P < 0.05),在浓度达到200 μg/mL时仍具有较高的细胞活性,且各组间差异无统计学意义(P>0.05,图 7A)。经LHR/pGL3或不同交联度LHRss/pGL3纳米复合物转染HEK293细胞24 h后,均未见明显的细胞毒性作用;而bPEI-25K浓度达到20 μg/mL时,经bPEI-25K/pGL3转染的细胞活性已降至25%(图 7B),与合成的载体毒性相比差异具有统计学意义(P < 0.05)。表明所合成载体具有良好的生物相容性。
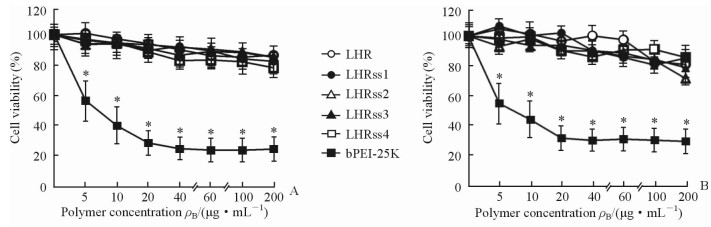
|
图 7 空白载体(A)和LHRss/pGL3复合物(B)对HEK293细胞的细胞毒性 Fig 7 Cytotxiocity of blank polymer (A) and LHRss/pGL3 nanocomplexes (B) on HEK293 cells |
3 讨论
阳离子多肽因其安全性好、转染效率高而成为研究热点。在我们前期研究的基础上,本研究设计合成了一种高效的基因载体,其由6-L-精氨酸、3-L-组氨酸和1-LA通过LA二硫键交联而成;并用这种载体包载DNA,评价DNA是否能被摄取与转染。设计合成的载体LHRss/pDNA复合物粒径根据N/P值及LA交联度的不同而在70~300 nm间变化。与未交联的单体LHR相比,交联纳米复合物的粒径明显减小,这可能是由于随着载体的交联,复合物亲脂性内核结构更加紧密。LA交联度的不同影响复合物的粒径,当半胱氨酸摩尔分数为10%时,复合物具有较为合适的粒径,符合载体/基因复合物在体内应用的要求[13-14]。LHRss/pDNA复合物的zeta电位在N/P值≥2.5时均为正值,可保证基因物质通过静电相互作用被载体包裹;而交联度对复合物的zeta电位影响不大。本研究制备的纳米复合物稳定性好、粒径大小均匀,此粒径大小可充分利用肿瘤的增强渗透滞留效应(enhanced permeability and retention effect, EPR),使纳米复合物富集于靶区[15-16]。在细胞摄取方面,当半胱氨酸量为2.5%~10.0%时,LA交联度显著增加了细胞对复合物的摄取能力,可能是因为LA的交联增强了载体与细胞膜的亲和力,使其更容易进入胞体[17];而当半胱氨酸量达到20.0%时,细胞的摄取下降,可能是由于交联度的增加促使其细胞毒性增加。在基因转染方面,随着LA交联度的增加,LHRss/pEGFP纳米复合物作用的细胞的荧光强度显著增强,绿色荧光蛋白酶的表达也显著升高,其中LHRss3/pGL3在N/P=40时的细胞荧光素酶表达接近于bPEI-25K在N/P=10时的荧光素酶表达,可能是由于LA五元环的交联增加了载体/基因复合物与细胞膜的亲和力,同时二硫键在细胞内还原性条件下裂解释放基因药物,从而达到有效运输和高效释放的目的[18]。对空白载体和载体/基因复合物进行细胞毒性考察,结果发现空白载体和载体/基因复合物均具有较低的细胞毒性。载体质量浓度达到200 μg/mL时,其细胞存活率仍有80%左右;而当bPEI-25K浓度达到20 μg/mL时,其细胞存活率已下降至25%左右。上述研究表明LA的交联可能可以提高细胞的摄取和基因转染能力,其中LHRss3是本研究中最为合适的基因载体。
综上所述,LA修饰提高对于聚精氨酸多肽载体的基因转染能力具有一定的意义。LHRss在体外被证明可有效压缩DNA形成纳米复合物;其在体外培养的HEK293细胞中具有促进pDNA跨膜转运和内吞体逃逸,并最终在细胞内降解的作用,且具有较低的细胞毒性。本研究表明LHRss适合作为一种基因载体应用于多种疾病的研究中,后期我们将进一步开展LHRss作为基因载体包载治疗基因在抗乳腺癌方面的研究。
| [1] | NⅡDOME T, HUANG L. Gene therapy progress and prospects:nonviral vectors[J]. Gene Ther, 2002, 9: 1647–1652. DOI: 10.1038/sj.gt.3301923 |
| [2] | GOVERDHANA S, PUNTEL M, XIONG W, ZIRGER J M, BARCIA C, CURTIN J F, et al. Regulatable gene expression systems for gene therapy applications:progress and future challenges[J]. Mol Ther, 2005, 12: 189–211. DOI: 10.1016/j.ymthe.2005.03.022 |
| [3] | SKOTLAND T, IVERSEN T G, TORGERSEN M L, SANDVIG K. Cell-penetrating peptides:possibilities and challenges for drug delivery in vitro and in vivo[J]. Molecules, 2015, 20: 13313–13323. DOI: 10.3390/molecules200713313 |
| [4] | ZHANG C, TANG N, LIU X, LIANG W, XU W, TORCHILIN V P. siRNA-containing liposomes modified with polyarginine effectively silence the targeted gene[J]. J Control Release, 2006, 112: 229–239. DOI: 10.1016/j.jconrel.2006.01.022 |
| [5] | ZHAO Z X, GAO S Y, WANG J C, CHEN C J, ZHAO E Y, HOU W J, et al. Self-assembly nanomicelles based on cationic mPEG-PLA-b-Polyarginine (R15) triblock copolymer for siRNA delivery[J]. Biomaterials, 2012, 33: 6793–6807. DOI: 10.1016/j.biomaterials.2012.05.067 |
| [6] | LUNDBERG M, WIKSTROM S, JOHANSSON M. Cell surface adherence and endocytosis of protein transduction domains[J]. Mol Ther, 2003, 8: 143–150. DOI: 10.1016/S1525-0016(03)00135-7 |
| [7] | HART S L. Multifunctional nanocomplexes for gene transfer and gene therapy[J]. Cell Biol Toxicol, 2010, 26: 69–81. DOI: 10.1007/s10565-009-9141-y |
| [8] | LEE E S, SHIN H J, NA K, BAE Y H. Poly (L-histidine)-PEG block copolymer micelles and pH-induced destabilization[J]. J Control Release, 2003, 90: 363–374. DOI: 10.1016/S0168-3659(03)00205-0 |
| [9] | LI S, HUANG L. Nonviral gene therapy:promises and challenges[J]. Gene Ther, 2000, 7: 31–34. DOI: 10.1038/sj.gt.3301110 |
| [10] | GAO X, KIM K S, LIU D. Nonviral gene delivery:what we know and what is next[J]. AAPS J, 2007, 9: E92–E104. DOI: 10.1208/aapsj0901009 |
| [11] | ZHONG Y, ZHANG J, CHENG R, DENG C, MENG F H, XIE F, et al. Reversibly crosslinked hyaluronic acid nanoparticles for active targeting and intelligent delivery of doxorubicin to drug resistant CD44+ human breast tumor xenografts[J]. J Control Release, 2015, 205: 144–154. DOI: 10.1016/j.jconrel.2015.01.012 |
| [12] | XU X, JIAN Y, LI Y, ZHANG X, TU Z, GU Z. Bio-inspired supramolecular hybrid dendrimers self-assembled from low-generation peptide dendrons for highly efficient gene delivery and biological tracking[J]. ACS Nano, 2014, 8: 9255–9264. DOI: 10.1021/nn503118f |
| [13] | JIANG W, KIM B Y, RUTKA J T, CHAN W C. Nanoparticle-mediated cellular response is size-dependent[J]. Nat Nanotechnol, 2008, 3: 145–150. DOI: 10.1038/nnano.2008.30 |
| [14] | LUNDQVIST M, STIGLER J, ELIA G, LYNCH I, CEDERVALL T, DAWSON K A. Nanoparticle size and surface properties determine the protein corona with possible implications for biological impacts[J]. Proc Natl Acad Sci USA, 2008, 105: 14265–14270. DOI: 10.1073/pnas.0805135105 |
| [15] | MAEDA H, WU J, SAWA T, MATSUMURA Y, HORI K. Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J]. J Control Release, 2000, 65: 271–284. DOI: 10.1016/S0168-3659(99)00248-5 |
| [16] | FERRARI M. Nanovector therapeutics[J]. Curr Opin Chem Biol, 2005, 9: 343–346. DOI: 10.1016/j.cbpa.2005.06.001 |
| [17] | WEI R, CHENG L, ZHENG M, CHENG R, MENG F, DENG C, et al. Reduction-responsive disassemblable core-cross-linked micelles based on poly (ethylene glycol)-b-poly (N-2-hydroxypropyl methacrylamide)-lipoic acid conjugates for triggered intracellular anticancer drug release[J]. Biomacromolecules, 2012, 13: 2429–2438. DOI: 10.1021/bm3006819 |
| [18] | MIYATA K, KAKIZAWA Y, NISHIYAMA N, HARADA A, YAMASAKI Y, KOYAMA H, et al. Block catiomer polyplexes with regulated densities of charge and disulfide cross-linking directed to enhance gene expression[J]. J Am Chem Soc, 2004, 126: 2355–2361. DOI: 10.1021/ja0379666 |
 2016, Vol. 37
2016, Vol. 37


