近年来,心血管疾病已经成为世界范围内发病率和病死率最高的疾病之一[1]。随着我国社会经济的发展、生活方式和饮食结构的变化、工作及生活压力的增加,冠心病的发病率和病死率呈现持续上升的特点,其中心肌缺血后导致的心力衰竭是冠心病患者高病死率的主要病因。冠心病的传统治疗策略大多只能改善症状,延缓心衰的发展,并不能针对病因逆转心脏组织的损伤[2]。因此寻找新型治疗措施,修复损伤心肌,改善缺血心肌功能,仍然是今后治疗的重要方向。
目前,随着基因工程的飞速发展,基因治疗在人类疾病治疗和预防中的地位越来越重要。而配体修饰的脂质体作为一种新型的基因药物传递系统,已经在靶向性、抵御调理作用等方面取得了很大的成功。PCM (WLSEAGPVVTVRALRGTGSW)是一种由20个氨基酸组成的心肌细胞特异性靶向肽,通过噬菌体展示技术筛选出来。独立的PCM噬菌体与原代心肌细胞的结合能力是对照噬菌体的180倍,且与其他细胞包括其他肌细胞比较,PCM可特异性地与心肌细胞结合[3-5]。以PCM作为配体修饰脂质体, 使脂质体具有心肌靶向性,可将基因药物有效地传递至缺血心肌,达到更有效、更安全的治疗效果。本研究以增强绿色荧光蛋白表达质粒(pEGFP)作为报告基因,配体PCM修饰的脂质体(PCM-LIP)为基因载体,研究脂质体的制备工艺和稳定性,考察PCM-LIP对心肌细胞的转染效率,初步评价PCM-LIP的心肌靶向性。
1 材料和方法 1.1 仪器与试剂RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂),DKZ-450B型电热恒温振荡水槽(上海森信实验仪器有限公司),VC505探头超声仪(Sonics公司,美国),RF-5301pc荧光扫描仪(Shimadzu公司,日本),Zetasizer Nano ZS90型纳米粒度及zeta电位分析仪(Malvern公司,英国),Hitachi-7500透射电镜(Hitachi公司,日本),倒置荧光显微镜(Nikon公司,日本),低温高速离心机(Thermo Scientific公司,美国),流式细胞仪(Becton Dickinson公司,美国),净化工作台(苏州净化设备有限公司),细胞培养箱(Thermo Scientific公司,美国)。
大豆磷脂(Cargill公司,德国),胆固醇(NFC公司,日本),DSPE-mPEG2000(NFC公司,日本),DSPE-PEG2000-Mal (Nanosoft公司,美国),DOTAP (Corden公司,瑞士),PCM (上海吉尔生化有限公司),Sephadex-G50 (Pharmacia公司,美国),荧光胺(阿拉丁试剂),pEGFP (自制),DMEM培养基(Gibco公司,美国),胎牛血清(Gibco公司,美国)。
1.2 未修饰脂质体的制备精密称取一定量的大豆磷脂、胆固醇、DSPE-mPEG2000、DOTAP,使其摩尔比为40:30:10:20,三氯甲烷溶解后,旋转蒸发呈均匀薄膜,真空干燥2 h后,加入2 mL磷酸盐缓冲液(PBS),37℃水浴振荡1 h,水浴超声使脂质膜完全溶解,探头超声(150 W,5 s,5 s) 30次,形成均匀脂质体,用Sephadex-G50柱纯化脂质体。
1.3 PCM修饰脂质体的制备考察PCM的溶解性,PCM不溶于低沸点可抽膜的有机溶剂,可溶于水,所以考虑采用插入法和水相反应法制备DSPE-mPEG2000-PCM。插入法:按1.2项下的方法制备脂质体,另取一定量的DSPE-mPEG2000-Mal溶于三氯甲烷中,采用薄膜分散-超声法制成胶束后,加入PCM室温反应过夜。将制得的胶束加入脂质体中,室温孵育3 h。水相反应法:将一定量的DSPE-mPEG2000-Mal与脂质材料抽膜,按1.2项下的方法制备脂质体后,加入PCM室温搅拌反应3 h。制备不同PCM用量(1%、3%、5%、7%)的PCM-LIP,即1% PCM-LIP、3% PCM-LIP、5% PCM-LIP和7% PCM-LIP,用Sephadex-G50柱纯化脂质体。
1.4 PCM连接率的测定采用改进的荧光胺法测定PCM的连接率[6-7],以PCM连接率为指标,筛选PCM的连接方法。在离心管中加入PCM-LIP和荧光胺乙腈溶液,涡旋振摇,室温避光反应,加甲醇至3 mL,用荧光分光光度计测定其光密度值(Ex=395 nm,Em=475 nm,slit Ex/Em=5 nm/5 nm)。样品通过一系列已知PCM浓度的标准溶液所制备的标准曲线定量。
1.5 载pEGFP脂质体的制备及脂质体载药能力考察取不同体积数的脂质体样品和0.5 μg pEGFP加入不同离心管中,分别用适量PBS稀释,静置2 min后,室温孵育20 min,制备得到不同脂质/DNA比的脂质体/DNA复合物,通过琼脂糖凝胶电泳考察脂质体对pEGFP的载药能力。
1.6 不同PCM用量脂质体的细胞转染效率根据琼脂糖凝胶电泳实验的结果,制备载pEGFP的脂质体。分别取一定体积的未修饰的脂质体、1% PCM-LIP、3% PCM-LIP、5% PCM-LIP和0.5 μg pEGFP加入不同的离心管中,分别用适量的PBS稀释,静置2 min,室温孵育20 min,制备得到不同PCM连接比例的脂质体/DNA复合物,用opti-MEM稀释后用于细胞转染实验。
将H9c2细胞(四川大学生物治疗国家重点实验室蒋维教授惠赠)接种于24孔板内, 待细胞融合度达60%~70%且形态饱满后, 分别加入上述载pEGFP的PCM-LIP。在37℃、5% CO2孵箱中转染5 h后,弃去脂质体悬液,换有血清培养液,继续培养。24 h后,用倒置荧光显微镜定性观察转染效果。另将H9c2细胞接种于6孔板内, 待细胞融合度达70%~80%且形态饱满后, 按上述方法转染载pEGFP的PCM-LIP,收集细胞,用流式细胞仪检测脂质体的转染效率。
1.7 脂质体的形态、粒径、zeta电位的测定取适量载pEGFP的3% PCM-LIP稀释至一定倍数, 滴加在覆有支持膜的铜筛网上,用2%磷钨酸负染,自然干燥后,透射电镜观察形态。另取适量样品稀释一定倍数后,用纳米粒度及zeta电位分析仪测定脂质体的粒径及电位。
1.8 脂质体的稳定性考察制备未修饰的脂质体和3% PCM-LIP,考察脂质体在PBS中的稳定性。将脂质体样品置于4℃冰箱保存,于0 d、30 d时分别测定脂质体的粒径和电位。
1.9 统计学处理应用GraphPad Prism 4.0软件进行统计学分析,数据以x±s形式表式,采用单因素方差分析(ANOVA)。检验水准(α)为0.05。
2 结果 2.1 PCM连接率的测定结果实验发现,7%PCM-LIP无法经凝胶柱有效纯化,因此只能测出1% PCM-LIP、3% PCM-LIP、5% PCM-LIP的PCM连接率。结果如表 1,不同PCM用量的脂质体通过插入法制备得到的PCM连接率均高于通过水相反应法制备得到的PCM连接率,且在这两种方法中,当PCM用量为3%时得到的连接率最高,故选择插入法作为PCM的连接方法,PCM用量为3%。
|
|
表 1 PCM不同连接方法的连接率 Tab 1 The PCM connection ratio of PCM-LIPs of different connection modes |
2.2 脂质体载药能力考察结果
首先分别考察了1、2、5、10 μL的未修饰的脂质体对pEGFP的载药能力,结果如图 1A所示,5 μL的脂质体可将pEGFP载带完全。进一步考察了5 μL不同PCM用量的脂质体对pEGFP的载药能力,结果如图 1B,5 μL不同PCM用量的脂质体都可将pEGFP载带完全。
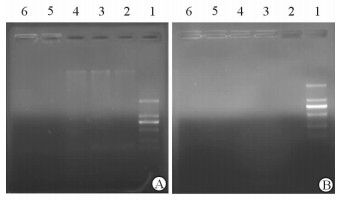
|
图 1 脂质体对pEGFP载药能力的测定 Fig 1 Determination of pEGFP encapsulation ability of liposomes (LIPs) |
2.3 不同PCM用量脂质体的细胞转染效率
图 2显示了不同PCM用量脂质体转染H9c2细胞的转染效率,可见PCM-LIP的转染效率均高于未修饰的脂质体,且当PCM的用量为3%时,细胞的绿色荧光最高,脂质体的转染效率最高。

|
图 2 载pEGFP的脂质体在H9c2细胞中的表达 Fig 2 Expression of pEGFP carried by liposomes (LIPs) in H9c2 cells |
2.4 不同PCM用量的脂质体的细胞转染效率的定量测定
图 3显示了不同PCM用量脂质体转染H9c2细胞的流式细胞仪检测结果,可见3% PCM-LIP的转染效率最高。结合连接率测定结果和细胞转染效率的定性观察结果,筛选得到的PCM最佳用量为3%。

|
图 3 载pEGFP的脂质体转染H9c2细胞的流式细胞术测定结果 Fig 3 The flow cytometry assay of H9c2 cells transfected with liposomes (LIPs) containing pEGFP |
2.5 脂质体的形态、粒径、zeta电位
透射电镜图(图 4)显示载pEGFP的3%PCM-LIP呈圆球形。载pEGFP的未修饰的脂质体粒径为(212.4±3.0) nm,载pEGFP的3% PCM-LIP粒径为(261.9±2.2) nm,连接PCM后脂质体的粒径增大;两种脂质体多分散系数(PDI)均在0.2左右[(0.20±0.01) vs (0.19±0.01)],zeta电位分别为(-4.3±0.6) mV和(-5.0±0.6) mV,说明PCM的连接对脂质体电位无明显影响。

|
图 4 载pEGFP的3% PCM-LIP透射电镜图 Fig 4 TEM of 3% PCM-LIP containing pEGFP |
2.6 脂质体的稳定性考察结果
新制备的PCM-LIP (3% PCM-LIP)的粒径为(261.9±2.2) nm,zeta电位为(-5.0±0.6) mV,PDI为(0.19±0.01)。-4℃放置30 d后,粒径为(267.4±1.9) nm,zeta电位为(-5.3±0.1) mV,PDI为(0.20±0.01)。结果表明PCM-LIP在-4℃下放置30 d,脂质体的粒径、zeta电位和PDI无明显变化,说明脂质体在PBS中有较好的稳定性。
3 讨论缺血性心脏病严重威胁着人类生命健康和生活质量,目前国内外公认的疗法有药物治疗、介入治疗和外科手术治疗3种。这些治疗方法在一定程度上可以减轻症状,但并不能针对病因逆转心脏组织的损伤。基因治疗是将目的基因用一定的手段导入患者特定的组织和细胞并进行适当的表达,以补偿或纠正因基因缺陷或异常而引起的疾病,从而达到治疗疾病的目的[8]。基因治疗与传统治疗方法相比有巨大的优越性,它从根源上纠正了引起疾病的异常基因,可以选择性地治疗多种严重威胁人类健康的疾病[9]。目前用于传递基因药物的系统有病毒载体和非病毒载体两大类,其中脂质体由于具有低毒、低免疫反应、靶向性和易于组装等优点,已经成为基因治疗领域中一个新的研究热点[10]。
本研究采用薄膜分散-超声法,以pEGFP为报告基因制备PCM-LIP,筛选出PCM的最佳连接方法为插入法,最佳用量为3%,测定PCM的连接率最高可达95%以上。PCM的连接率不是随着PCM用量的提高而提高,这与相关文献得到的结论相同:随着预插入量的增多,插入效率的下降和插入量增加有逐渐变缓趋势[11]。通过凝胶阻滞实验测定了脂质体的载药能力,5 μL的脂质体可将0.5 μg的pEGFP质粒载带完全。制备得到的载质粒的PCM-LIP形态圆整,粒径为(261.9±2.2) nm,zeta电位为(-5.0±0.6) mV,粒径和电位是考察脂质体稳定性的重要指标[12-13],由于本研究制备的PCM-LIP存放于PBS中,因此考察了PCM-LIP在PBS中的稳定性,实验表明该脂质体在PBS中具有良好的稳定性。通过倒置荧光显微镜和流式细胞仪定性和定量地考察了PCM-LIP对心肌细胞的转染效率,结果表明PCM-LIP相比于未修饰的普通脂质体具有明显的心肌细胞靶向性,且筛选得到的PCM最佳用量为3%。脂质体转染效率不是随着PCM的用量提高而提高,有两方面原因,一方面当PCM用量为5%时,PCM的连接量与PCM用量为3%时相差不多,另一方面是脂质体表面修饰的构象和密度等因素,对脂质体本身的特性及其靶向效果都有很大的影响[14-15],其中具体的相互关系国内外文献都尚无定论。本研究制备的PCM-LIP有望成为一种新的靶向心肌的基因传递系统,但尚待进一步考察其体内靶向性、载目的基因后的抗心肌缺血活性和安全性, 以全面检验脂质体的基因传递能力。
| [1] | LIU M, LI M, SUN S, LI B, DU D, SUN J, et al. The use of antibody modified liposomes loaded with AMO-1 to deliver oligonucleotides to ischemic myocardium for arrhythmia therapy[J]. Biomaterials, 2014, 35: 3697–3707. DOI: 10.1016/j.biomaterials.2013.12.099 |
| [2] | WHELAN R S, KAPLINSKIY V, KITSIS R N. Cell death in the pathogenesis of heart disease:mechanisms and significance[J]. Annu Rev Physiol, 2010, 72: 19–44. DOI: 10.1146/annurev.physiol.010908.163111 |
| [3] | MCGUIRE M J, SAMLI K N, JOHNSTON S A, BROWN K C. In vitro selection of a peptide with high selectivity for cardiomyocytes in vivo[J]. J Mol Biol, 2004, 342: 171–182. DOI: 10.1016/j.jmb.2004.06.029 |
| [4] | NAM H Y, KIM J, KIM S W, BULL D A. Cell targeting peptide conjugation to siRNA polyplexes for effective gene silencing in cardiomyocytes[J]. Mol Pharm, 2012, 9: 1302–1309. |
| [5] | WON Y W, BULL D A, KIM S W. Functional polymers of gene delivery for treatment of myocardial infarct[J]. J Control Release, 2014, 195: 110–119. DOI: 10.1016/j.jconrel.2014.07.041 |
| [6] | YAYLAYAN V A, HUYGHUES-DESPOINTES A, POLYDORIDES A. A fluorescamine-based assay for the degree of glycation in bovine serum albumin[J]. Food Res Int, 1992, 25: 269–275. DOI: 10.1016/0963-9969(92)90123-M |
| [7] | BELAL F, ABDINE H, AL-MAJED A, KHALIL N Y. Spectrofluorimetric determination of vigabatrin and gabapentin in urine and dosage forms through derivatization with fluorescamine[J]. J Pharm Biomed Anal, 2002, 27: 253–260. DOI: 10.1016/S0731-7085(01)00503-9 |
| [8] | TROS DE ILARDUYA C, SUN Y, DVZGVNES N. Gene delivery by lipoplexes and polyplexes[J]. Eur J Pharm Sci, 2010, 40: 159–170. DOI: 10.1016/j.ejps.2010.03.019 |
| [9] | 李燕, 阳俊, 刘桂英, 张欣. 基因治疗药物输递系统的研究现状及发展趋势[J]. 生物化学与生物物理进展, 2013, 40: 998–1007. |
| [10] | 江献芳, 周诺. 脂质体在基因治疗中的应用研究及进展[J]. 中国组织工程研究, 2012, 16: 1463–1466. |
| [11] | 周正源, 唐海玲, 徐宇虹. 多肽靶向脂质体的表面配体修饰密度及其体内肿瘤靶向效果的研究[J]. 生物物理学报, 2010, 26: 216–224. |
| [12] | SHARMA G, MODGIL A, LAYEK B, ARORA K, SUN C, LAW B, et al. Cell penetrating peptide tethered bi-ligand liposomes for delivery to brain in vivo:biodistribution and transfection[J]. J Control Release, 2013, 167: 1–10. DOI: 10.1016/j.jconrel.2013.01.016 |
| [13] | 袁松, 孙会敏, 丁丽霞. 脂质体物理化学稳定性研究进展[J]. 中国药事, 2011, 25: 384–388. |
| [14] | ALLEN T M, SAPRA P, MOASE E. Use of the post-insertion method for the formation of ligand-coupled liposomes[J]. Cell Mole Biol Lett, 2002, 7: 217–219. |
| [15] | MOREIRA J N, ISHIDA T, GASPAR R, ALLEN T M. Use of the post-insertion technique to insert peptide ligands into pre-formed stealth liposomes with retention of binding activity and cytotoxicity[J]. Pharm Res, 2002, 19: 265–269. DOI: 10.1023/A:1014434732752 |
 2016, Vol. 37
2016, Vol. 37


