2. 河北北方学院第一附属医院普外科, 张家口 075000
2. Department of General Surgery, The First Affiliated Hospital of Hebei North University, Zhangjiakou 075000, Hebei, China
胰腺实性-假乳头瘤(solid-pseudopapillary neoplasm of pancreas, SPNP)是一种少见的、伴有低度恶性潜能的胰腺肿瘤,1959年由Frantz[1]首次报道,并于1996年由世界卫生组织(WHO)正式命名。SPNP的发病率低,约占所有胰腺外分泌肿瘤的0.9%~2.7%,肿瘤质地可为实性或囊实性[2]。该病主要见于青年女性,平均发病年龄约为22岁,肿瘤多局限于胰腺内,且胰体尾部较头颈部多见[3],其组织起源及发病机制尚不清楚,术式选择由肿瘤位置、大小及与周围组织的关系决定。过去SPNP通常被认定为交界性肿瘤,然而部分病例表现出血管侵犯、肝转移等恶性肿瘤特征[2],2010年WHO将其归类为低度恶性肿瘤[4]。既往研究表明,细胞异型性、核分裂活性、胰腺实质及周围组织浸润、包膜侵犯及淋巴转移等组织病理学特点与其恶性潜能相关[5-7]。约10%~15%的SPNP在生长过程中可发生肝转移而导致预后不良甚至死亡[8]。病例荟萃分析结果显示,除胰头部SPNP压迫胆总管导致梗阻性黄疸外,该病缺乏特异的临床表现及实验室检查指标,发生肝转移的SPNP患者肿瘤标记物检查也大多正常[9]。因此,尽管SPNP的恶性程度及复发转移率较导管腺癌和神经内分泌癌等胰腺肿瘤低,但仍值得临床医师高度重视。
随着对该疾病认识的逐渐加深,近年来有关SPNP的报道,特别是对其病理特征和免疫组化特征的研究日益增多,但其中大多数研究样本量较小,且较少有对SPNP的术式选择进行总结对比。本研究回顾性分析了第二军医大学长海医院胰腺外科的51例SPNP手术患者的临床及病理资料,旨在总结SPNP的临床特点及术式选择,探寻与镜下高度侵袭性病理学表现相关的临床因素,进一步提高对该病的认识。
1 资料和方法 1.1 病例资料收集2008年9月至2012年6月第二军医大学长海医院胰腺外科收治的51例经病理证实的SPNP患者的临床及病理资料,包括患者的性别、年龄、临床表现、术前检查、治疗方法、术后并发症、病理结果及随访情况等。临床及病理数据获自于患者病历资料,随访情况通过门诊及电话回访获得。
1.2 方法所有病例均完成常规术前检查,排除明显手术禁忌证后均行手术治疗。根据SPNP是否具有侵袭性病理学表现,对51例患者的病理结果进行审核分类,筛选出具有镜下侵袭性病理表现的SPNP病例。根据病理检查及影像学描述,将所有切除的肿瘤分为实性组和囊实性组。根据国际胰腺疾病研究小组(ISGPS)术后并发症标准定义胰瘘、胃排空障碍。新发糖尿病指既往无糖尿病史,胰腺术后新发糖尿病。消化功能紊乱指术后出现长期腹泻、脂肪泻,需口服胰酶治疗。
1.3 统计学处理应用SPSS 21.0软件进行数据分析。计量资料用x±s表示,计数资料以百分比表示。计数变量组间比较采用χ2检验,如有理论频数 < 10,采用Fisher精确概率法分析;如为连续变量,用Kruskal-Wallis秩和检验。检验水准(α)为0.05。
2 结果 2.1 一般资料及临床表现本组51例SPNP患者中,女性45例、男性6例(7.5:1),平均发病年龄33.5±10.8(8~53)岁。首发症状为腹部疼痛16例(31.4%)、饱胀不适7例(13.7%)、腹部扪及包块3例(5.9%)、恶心呕吐3例(5.9%)及无症状体检发现22例(43.1%)。2例既往有胰腺炎病史,1例为胃肠吻合术后。1例因误诊为胰腺癌,术前行吉西他滨单药化疗2次、放射治疗1次。
2.2 影像学检查及实验室检查本研究中较多使用的影像学检查方式是腹部超声(86.3%,44/51)及上腹部增强CT (86.3%,44/51),其余包括MRI检查(31.4%,16/51)、PET/CT (5.9%,3/51)、超声内镜(17.6%,9/51)等,部分患者行2~3项上述检查。肿瘤直径6.3±5.8(1~37.8) cm;位于胰头者12例(23.5%)、胰颈部14例(27.5%)、胰体尾部25例(49.0%),其中3例侵犯门静脉/肠系膜上静脉。11例伴有钙化,7例主胰管扩张,2例胆总管扩张。肿瘤质地实性为主者23例,囊实性者28例。51例患者中,仅1例侵犯门静脉的巨大胰体尾SPNP (直径37.8 cm)患者的CA19-9水平轻度升高,余50例术前肿瘤标记物CEA、CA19-9及CA125水平均在正常范围内。术前SPNP诊断率为56.9%(29/51),误诊疾病包括黏液性囊腺瘤(MCN)13例、无功能神经内分泌瘤(NF-PNET)6例、假性囊肿(PPs)2例及胰腺癌(PC)1例。
2.3 手术方式51例患者全部行手术治疗。21例行脾+胰体尾切除术(distal pancreatectomy, DP),7例行保脾胰体尾切除术(spleen-preserving distal pancreatectomy, SPDP),7例行胰腺节段切除术(middle segmental pancreatectomy, MSP),6例行肿瘤局部切除术(local resection, LR),5例行胰十二指肠切除术(pancreaticoduodenectomy, PD),5例行保留幽门胰十二指肠切除术(pylorus-preserving pancreatoduodenectomy, PPPD);其中1例胰头部肿瘤行局部切除,2例胰颈部肿瘤行胰颈体尾切除。此外,1例联合左侧肾上腺部分切除,3例因侵犯门静脉行门静脉、肠系膜上静脉部分切除重建,1例因合并肝右后叶血管瘤行部分肝切除术。将上述术式的手术细节及患者近、远期并发症情况进行对比,结果见表 1。
|
|
表 1 不同术式手术情况及患者近、远期并发症的比较 Tab 1 Comparison of surgical data and complications between different surgical strategies |
2.4 病理检查结果
本组所有切除肿瘤均经病理学检查证实为SPNP (图 1)。51例患者中,最小肿瘤直径为1 cm,最大为37.8 cm,平均(6.3±5.8) cm。其中15例显示出高度侵袭性病理学表现,包括胰腺实质浸润11例、细胞异型性9例、周围神经浸润4例、包膜侵犯1例,未见肝转移及脉管癌栓,部分患者具有2项或以上侵袭性病理学表现。3例侵犯门静脉行门静脉切除重建的患者中,胰腺实质浸润1例、周围神经浸润1例,余1例未见侵袭性病理学表现。淋巴结检出数为(5.8±4.9)枚,均为反应性增生。根据肿瘤质地,将51例肿瘤分为实性组(n=23)及囊实性组(n=28)。采用病例-对照方法分析肿瘤质地与侵袭性病理学表现的相关性。结果表明,实性肿瘤与胰腺实质浸润(P<0.01)、细胞异型性(P<0.01)及周围神经浸润(P<0.05)等侵袭性病理学表现相关,见表 2。
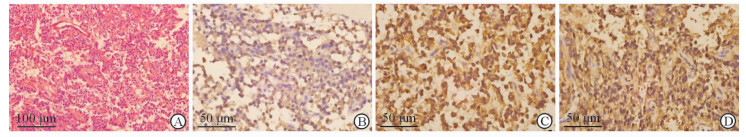
|
图 1 H-E染色及免疫组织化学检查 Fig 1 Hematoxylin-eosin (H-E) staining and immunohistochemistry examination |
|
|
表 2 肿瘤质地与侵袭性病理学表现的相关性 Tab 2 Correlation of tumor texture with pathological manifestations |
2.5 术后并发症及随访
51例患者术后住院时间为8~29 d,平均(15.2±5.4) d,无院内死亡。11例患者出现临床相关胰瘘,5例发生胃排空障碍。此外,切口感染3例,腹腔感染7例,肺部感染2例,尿潴留1例。以上患者均经保守治疗治愈,无二次手术。远期并发症包括新发糖尿病11例,消化功能紊乱15例。1例发生胰腺炎,1例发生肠梗阻,均经禁食、胃肠减压、营养支持及抗感染等保守治疗方法治愈。部分并发症由于例数过少,未进行对照研究。51例患者中失访6例, 余45例患者随访26~74个月,包括3例门静脉侵犯在内的所有患者均未行术后放化疗,随访期内均存活且无复发或转移证据。
3 讨论SPNP是较为少见的肿瘤,过去由于命名不统一,亦被称为乳头状囊性肿瘤、乳头状囊性上皮性肿瘤、囊实性肿瘤、假乳头状肿瘤等[10]。SPNP的发病机制尚未完全清晰,有研究者认为SPNP的发生可能与β-catenin基因突变导致的Wnt信号通路中断有关[11]。
该病腹痛及腹部不适是最常见的临床表现,约15.6%~43.9%的SPNP患者无明显临床表现,这部分患者多在体检或治疗其他疾病过程中偶然发现[3-4, 9]。由于SPNP是一种无功能性、生长缓慢的外生性肿瘤,因此梗阻性黄疸及胰管扩张并不常见[12]。肿瘤可发生于胰腺任何部位,以胰体尾部较为常见,个别病例可出现多发肿瘤,胰腺外SPNP较为罕见。SPNP平均直径多>5 cm,肝功能、血淀粉酶、肿瘤标记物大多处于正常范围内,个别患者肿瘤标记物检查可出现异常。本研究结果与以往研究[3, 9]结果基本一致。
SPNP的临床诊断主要依靠好发年龄、性别、超声及CT或MRI特征性表现,最终经病理检查确诊。该肿瘤大体表现为圆形或椭圆形,外被纤维包膜,界限清晰,切面由囊性、实性成分以不同比例构成,可见钙化和出血[13]。典型镜下表现为由肿瘤细胞围绕微血管形成假乳头结构,细胞形态统一,核呈圆形或椭圆形,核分裂相对罕见,可见嗜酸性颗粒、泡沫细胞、胆固醇结晶[14]。侵袭性病理学表现包括细胞异型性、核分裂活跃、包膜侵犯、胰腺实质及周围组织浸润、周围神经浸润、淋巴侵犯等。
腹部超声是SPNP临床最常用的影像学筛查手段,其可诊断直径 < 5 cm的SPNP,但对医师的临床经验要求较高。SPNP超声检查主要表现为实性为主伴局灶囊性变,或内缘不规则的厚壁囊实性肿物等[15]。SPNP的典型CT征象为单发的、边界清晰、包膜良好、质地不均的占位性病变,可伴囊内出血,约1/3的患者可见不规则钙化[16]。MRI则可更好地显示囊内出血等特征。相比于超声,腹部增强CT及MRI在诊断SPNP上具有独特优势,如增强CT和MRI可更为明确地显示出包膜及瘤内出血等征象[12, 17],这在与其他胰腺肿瘤相鉴别时极为关键。CT及MRI恶性表现包括侵犯大血管、肝转移等。其他可选的影像学检查包括PET/CT及超声内镜(EUS)。有研究报道,18氟化脱氧葡萄糖PET/CT (18FDG PET/CT)可反映肿瘤细胞性质、增殖指数及恶性组织学表现[18],而EUS引导下细针穿刺活检术(EUS-FNA)可提供细胞学诊断证据[19],进而与胰腺导管腺癌等高度恶性胰腺肿瘤相鉴别以避免过大的术式。本研究中较多使用的影像学检查方式有腹部超声(86.3%)、增强CT (86.3%)和MRI (31.4%),SPNP术前诊断率达56.9%,误诊疾病有MCN、NF-PNET、PPs等良性占位,可与胰腺癌进行鉴别。由于高昂的费用及有创性,不推荐常规行PET/CT及EUS-FNA检查。
SPNP为具有侵袭及转移潜能的低度恶性肿瘤,即使发生浸润、复发或远处转移,在完全切除(R0)的情况下可获得极好的预后,因此手术治疗是目前SPNP的首选治疗方法。一项多中心研究表明,351例行手术切除的SPNP患者中,仅9例(2.6%)出现术后复发[4]。SPNP术后2年总体生存率近97%,5年生存率达95%以上。因此,即使肿瘤巨大、侵犯周围脏器或血管,也应积极行手术治疗。本研究中1例胰体尾SPNP患者肿瘤直径达37.8 cm,因侵犯门静脉行胰体尾+脾切除术+门静脉、肠系膜上静脉部分切除术+人造血管移植,病理检查可见肿瘤细胞深度侵犯胰腺实质,术后亦获得良好预后。有研究发现对包括SPNP在内的良性或低度恶性胰腺肿瘤而言,较小的术式往往可使患者获得更好的预后及生活质量[20]。本研究所有病例的术式选择除依据肿瘤位置、大小及与周围组织关系外,基本原则为在保证R0的基础上,尽可能多地保留正常胰腺组织及消化道连续性。对于胰头部肿瘤,如肿瘤体积较小且无幽门侵犯可行PPPD;肿瘤位于胰体尾部者,如术中发现肿瘤局限于胰腺内且无周围组织侵犯则可行MSP或DP。此外,术中冰冻病理学检查亦有助于术式的选择,若根据影像学检查及术中评估为距离主胰管有一定距离且包膜完整的外向生长型肿瘤,术中冰冻病理学检查证实为SPNP,则应做肿瘤局部切除而非较大的PD或DP。本研究平均淋巴结清除数为(5.8±4.9)枚,病理证实均为反应性增生。既往文献报道SPNP淋巴结转移率极低(0.3%)[4],因此不推荐常规行淋巴结清扫,但术野可见的肿大淋巴结可一并切除。
既往研究表明,与PD相比,PPPD并未显著增加胃排空障碍的发生率[21],并在患者长期营养状态上更具优势[22]。与DP相比,SPDP术后患者较少发生严重并发症及血液指标异常[23]。对于胰颈体尾部肿瘤,由于肿瘤剜除术或MSP保留了更多的胰腺,在胰腺术后新发糖尿病及生活质量方面要优于传统的胰体尾切除,且围手术期并发症并未显著增加[24]。本研究中较小术式组(PPPD、SPDP、MSP及LR)与较大术式组(PD、DP)在手术时间、估计失血量、术中输血量、住院时间及并发症等方面差异均无统计学意义。在远期预后方面,MSP和LR保留了更多的正常胰腺组织,胰腺内外分泌功能受损较小,因此新发糖尿病及消化功能紊乱发生率(4/13,30.8%)低于DP和SPDP组(17/28,60.7%)。
尽管术后复发率、转移率低,SPNP患者仍需长期随访观察。SPNP术后复发高危因素的病理表现包括胰腺实质浸润、周围神经侵犯及血管浸润等[25]。为探索肿瘤质地与其病理学表现的相关性,本研究将51例SPNP根据大体及病理描述分为实性组与囊实性组并行病例-对照分析。结果显示实性肿瘤与胰腺实质浸润(P<0.01)、细胞异型性(P<0.01)及周围神经浸润(P<0.05)等侵袭性病理学表现相关。本组15例具有侵袭性病理学表现的患者在随访期内虽未发现复发或转移,但仍建议该部分患者坚持定期复查。目前尚无研究支持SPNP术后需辅助化疗或放疗。
对于不可切除的肿瘤及肝转移病例,可试用新辅助放化疗。Martin等[2]报道1例伴有肝转移的SPNP患者在应用完整疗程的5-氟尿嘧啶、多柔比星、链脲佐菌素、干扰素、顺铂及托泊替康治疗后并无明显疗效。而Maffuz等[26]报道,不可切除的SPNP患者在应用吉西他滨后肿瘤体积明显减小。Rebhandl等[27]报道1例因伴有转移而仅行原发肿瘤切除的女性SPNP患者,在应用异环磷酰胺、顺铂、VP16后获得较好预后。Fried等[28]研究发现,放射治疗使局部晚期的不可切除SPNP体积明显缩小,随访3年后肿瘤仍无转移迹象。此后,Zauls等[29]研究发现放射治疗仅使肿瘤体积稍减,但腹痛症状明显好转。然而,上述研究均为小样本量的病例报道,对不可切除SPNP的治疗仅有提示作用,目前尚无明确治疗标准。
综上所述,SPNP是一种少见的好发于青中年女性的低度恶性肿瘤。临床表现多无特异性,肿瘤标记物等实验室检查多无异常,且约40%的患者无任何临床表现,提示应以B超为主要手段行定期体检。CT和MRI可提供较好的SPNP术前诊断,而确诊有赖于病理结果。治疗以手术为主,术式选择在保证R0的基础上以较小术式为优;但对于周围组织有明显侵犯者应视情况扩大切除范围。此外,实性肿瘤质地与胰腺实质及周围神经浸润2项复发高危因素相关,提示该部分患者需长期密切随访。
| [1] | FRANTZ V K. Atlas of tumor pathology[M]. Washington, DC: US Armed Forces Institute of Pathology, 1959: 32-33. |
| [2] | MARTIN R C, KLIMSTRA D S, BRENNAN M F, CONLON K C. Solid-pseudopapillary tumor of the pancreas:a surgical enigma?[J]. Ann Surg Oncol, 2002, 9: 35–40. DOI: 10.1245/aso.2002.9.1.35 |
| [3] | PAPAVRAMIDIS T, PAPAVRAMIDIS S. Solid pseudopapillary tumors of the pancreas:review of 718 patients reported in English literature[J]. J Am Coll Surg, 2005, 200: 965–972. DOI: 10.1016/j.jamcollsurg.2005.02.011 |
| [4] | KANG C M, CHOI S H, KIM S C, LEE W J, CHOI D W, KIM S W. Korean Pancreatic Surgery Club. Predicting recurrence of pancreatic solid pseudopapillary tumors after surgical resection:a multicenter analysis in Korea[J]. Ann Surg, 2014, 260: 348–355. DOI: 10.1097/SLA.0000000000000583 |
| [5] | CANZONIERI V, BERRETTA M, BUONADONNA A, LIBRA M, VASQUEZ E, BARBAGALLO E, et al. Solid pseudopapillary tumour of the pancreas[J]. Lancet Oncol, 2003, 4: 255–256. DOI: 10.1016/S1470-2045(03)01038-6 |
| [6] | NISHIHARA K, NAGOSHI M, TSUNEYOSHI M, YAMAGUCHI K, HAYASHI I. Papillary cystic tumors of the pancreas[J]. Cancer, 1993, 71: 82–92. DOI: 10.1002/(ISSN)1097-0142 |
| [7] | SHIMIZU M, MATSUMOTO T, HIROKAWA M, MONOBE Y, IWAMOTO S, TSUNODA T, et al. Solid-pseudopapillary carcinoma of the pancreas[J]. Pathol Int, 1999, 49: 231–234. DOI: 10.1046/j.1440-1827.1999.00852.x |
| [8] | CHUNG Y E, KIM M J, CHOI J Y, LIM J S, HONG H S, KIM Y C, et al. Differentiation of benign and malignant solid pseudopapillary neoplasms of the pancreas[J]. J Comput Assist Tomogr, 2009, 33: 689–694. DOI: 10.1097/RCT.0b013e31818f2a74 |
| [9] | YU P F, HU Z H, WANG X B, GUO J M, CHENG X D, ZHANG Y L, et al. Solid pseudopapillary tumor of the pancreas:a review of 553 cases in Chinese literature[J]. World J Gastroenterol, 2010, 16: 1209–1214. DOI: 10.3748/wjg.v16.i10.1209 |
| [10] | 寇晓霞, 袁振刚, 钱其军. 胰腺囊实性假乳头状肿瘤11例临床病理分析[J]. 中华胰腺病杂志, 2015, 15: 336–337. |
| [11] | CLEVERS H. Wnt/β-catenin signaling in development and disease[J]. Cell, 2006, 127: 469–480. DOI: 10.1016/j.cell.2006.10.018 |
| [12] | CANTISANI V, MORTELE K J, LEVY A, GLICKMAN J N, RICCI P, PASSARIELLO R, et al. MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients[J]. AJR Am J Roentgenol, 2003, 181: 395–401. DOI: 10.2214/ajr.181.2.1810395 |
| [13] | YANG F, JIN C, LONG J, YU X J, XU J, DI Y, et al. Solid pseudopapillary tumor of the pancreas:a case series of 26 consecutive patients[J]. Am J Surg, 2009, 198: 210–215. DOI: 10.1016/j.amjsurg.2008.07.062 |
| [14] | GOH B K, TAN Y M, CHEOW P C, CHUNG A Y, CHOW P K, WONG W K, et al. Solid pseudopapillary neoplasms of the pancreas:an updated experience[J]. J Surg Oncol, 2007, 95: 640–644. DOI: 10.1002/(ISSN)1096-9098 |
| [15] | JIANG L, CUI L, WANG J, CHEN W, MIAO L, JIA J. Solid pseudopapillary tumors of the pancreas:findings from routine screening sonographic examination and the value of contrast-enhanced ultrasound[J]. J Clin Ultrasound, 2015, 43: 277–282. DOI: 10.1002/jcu.v43.5 |
| [16] | CHANG H, GONG Y, XU J, SU Z, QIN C, ZHANG Z. Clinical strategy for the management of solid pseudopapillary tumor of the pancreas:aggressive or less?[J]. Int J Med Sci, 2010, 7: 309–313. |
| [17] | CHOI J Y, KIM M J, KIM J H, KIM S H, LIM J S, OH Y T, et al. Solid pseudopapillary tumor of the pancreas:typical and atypical manifestations[J]. AJR Am J Roentgenol, 2006, 187: 178–186. DOI: 10.2214/AJR.05.0569 |
| [18] | DONG A, WANG Y, DONG H, ZHANG J, CHENG C, ZUO C. FDG PET/CT findings of solid pseudopapillary tumor of the pancreas with CT and MRI correlation[J]. Clin Nucl Med, 2013, 38: e118–e124. DOI: 10.1097/RLU.0b013e318270868a |
| [19] | PARK H Y, LEE Y J, LEE J H, LEE M J, LEE J K, LEE K T, et al. Endoscopic ultrasound-guided fine needle aspiration of solid pseudopapillary tumors of the pancreas:a report of three cases[J]. Korean J Intern Med, 2013, 28: 599–604. DOI: 10.3904/kjim.2013.28.5.599 |
| [20] | LI Z, ZHANG Z, LIU X, HU W, MAI G, ZHANG Y, et al. Solid pseudopapillary tumor of the pancreas:the surgical procedures[J]. Surg Today, 2011, 41: 91–96. DOI: 10.1007/s00595-009-4225-0 |
| [21] | TRAN K T, SMEENK H G, VAN EIJCK C H, KAZEMIER G, HOP W C, GREVE J W, et al. Pylorus preserving pancreaticoduodenectomy versus standard Whipple procedure:a prospective, randomized, multicenter analysis of 170 patients with pancreatic and periampullary tumors[J]. Ann Surg, 2004, 240: 738–745. DOI: 10.1097/01.sla.0000143248.71964.29 |
| [22] | NIEDERGETHMANN M, SHANG E, FARAG SOLIMAN M, SAAR J, BERISHA S, WILLEKE F, et al. Early and enduring nutritional and functional results of pylorus preservation vs classic Whipple procedure for pancreatic cancer[J]. Langenbecks Arch Surg, 2006, 391: 195–202. DOI: 10.1007/s00423-005-0015-3 |
| [23] | TANG C W, FENG W M, BAO Y, FEI M Y, TAO Y L. Spleen-preserving distal pancreatectomy or distal pancreatectomy with splenectomy?:perioperative and patient-reported outcome analysis[J]. J Clin Gastroenterol, 2014, 48: e62–e66. DOI: 10.1097/MCG.000000000000021 |
| [24] | ADHAM M, GIUNIPPERO A, HERVIEU V, COURBIÈRE M, PARTENSKY C. Central pancreatectomy:single-center experience of 50 cases[J]. Arch Surg, 2008, 143: 175–181. DOI: 10.1001/archsurg.2007.52 |
| [25] | 中华医学会外科学分会胰腺外科学组. 胰腺囊性疾病诊治指南(2015版)[J]. 中国实用外科杂志, 2015, 35: 955–959. |
| [26] | MAFFUZ A, BUSTAMANTE FDE T, SILVA J A, TORRES-VARGAS S. Preoperative gemcitabine for unresectable, solid pseudopapillary tumour of the pancreas[J]. Lancet Oncol, 2005, 6: 185–186. DOI: 10.1016/S1470-2045(05)01770-5 |
| [27] | REBHANDL W, FELBERBAUER F X, PUIG S, PAYA K, HOCHSCHORNER S, BARLAN M, et al. Solid-pseudopapillary tumor of the pancreas (Frantz tumor) in children:report of four cases and review of the literature[J]. J Surg Oncol, 2001, 76: 289–296. DOI: 10.1002/(ISSN)1096-9098 |
| [28] | FRIED P, COOPER J, BALTHAZAR E, FAZZINI E, NEWALL J. A role for radiotherapy in the treatment of solid and papillary neoplasms of the pancreas[J]. Cancer, 1985, 56: 2783–2785. DOI: 10.1002/(ISSN)1097-0142 |
| [29] | ZAULS J A, DRAGUN A E, SHARMA A K. Intensity-modulated radiation therapy for unresectable solid pseudopapillary tumor of the pancreas[J]. Am J Clin Oncol, 2006, 29: 639–640. DOI: 10.1097/01.coc.0000190457.43060.fd |
 2016, Vol. 37
2016, Vol. 37


