吴茱萸碱(evodiamine,EVO)是植物吴茱萸中一种色胺吲哚类生物碱[1]。EVO具有抗肿瘤、抗炎、扩张血管、降血压、减肥、免疫抑制等药理作用[2],抗肿瘤活性是其最受关注的药理活性之一[3-5]。但EVO水溶性极差,生物利用度低。包合物作为新的药物载体能够提高难溶性药物的溶解性,提高药物的疗效、减少药物对皮肤黏膜以及胃部的刺激性[6]。近年来少有研究对EVO及其制剂的在体肠吸收进行报道,本课题首次将EVO与羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)制备成吴茱萸碱羟丙基-β-环糊精包合物(evodiamine hydroxypropyl-β-cyclodextrin inclusion complex,EHD),并采用单向肠灌流法研究EHD在大鼠各肠段的吸收特征,为EVO的临床研究提供一定依据。
1 材料和方法 1.1 材料 1.1.1 药品与试剂EVO (纯度 > 99%,武汉远城科技发展有限公司);HP-β-CD ( > 99%,江苏泰兴新鑫医药辅料有限公司);Krebs-Ringer缓冲液[7](自制:NaCl 7.80 g,KCl 0.35 g,CaCl2 0.37 g,NaHCO3 1.37 g,KH2PO4 0.32 g,MgCl2 20 mg,D-葡萄糖1.40 g,蒸馏水溶解定容至1 000 mL,HCl和NaOH调节pH至6.5);甲醇(色谱纯,上海国药集团化学试剂有限公司);其余试剂均为分析纯。
1.1.2 仪器与设备1100型高效液相色谱仪(美国Agilent公司);STA449型综合热分析仪(德国Netzsch公司);HL-1型恒流泵(上海青浦沪西仪器厂);TGL-16B型高速台式离心机(上海安亭科学仪器厂);HHS-4S型电子恒温不锈钢水浴锅(上海康路仪器设备有限公司)。
1.1.3 实验动物清洁级雄性SD大鼠购自重庆医科大学实验动物中心[动物许可证号:SCXK (渝) 2012-0001],体质量(250±20) g。
1.2 EHD的制备按处方量(HP-β-CD与EVO的摩尔比为1:1)称取约120 mg HP-β-CD和30 mg EVO于干净的研钵内,加蒸馏水后研磨1 h,40℃真空干燥2 h,用丙酮洗涤,干燥后即得EHD。
1.3 EHD理化性质的检测 1.3.1 傅里叶红外光谱分析采用KBr压片法分别对EVO、HP-β-CD、EVO与HP-β-CD的物理混合物以及EHD在400~4 000 cm-1内进行红外扫描[8]。
1.3.2 差示扫描量热分析以空铝坩埚为对照物,另一铝坩锅加入10 mg样品,升温速率为10℃/min,扫描范围0~350℃,量程±25 V,气体为氮气[9]。分别对EVO、HP-β-CD、EVO与HP-β-CD的物理混合物和EHD进行差示扫描量热分析。
1.3.3 光镜分析分别取少量的EVO、HP-β-CD、EVO与HP-β-CD的物理混合物和EHD置于不同的载玻片上,将载玻片置于显微镜上,放大200倍观察并照相。
1.4 HPLC含量测定方法的建立 1.4.1 色谱条件所用色谱柱为大连依利特Lichrospher C18柱(250 mm×4.6 mm,5 μm);柱温35℃;流动相甲醇:水=75:25(体积比),流速1.0 mL/min;检测波长225 nm;进样量20 μL。
1.4.2 样品处理取适量待测肠灌流液,加入适量甲醇,涡旋混合5 min,16 000×g离心10 min,吸取上清液待测。
1.4.3 专属性实验按照1.4.1项下色谱条件,将空白肠灌流液、EVO对照品溶液、EHD肠灌流液按1.4.2项处理后分别进样,考察其专属性。
1.4.4 标准曲线的建立精密称取EVO 10.5 mg,用适量甲醇溶解后,转移至100 mL棕色容量瓶中,甲醇定容至刻度,摇匀,得100 μg/mL对照品溶液。精密量取对照品溶液100、300、500、1 000、2 000、3 000、4 000 μL,分别置于10 mL棕色容量瓶中,加甲醇稀释,定容,摇匀,得到质量浓度为1~40 μg/mL的系列标准溶液。分别取各标准溶液20 μL进样,记录峰面积,以峰面积(A)对EVO的浓度(C)进行线性回归。
1.4.5 精密度和回收率分别制备低、中、高质量浓度(1、10、30 μg/mL)的EVO溶液,各质量浓度分别平行配制3份,测定回收率。同日内每个浓度连续进样5次,计算日内精密度;连续5 d测定浓度,计算日间精密度。
1.4.6 肠灌流液的稳定性用大鼠空白肠灌流液配制低、中、高质量浓度(1、10、30 μg/mL)的EVO溶液,各质量浓度平行配制3份,置于(37.0±0.5)℃的水浴中孵育,分别于0、1、2、4 h取样测定EVO含量。
1.5 灌流液的配制 1.5.1 EVO灌流液的配制称取EVO 18.0 mg,用Krebs-Ringer液稀释并定容至200 mL,配制成质量浓度为90 μg/mL的EVO灌流液。
1.5.2 EHD灌流液的配制称取含EVO 18.0 mg的EHD,用Krebs-Ringer液稀释并定容至200 mL,配制成质量浓度为90 μg/mL的EHD灌流液。
1.6 大鼠肠灌流实验将SD大鼠随机分成2组,禁食12 h,全程不禁水,分别用EVO及EHD进行在体肠灌流实验。每只大鼠分别腹腔注射3.5%水合氯醛(10 mL/kg)麻醉后固定。沿腹中线打开腹腔约3 cm。分别在十二指肠上端和往下10 cm处、空肠上端和往下10 cm处、盲肠上端往上10 cm处,以及结肠上端往下10 cm处剪开一个小口,插管结扎。将这4个肠段用生理盐水浸润的纱布盖上,并将肠内容物冲洗干净。将100 mL Krebs-Ringer循环液放入恒温水浴(37℃)中,再将恒温至37℃的Krebs-Ringer液以0.4 mL/min流速在肠段灌流10 min,平衡后将Krebs-Ringer液排空。然后换15 mL的EHD或EVO药物循环液(相当于含EVO 90 μg/mL),以流速0.25 mL/min进行单向灌流实验。4肠段出口处分别用25 mL的容量瓶接流出液体,1 h后结束灌流实验。取下4个25 mL容量瓶用Krebs-Ringer液稀释至刻度。实验结束后处死大鼠,剪下肠段,测量长度(L)和内径(R),计算药物的吸收速率常数(Ka)和有效渗透系数(Peff)。Ka=(X0-Xt)/C0tπR2L;Peff=Q×ln (Xin/Xout)/2πRL;其中,X0为0时药物量,Xt为t时灌流液中剩余药物量,C0为0时药物浓度,t为灌注时间,Q为流速,Xin和Xout分别为流入和流出的药物量,R和L分别为各灌流肠段的内径和长度[10]。
1.7 统计学处理应用Origin 8软件分别对Ka和Peff进行统计学分析,检验水准(α)为0.05。
2 结果 2.1 EHD傅里叶红外光谱扫描结果由图 1可知,EVO的特征吸收峰是1 144 cm-1(C-N)、1 510 cm-1和1 507 cm-1(苯环的吸收峰)、746 cm-1和733 cm-1(苯环上的邻位取代基),HP-β-CD的特征吸收峰是1 630 cm-1(糖苷键结构),EHD和EVO与HP-β-CD的物理混合物图谱中药物特征吸收峰1 144 cm-1峰消失,746 cm-1和733 cm-1峰消失,代表苯环的1 510 cm-1吸收峰减弱,且EHD减弱程度明显强于EVO与HP-β-CD的物理混合物,表明EHD形成。

|
图 1 EVO、HP-β-CD、EVO与HP-β-CD的物理混合物和EHD的红外图谱 Fig 1 FTIR of EVO, HP-β-CD, physical mixture and EHD |
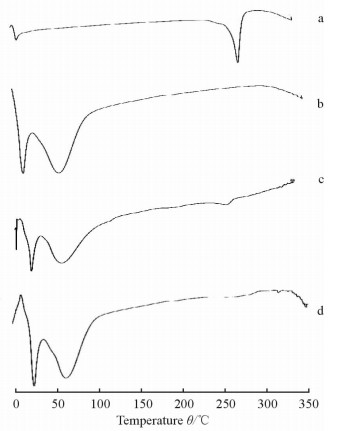
2.2 EHD差示扫描量热分析结果
由图 2可知,EVO在287.5℃有一个吸热峰,为药物的熔融峰。HP-β-CD没有吸热峰,EVO与HP-β-CD的物理混合物在该温度时有此吸热峰,而在EHD中该吸热峰明显减小,表明EVO与HP-β-CD形成了包合物EHD。
|
图 2 EVO、HP-β-CD、EVO与HP-β-CD的物理混合物和EHD的差示扫描量热法分析图谱 Fig 2 DSC curves of EVO, HP-β-CD, physical mixture and EHD |
2.3 EHD在电镜下的形态
由图 3D可见有新的物质形成,即形成了包合物EHD, 形态与EVO与HP-β-CD的物理混合物明显不同。

|
图 3 EVO、HP-β-CD、EVO与HP-β-CD的物理混合物和EHD的显微照片 Fig 3 Microphotographs of EVO, HP-β-CD, physical mixture and EHD |
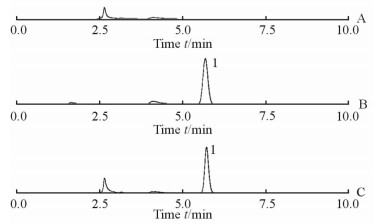
2.4 方法学实验 2.4.1 专属性实验
在1.4.1项色谱条件下,EVO峰形良好且辅料不干扰其测定,保留时间为5.7 min。
|
图 4 肠灌流液的色谱图 Fig 4 Chromatogram of intestinal perfusion liquid |
2.4.2 标准曲线的建立
建立标准曲线得回归方程:A=213.68C-23.633,r=0.999 7,结果表明EVO在1~40 μg/mL浓度范围内与峰面积呈良好的线性关系。
2.4.3 精密度和回收率EVO的平均回收率为99.85%,RSD为0.162%,符合方法学要求。低、中、高浓度的日内精密度RSD分别为2.2%、1.8%、1.4%,日间精密度RSD分别为1.2%、2.7%、2.5%,符合方法学要求。
2.4.4 肠灌流液的稳定性结果显示低、中、高浓度EVO溶液的RSD分别为1.1%、0.9%、0.7%,说明在4 h内EVO肠灌流液稳定性较好。
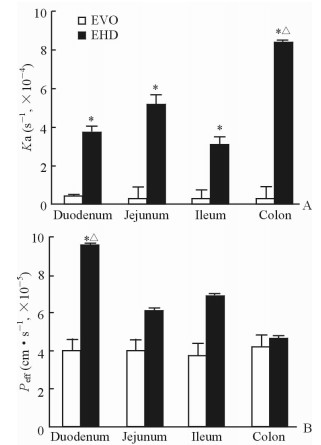
2.5 大鼠肠灌流实验由图 5可知,EHD在各肠段的Ka值以及Peff值均高于EVO,且EHD在十二指肠、空肠、回肠、结肠中的Ka值分别为EVO的9.07、16.22、11.04、28.86倍, Peff值分别为EVO的2.41、1.52、1.82、1.09倍。EHD在结肠处的Ka值大于十二指肠、空肠、回肠的Ka值(P < 0.05);在十二指肠处的Peff值大于空肠、回肠、结肠的Peff值(P < 0.05)。EVO在不同肠段的Ka值和Peff值差异均无统计学意义。各肠段EHD与EVO的Ka值差异均有统计学意义(P < 0.05);十二指肠处EHD与EVO的Peff值差异有统计学意义(P < 0.05),其他肠段处差异均无统计学意义。说明将EVO制备成EHD后能提高EVO的吸收。
|
图 5 大鼠各肠段的吸收速率常数(Ka, A)和有效渗透系数(Peff, B) Fig 5 Absorption rate constants (Ka, A) and effective permeability coefficients (Peff, B) in each intestinal segment |
3 讨论
肠灌流法分为单向灌流法和循环灌流法,它是最接近体内真实吸收状态的药物肠道吸收模型,与体内情况相关性很好,可用于研究药物在肠道的吸收程度及药物透过率等[11]。其中,单向灌流法是药物肠吸收动力学研究的主要方法。本实验采用单向灌流法对大鼠各肠段药物吸收进行研究。
实验结果表明,EHD和EVO在整个肠段均有吸收,且EHD在肠道内的吸收高于游离EVO。EHD与EVO各肠段间的Ka值差异均有统计学意义(P < 0.05),说明制备成EHD后EVO在各肠段的吸收都有明显提高;EVO不同肠段的Ka值差异无统计学意义,EHD的Ka值分别为结肠>空肠>十二指肠>回肠,其在结肠处的Ka值与十二指肠、回肠、空肠处差异均有统计学意义(P < 0.05),说明将EVO制备成EHD后药物在结肠处吸收程度最好。胡江波等[12]将EVO制备成水包油型复方吴茱萸碱纳米乳,并考察其在体肠吸收情况,结果显示EVO的Ka值是十二指肠大于空肠、回肠、结肠,复方吴茱萸碱纳米乳的Ka值是回肠大于空肠、结肠、十二指肠,说明将EVO制备成制剂后不同肠段的吸收情况发生了改变。研究表明,根据Peff的大小将吸收能力分为3类:Peff < 0.3×10-5 cm·s-1表明吸收差,Peff > 2×10-5 cm·s-1表明吸收完全,介于两者之间为中等吸收[7, 13]。EHD和EVO在4个肠段的Peff均大于2×10-5 cm·s-1,表明其在大鼠各肠段的吸收完全。且EHD的Ka值和Peff值与EVO相比都有明显的提高。可能是由于EHD的组成成分HP-β-CD能提高难溶性药物EVO的溶解性,减少药物对胃肠道的刺激,促进药物与肠黏膜的融合,从而提高胃肠道对药物的吸收。
| [1] | 晏子俊, 李万玉, 万坤, 张景勍. HPLC法测定复方吴茱萸碱纳米乳中吴茱萸碱的含量[J]. 激光杂志, 2014, 35: 72–73. |
| [2] | HU J, SUN L, ZHAO D, ZHANG L, YE M, TAN Q, et al. Supermolecular evodiamine loaded water-in-oil nanoemulsions:enhanced physicochemical and biological characteristics[J]. Eur J Pharm Biopharm, 2014, 88: 556–564. DOI: 10.1016/j.ejpb.2014.06.007 |
| [3] | SHEN H, ZHAO S, XU Z, ZHU L, HAN Y, YE J. Evodiamine inhibits proliferation and induces apoptosis in gastric cancer cells[J]. Oncol Lett, 2015, 10: 367–371. |
| [4] | CHEN M C, YU C H, WANG S W, PU H F, KAN S F, LIN L C, et al. Anti-proliferative effects of evodiamine on human thyroid cancer cell line ARO[J]. J Cell Biochem, 2010, 110: 1495–1503. DOI: 10.1002/jcb.22716 |
| [5] | BAI X, MENG H, MA L, GUO A. Inhibitory effects of evodiamine on human osteosarcoma cell proliferation and apoptosis[J]. Oncol Lett, 2015, 9: 801–805. |
| [6] | 徐才兵, 贾运涛, 田睿, 刘依依, 刘玉祺, 张良珂. 和厚朴酚羟丙基-β-环糊精包合物制备及验证[J]. 中国药学杂志, 2013, 48: 1385–1388. |
| [7] |
罗见春, 何丹, 杨梅, 吴建勇, 张景勍. 去甲氧基姜黄素羟丙基-β-环糊精在体肠吸收特征[J]. 第二军医大学学报, 2016, 37: 247–250.
LUO J C, HE D, YANG M, WU J Y, ZHANG J Q. Intestinal absorption characteristics of demethoxycurcumin hydroxypropyl-β-cyclodextrin in rats[J]. Acad J Sec Mil Med Univ, 2016, 37: 247–250. |
| [8] | 恽菲, 徐晓琰, 狄留庆, 康安, 单进军, 赵晓莉, 等. 蛇床子素不同环糊精包合物的制备及其生物利用度比较研究[J]. 中草药, 2014, 45: 341–348. |
| [9] | 曾倩, 纪晖, 唐慧慧, 谢学渊. 白杨素-羟丙基-β-环糊精包合物的制备与表征[J]. 药学实践杂志, 2014, 32: 456–459. |
| [10] | HU J, CHEN D, JIANG R, TAN Q, ZHU B, ZHANG J. Improved absorption and in vivo kinetic characteristics of nanoemulsions containing evodiamine-phospholipid nanocomplex[J]. Int J Nanomedicine, 2014, 9: 4411–4420. |
| [11] | 谭蓉, 侴桂新, 冯年平, 赵继会, 王志. 乌药总生物碱的大鼠在体肠吸收研究[J]. 中成药, 2011, 33: 787–790. |
| [12] | 胡江波, 何丹, 吴建勇, 万坤, 张景勍. 复方吴茱萸碱纳米乳的体外释放和大鼠在体肠吸收的研究[J]. 华西药学杂志, 2015, 30: 405–407. |
| [13] | 何承华, 张振海, 王舒, 周建平, 吕慧侠. 芹菜素大鼠在体肠吸收动力学的研究[J]. 中国中药杂志, 2013, 38: 1416–1420. |
 2016, Vol. 37
2016, Vol. 37


