2. 第二军医大学长征医院泌尿外科, 上海 200003;
3. 上海交通大学医学院附属上海市第九人民医院泌尿外科, 上海 200023;
4. 第二军医大学长海医院病理科, 上海 200433;
5. 第二军医大学长海医院放射科, 上海 200433
2. Department of Urology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China;
3. Department of Urology, The 9thPeople's Hospital of Shanghai, Shanghai Jiaotong University School of Medicine, Shanghai 200023, China;
4. Department of Pathology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
5. Department of Radiology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
肾上皮样血管平滑肌脂肪瘤(epithelioid angiomyolipoma, EAML)是血管平滑肌脂肪瘤(angiomyolipoma,AML)的亚型,为一种罕见的间叶源性肿瘤。因EAML短期内即会出现其他器官转移,呈现侵袭性生物学行为,逐渐引起人们对它的重新认识,因而被认为是一种具有恶性潜能的肿瘤[1-2]。本研究回顾性分析了2012年12月至2014年3月第二军医大学长海医院泌尿外科收治的7例EAML患者的临床特点及诊治经验,现报告如下。
1 资料和方法 1.1 临床资料选取2012年12月至2014年3月第二军医大学长海医院泌尿外科收治的EAML患者7例,其中男2例、女5例,年龄26~69岁,平均(43.00±16.26)岁。病变部位位于左侧4例,右侧3例。6例为健康体检时发现,1例因肉眼血尿就诊;无合并结节性硬化症(tuber sclerosis, TSC)。体格检查时患侧肾区叩击痛1例,1例可触及肿块,余患者体格检查时未见异常。实验室检查均未见明显异常。
1.2 手术方法术前诊断为肾细胞癌(renal cell carcinoma,RCC)的患者6例,有3例行根治性肾切除术,其中1例合并后腹膜淋巴结转移以及肺转移者同时行淋巴结清扫术;余3例行肾部分切除术。诊断为间叶来源肿瘤患者1例,因肿瘤较大行根治性肾切除术。
1.3 免疫组化染色取患者肿瘤标本,经10%甲醛固定,常规石蜡包埋、4 μm切片。采用H-E染色和EnVision两步法进行免疫组化染色。所使用抗HMB45、SMA、p53、S-100、Melp、CK、EMA、Ki-67、CD10和CD34抗体均购于福州迈新生物技术开发有限公司。
2 结果所有患者均行彩色超声及CT检查,可见患侧肾脏一边界清楚的实性肿物,肿瘤最大直径为2.5~22.0 cm,平均(8.79±7.86) cm。4例B超提示低回声肿块,3例提示囊实性占位。4例CT平扫均提示高密度肿块(图 1),增强后可见明显强化;3例CT平扫提示囊实性占位(图 2)。所有患者均行手术切除。本组7例患者光镜下可见瘤细胞以上皮样细胞为主,见少量脂肪组织及厚壁血管(图 3A),并呈实性巢片状结构改变(图 3B、3C)。免疫组化结果可见:所有患者HMB45、SMA及Melp均呈阳性表达(图 4),而CK、EMA均呈阴性表达;2例p53表达阳性,6例Ki-67表达阳性。7例患者均获得随访,无失访病例。随访时间21~37个月,平均(27.57±5.68)个月。合并转移者1例术后随访提示双肺及肝脏多发转移,其余6例均无瘤存活至今。
|
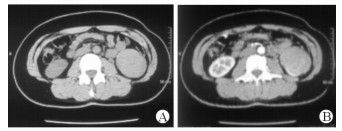
图 1 1例33岁女性左肾EAML患者双肾CT扫描结果 A: CT平扫示左肾类圆形病灶,呈均匀高密度,周边可见散在点状低密度影; B:增强皮质期显示病灶明显强化,周边点状低密度灶无明显强化,表现为“黑星征”. EAML:上皮样血管平滑肌脂肪瘤 |
|
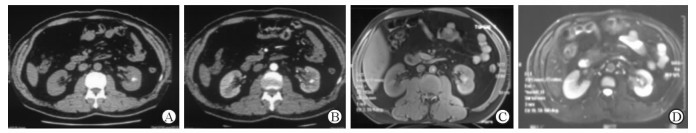
图 2 1例51岁男性左肾EAML患者双肾CT以及MRI扫描结果 A: CT平扫示左肾内生型低密度肿块,内见不规则钙化; B: CT增强后未见明显强化; C: MR T1WI呈等高信号; D: MR T2WI呈等高混杂信号,边缘尚清. EAML:上皮样血管平滑肌脂肪瘤 |
|
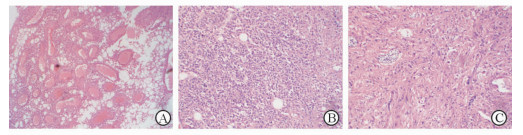
图 3 肾EAML的H-E染色结果 A:瘤内高细胞密度及散在血管,以上皮样细胞为主; B, C:肿瘤组织呈实性巢片状结构. EAML:上皮样血管平滑肌脂肪瘤. Original magnification: ×40(A);×100(B, C) |
|
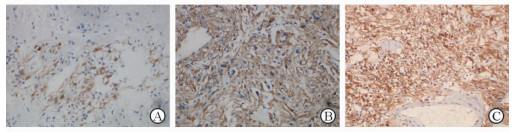
图 4 肾EAML免疫组化染色结果 A: HMB45阳性,定位于胞质; B: SMA阳性,定位于胞质; C: Melp阳性,定位于胞质. EAML:上皮样血管平滑肌脂肪瘤. Original magnification: ×200 |
3 讨论
EAML是一种罕见的间叶源性肿瘤,1996年被首次报道[3],约24%EAML患者伴有散发性或家族遗传性TSC[4],至2013年全世界共报道100余例[5]。
EAML临床表现无特异性,大部分患者没有任何症状,仅在健康体检时发现,少数患者可出现腰痛、肉眼血尿以及发热等。本组7例病例中,1例以肉眼血尿就诊,其余均为健康体检时发现,无合并TSC。文献报道EAML的CT检查特点为平扫期高密度肿物、增强后明显不均性强化、瘤体较大、包膜完整,可伴有局部淋巴结或远处器官转移等征象[6]。最新一项研究显示,超声造影检查(CEUS)对EAML合并肾静脉、下腔静脉侵犯病例的诊断更有意义[7]。本组4例CT平扫均提示高密度肿块,增强后可见明显强化;3例CT平扫提示囊实性占位。通过上述病例,可见对于术前诊断不明、CT检查提示典型的高密度肿物而无行肾部分切除术绝对指征的患者,术前穿刺存在较大意义;尤其是对于年轻患者,确诊后尽可能行肾脏部分切除术或暂时保守治疗,尽量减少因术前误诊而导致的损失。其次,对于术前影像学检查提示恶性来源同时合并全身多发转移但临床表现全身情况良好的患者,也应加强术前诊断的准确度;若临床症状与影像学检查结果存在明显矛盾,也可于术前行穿刺活检明确病理,以进一步明确具体手术方案,尽可能减少手术创伤。EAML大体标本可为灰褐、灰粉或灰白的边界尚清的肿物,或伴有出血坏死、囊变等,部分肿瘤可呈鱼肉样外观,与常见的RCC不易区分[8-9]。EAML镜下常表现为:(1)肿瘤细胞呈实性巢片状排列或呈弥漫性肉瘤样结构;(2)不同程度的异型性多角形上皮样肿瘤细胞;(3)核分裂多少不一;(4)可见黑素沉着、浆样或横纹肌样分化等;(5)坏死常见[8-13]。由于EAML易与RCC混淆,此时,免疫组化染色是唯一的鉴别方法。EAML表现为HMB45、Melan A等黑素细胞相关标记物呈阳性表达,CK、EMA等上皮细胞性标记物呈阴性表达, 而SMA、MSA等平滑肌标记物的表达各不相同。
目前,对于EAML的良、恶性尚无统一认识,其中,以Brimo等[11]和Nese等[14]的研究更具有参考价值,认为其恶性发展的可能性与上皮样成分的比例呈正相关。有报道证实,近半数的EAML病例术后发生了转移,并有1/3的病例死于该病[14-15]。Folpe等[16]根据肿瘤大小、浸润性、核的异型性、坏死等特征初步判定此类肿瘤的良、恶性。Zheng等[17]也报道了恶性EAML可能与肿瘤大小、肿瘤坏死以及不规则边界的特性相关。也有文献提出Ki-67、p53有助于EAML良、恶性的鉴别诊断,对于Ki-67和p53阳性患者应加强随访[18]。本组1例合并淋巴结及肺转移病例术后免疫组化提示Ki-67以及p53阳性率均达10%。除手术治疗外,mTOR类靶向分子药物如西维莫司也已被证实成功应用于EAML的治疗[19]。综上所述,我们应重视对EAML的术前诊治,必要的穿刺活检不可忽略,选择适合的治疗方案,尽可能为患者减少不必要的损失,术后严密随诊,以期获得更好的预后。
| [1] | VARMA S, GUPTA S, TALWAR J, FORTE F, DHAR M. Renal epithelioid angiomyolipoma:a malignant disease[J]. J Nephrol, 2011, 24: 18–22. |
| [2] | MAK C W, CHANG J M, TZENG W S, HUAN S K. An unusual appearance of renal epithelioid angiomyolipoma[J]. Singapore Med J, 2012, 53: e204–e207. |
| [3] | MAI K T, PERKINS D G, COLLINS J P. Epithelioid cell variant of renal angiomyolipoma[J]. Histopathology, 1996, 28: 277–280. DOI: 10.1046/j.1365-2559.1996.d01-421.x |
| [4] | OOI S M, VIVIAN J B, COHEN R J. The use of the Ki-67 marker in the pathological diagnosis of the epithelioid variant of renal angiomyolipoma[J]. Int Urol Nephrol, 2009, 41: 559–565. DOI: 10.1007/s11255-008-9473-1 |
| [5] | HOHENSEE S E, LA ROSA F G, HOMER P, SUBY-LONG T, WILSON S, LUCIA S M, et al. Renal epithelioid angiomyolipoma with a negative premelanosome marker immunoprofile:a case report and review of the literature[J]. J Med Case Rep, 2013, 7: 118. DOI: 10.1186/1752-1947-7-118 |
| [6] | 胡晓云, 方向明, 陈宏伟, 鲍健, 姚传军, 胡强. 肾上皮样血管平滑肌脂肪瘤一例报告并文献复习[J]. 中华泌尿外科杂志, 2010, 31: 443–445. |
| [7] | QIU T, LING W, LU Q, LU C, LUO Y. Contrast-enhanced ultrasound in diagnosis of epithelioid renal angiomyolipoma with renal vein and inferior vena cava extension[J]. J Med Ultrason (2001), 2016, 43: 427–430. DOI: 10.1007/s10396-016-0705-1 |
| [8] | 李君, 滕晓东, 严丽萍, 肖文波, 尤启汉, 李燕园. 转移性恶性肾血管平滑脂肪瘤三例报告[J]. 中华泌尿外科杂志, 2008, 29: 744–747. |
| [9] | 戴君勇, 肖觉, 罗宏, 李元, 周宏, 王传麟, 等. 肾上皮样血管平滑肌脂肪瘤诊治探讨[J]. 中华泌尿外科杂志, 2010, 31: 595–597. |
| [10] | 夏秋媛, 饶秋, 沈勤, 刘标, 李莉, 石群立, 等. 血管周上皮样细胞肿瘤免疫表型分析[J]. 中华病理学杂志, 2013, 42: 381–385. |
| [11] | BRIMO F, ROBINSON B, GUO C, ZHOU M, LATOUR M, EPSTEIN J I. Renal epithelioid angiomyolipoma with atypia:a series of 40 cases with emphasis on clinicopathologic prognostic indicators of malignancy[J]. Am J Surg Pathol, 2010, 34: 715–722. |
| [12] | METE O, VAN DER KWAST T H. Epithelioid angiomyolipoma a morphologically distinct variant that mimics a variety of intra-abdominal neoplasms[J]. Arch Pathol Lab Med, 2011, 135: 665–670. |
| [13] | LI J, ZHU M, WANG Y L. Malignant epithelioid angiomyoliopoma of the kidney with pulmonary metastases and p53 gene mutation[J]. World J Surg Oncol, 2012, 10: 213. DOI: 10.1186/1477-7819-10-213 |
| [14] | NESE N, MARTIGNONI G, FLETCHER C D, GUPTA R, PAN C C, KIM H, et al. Pure epithelioid PEComas (so-called epithelioid angiomyolipoma) of the kidney:a clinicopathologic study of 41 cases:detailed assessment of morphology and risk stratification[J]. Am J Surg Pathol, 2011, 35: 161–176. DOI: 10.1097/PAS.0b013e318206f2a9 |
| [15] | CIBAS E S, GOSS G A, KULKE M H, DEMETRI G D, FLETCHER C D. Malignant epithelioid angiomyolipoma ("sarcoma ex angiomyolipoma") of the kidney:a case report and review of the literature[J]. Am J Surg Pathol, 2001, 25: 121–126. DOI: 10.1097/00000478-200101000-00014 |
| [16] | FOLPE A L, MENTZEL T, LEHR H A, FISHER C, BALZER B L, WEISS S W. Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin:a clinicopathologic study of 26 cases and review of the literature[J]. Am J surg Pathol, 2005, 29: 1558–1575. DOI: 10.1097/01.pas.0000173232.22117.37 |
| [17] | ZHENG S, BI X G, SONG Q K, YUAN Z, GUO L, ZHANG H, et al. A suggestion for pathological grossing and reporting based on prognostic indicators of malignancies from a pooled analysis of renal epithelioid angiomyolipoma[J]. Int Urol Nephrol, 2015, 47: 1643–1651. DOI: 10.1007/s11255-015-1079-9 |
| [18] | LI W, GUO L, BI X, MA J, ZHENG S. Immunohistochemistry of p53 and Ki-67 and p53 mutation analysis in renal epithelioid angiomyolipoma[J]. Int J Clin Exp Pathol, 2015, 8: 9446–9451. |
| [19] | SHITARA K, YATABE Y, MIZOTA A, SANO T, NIMURA Y, MURO K. Dramatic tumor response to everolimus for malignant epithelioid angiomyolipoma[J]. Jpn J Clin Oncol, 2011, 41: 814–816. DOI: 10.1093/jjco/hyr035 |
 2016, Vol. 37
2016, Vol. 37


