目前肝切除术仍是治疗肝细胞癌最有效的手段,在肝切除术中如何有效地控制术中出血一直是肝胆外科医生关心的主要问题之一。经过多年的发展,肝脏的血流控制技术已经非常成熟,而且随着超声吸引装置(CUSA)等的出现,在一些手术中已经可以做到不行血流阻断而直接进行肝切除。但在一些较大的肝切除术中,仍需要阻断血流减少术中出血。Pringle法是目前肝切除术中最常用的控制出血方法,此外还有半肝入肝血流阻断法、全肝血流阻断法以及选择性肝静脉阻断法等[1-4],但这些方法都存在各自的缺点[5-7]。我科在Belghiti等[8]肝脏悬吊法(liver hanging maneuver)的基础上,于2006年自创了一种半肝血流完全阻断法(total hemihepatic vascular exclusion,THHVE)。此法不仅可以同时阻断切除侧半肝的入肝血流及出肝血流,还可以阻断左右肝之间的交通血管,使肿瘤所在侧的半肝处于血流完全隔离状态。经过初步的回顾性研究,我们发现此方法可以明显减少术中出血、减轻患者肝功能的损伤、降低术后并发症的发生率,而且有助于降低肝癌切除术后早期肺转移的发生率,提高术后近期无瘤生存率[9-12]。鉴于我们此前研究均为回顾性研究,循证医学证据等级较低,而且对于THHVE对患者总生存期的影响未作长时间的随访研究,因此我们设计了一项前瞻性的随机对照研究,旨在进一步证实THHVE在肝细胞癌肝切除术中的作用,现将研究结果报告如下。
1 资料和方法 1.1 研究方案在我科住院拟行手术切除的肝癌患者中,选择符合标准的患者纳入本研究。将所有入选患者随机分为两组,一组在肝切除术中采用THHVE法控制血流(THHVE组),另一组采用Pringle法控制血流(Pringle组)。为避免操作上的差异可能对手术结果造成影响,所有入选患者的手术均由同一术者主持完成。本研究获得第二军医大学东方肝胆外科医院伦理委员会的批准,并且在国际临床试验登记中心(ClinicalTrials.gov)进行了注册(注册号:NCT00827047)。
纳入标准:(1)自愿入组参加,并签署知情同意书;(2)年龄≥18岁;(3)经临床、影像学等检查可明确诊断为肝细胞癌,并经术后病理确认;(4)经全面检查无手术禁忌证;(5)切除范围为右半肝或左半肝切除,或右肝2个及2个以上肝段的肝切除(右肝2个肝段以下的肝切除以及左外叶切除因切除范围较小故被排除);(6)肝功能分级为Child-Pugh A级;(7)初次诊断为肝癌,术前未接受过任何抗癌治疗。排除标准:(1)肿瘤有淋巴结和(或)肝外转移者;(2)有门静脉主干癌栓或下腔静脉癌栓者;(3)之前有过肝脏手术史或其他腹部手术史者;(4)无法定期来院随访者。
1.2 随机方法本研究采用完全随机方法进行随机化分组。由Microsoft Office Excel 2003软件(Microsoft,Inc.,Redmond,WA)生成随机表,将随机数字装在连续编号的不透明信封内并封闭信封。患者签署知情同意书后,在手术室里进行随机入组。即经过开腹探查后,如果患者符合本研究的纳入标准,则将患者编号相应信封内的随机号取出,根据随机号将患者分入THHVE组或Pringle组。
1.3 手术干预所有患者均采用右侧肋缘下切口。打开腹腔后仔细探查,确定病灶的位置及切除范围,并探查有无肝外及淋巴结转移。必要时行术中B超检查以明确肿瘤的大小、数目及与血管结构之间的关系。根据切除需要游离肝脏。
THHVE组患者在肝脏完全游离后,于第二肝门处分离肝右静脉与肝中、肝左静脉共干之间的陷窝,以直角钳沿肝后下腔静脉(inferior vena cava,IVC)前壁向下分离约2 cm。然后由助手用乳胶带将肝十二指肠韧带稍向左上方侧牵开,暴露出尾状叶和IVC的连接处,在连接处用电刀稍切开肝下IVC前壁的腹膜,使用血管钳在尾状叶和肝下IVC之间进行钝性分离;根据需要可结扎切断周围的肝短静脉,如果存在肝右下静脉,根据切除的范围决定是否将其结扎切断。然后换长弯血管钳沿肝后IVC的前壁逐渐向第二肝门处钝性分离,左手示指于先前在第二肝门分离的陷窝处引导,直至血管钳尖端在陷窝可触及,即成功建立肝后隧道。以血管钳的尖端牵引一根乳胶管,乳胶管另一端牵引2根8号导尿管,从肝后隧道穿过(图 1A)。然后将乳胶管解除,其中一根导尿管(Tape A)的下端留待放置右半肝阻断带时一起从左、右肝蒂之间穿过,向上环绕肝脏,在切肝时用来收紧以悬吊肝脏及阻断左、右肝之间的交通血管;将另一根导尿管(Tape B)拉向右侧,于肝脏后方环绕右肝静脉及下腔静脉右侧壁的肝短静脉,切肝时收紧可阻断右半肝脏的所有出肝血流(图 1B)。如果在右侧尾状叶靠下的位置有明显的肝短静脉进入下腔静脉,在阻断前先将其结扎切断,避免在收紧阻断带时将其撕裂而导致出血。如切除侧为左肝,则向左侧环绕。最后放置半肝入肝血流阻断带。在左右肝管汇合部上方与肝组织交界处稍切开肝十二指肠韧带前方的腹膜,采用钝性分离,使肝门板和肝脏下缘尽量分离。然后在Glisson鞘外左右肝管汇合部上方与肝实质之间以血管钳向肝十二指肠韧带后方门静脉分叉以上与尾状叶交界处穿出,牵引一根8号导尿管(Tape C)环绕右侧肝蒂,用来阻断右半肝入肝血流(图 1C);如切除左半肝则阻断左半肝的入肝血流。此时用血管钳将Tape A的下端从左、右肝蒂之间拉出向上环绕肝脏。切肝时首先阻断半肝入肝血流(Tape C),阻断后可见半肝脏颜色改变,呈现缺血表现。再收紧Tape A阻断左、右肝叶间的交通血管,最后收紧环绕肝右静脉及肝短静脉或肝左静脉的Tape B。切除手术完成后,以相反的顺序解除阻断。
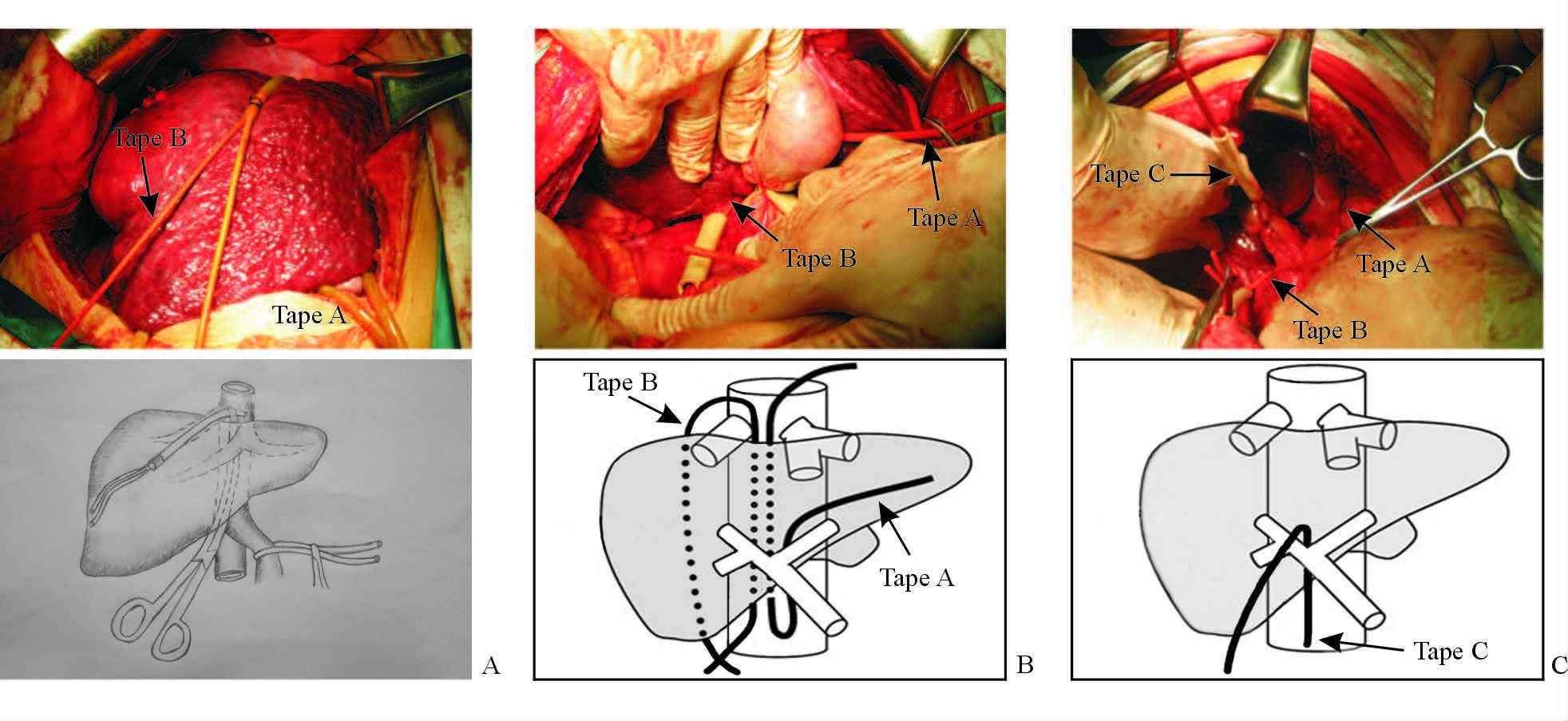
|
图 1 THHVE手术操作 Fig 1 Surgical procedures of THHVE |
Pringle组患者则是在游离肝脏后,直接用乳胶管收紧阻断肝十二指肠韧带。
所有患者均采用指捏+钳夹法离断肝组织。创面直径≥1 mm的血管及胆管均予以结扎,<1 mm的血管及胆管予以电凝。解除阻断后,仔细检查创面,如有出血点或胆漏处给予缝扎。创面处理完成后,在术区部位根据情况放置一双套管负压引流。
1.4 麻醉方法所有患者均采用全身麻醉。术前常规给予吗啡10 mg、阿托品0.5 mg、苯巴比妥100 mg。诱导麻醉采用舒芬太尼(1~2 μg/kg)、异丙酚(2 mg/kg)及罗库溴铵(0.6~0.8 mg/kg)。维持麻醉用七氟烷,术中间断静脉推注阿曲库铵维持肌松。术中静脉输液速度维持在8~12 mL/(kg·h)。
1.5 术后治疗及随访所有患者术后均给予相同的护理及支持治疗,并给予相同的保肝药物治疗,除非患者病情变化需要加用额外治疗。乙型肝炎病毒(HBV) DNA阳性的患者均在术前接受至少1周以上的口服抗病毒药物治疗,并且术后继续服药。所有患者于术后1个半月行包括B超、胸片及血液检验在内的全面复查;若肝功能允许则行一次辅助性介入(TACE)治疗,如术中造影肿瘤血管未见显影,则于肝固有动脉灌注由超液化碘油5 mL、表柔比星20 mg、5-氟尿嘧啶1 000 mg、卡铂100 mg(或丝裂霉素10 mg)制成的混悬剂栓塞。术后3个月无复发表现的患者再行全面检查,包括B超、CT、胸片以及甲胎蛋白(AFP)、血常规、肝功能、生化等。术后第1年内每2个月随访1次,第2年开始每3个月随访1次。每次随访常规行肝功能、AFP以及肝脏B超检查;如无复发表现,每6个月1次加做肝脏增强CT及胸片。对于有复发或转移的患者,根据肿瘤位置、肝功能以及全身情况选择相应的治疗方法。肝内复发的患者,根据复发时间、部位、大小、数目以及肝功能情况选择再手术切除、射频消融(PRFA)、肝动脉插管化疗过程栓塞(TACE)、口服化疗药物或口服索拉非尼等;肝外转移的治疗方法有支气管动脉灌注化疗、放疗、口服化疗药物、口服索拉非尼以及中医中药治疗等。
1.6 观察指标主要观察指标包括术中总出血量、断肝过程中出血量、总生存期和无瘤生存期。其他观察指标包括输血率、手术时间、血流阻断时间、并发症发生率、病死率、术后住院时间和术后肝功能指标。术中总出血量是用吸引器吸引量与纱布吸收的血的质量换算成出血量(1 g约为1 mL)的总和减去冲洗的水量。断肝过程中出血量为从阻断开始到解除阻断这段时间内的出血量。总生存期为从随机化开始到因任何原因引起患者死亡的时间。无瘤生存期为从手术后第1天开始到发现患者出现肿瘤复发或转移的时间。输血标准为术中或术后出血量达到800 mL或血红蛋白低于80 g/L。血流阻断时间:THHVE组为右侧或左侧肝门阻断的时间,Pringle组为第一肝门阻断的时间。并发症发生率按照Clavien-Dindo分级法进行评估,分为轻微并发症(Ⅰ~Ⅱ级)和严重并发症(Ⅲ~Ⅴ级) [13]。术后第1、第3、第7天常规行肝功能检查,记录患者血清总胆红素、丙氨酸转氨酶及前白蛋白值。
1.7 统计学处理根据主要观察指标即术中总出血量来推算所需样本量。结合前期Pringle法研究结果,本研究假设应用THHVE法可以使出血量降到300 mL,取检验水准(α)为0.05,检验效能(1-β)为80%,按此推算得每组需要>50例患者即可以达到差异有统计学意义。假设随机入组后因各种原因(如无法按预定计划完成手术、术后病理结果不符合、术后失访等)导致的患者退出率为30%左右,初步设定样本量为每组75例。
采用SPSS 11.0 软件进行数据分析。定量资料根据其是否为正态分布以x±s或中位数(四分位间距)表示,组间比较采用t检验或Mann-Whitney U检验;定性资料以例数和构成比表示,组间比较选用χ2 检验。生存曲线的描述采用Kaplan-Meier法,两组的生存曲线比较采用log-rank检验。运用Cox比例风险回归模型进行多因素分析,判定影响肝癌患者总生存期的独立预后因素。检验水准(α)为0.05。
2 结 果 2.1 分组情况及患者临床、病理资料对2011年8月至2013年8月在我科行肝切除术的462例患者进行评估筛选,通过初选的150例患者被随机分为THHVE组或Pringle组,每组75例患者。随机后共有7例患者因不符合纳入标准退出研究:THHVE组有1例患者建立肝后隧道失败,放弃THHVE法;有4例患者术后病理诊断为非肝细胞癌,其中3例胆管细胞癌,1例局灶性结节增生;1例患者术后病理提示淋巴结转移;1例患者术中发现门静脉主干癌栓。最终对143例符合本研究标准的患者资料进行了分析,THHVE组71例,Pringle组72例。两组患者的基线资料及术前实验室检查结果差异均无统计学意义;术后病理学结果显示两组患者的肿瘤大小、多发肿瘤的病例数、切缘>1 cm的病例数、合并有肉眼癌栓或镜下癌栓的病例数以及合并有肝硬化或慢性活动性肝炎的病例数差异均无统计学意义(表 1)。
|
|
表 1 两组患者的基线资料、实验室检查结果及术后病理学资料 Tab 1 Clinical and pathologic data of patients in two groups |
2.2 术中资料
两组患者的切除范围具有可比性。THHVE组患者的中位术中总出血量为250.0 mL,低于Pringle组(350.0 mL,P <0.001)。THHVE组患者的断肝过程中出血量也低于Pringle组[100.0 mL vs 215.0 mL,P <0.001]。THHVE组和Pringle组需要输血的患者分别为8例和15例,输血率比较差异无统计学意义(11.3% vs 20.8%,P=0.120)。两组患者的中位手术时间分别为142.0 min和135.5 min,差异无统计学意义(P=0.282),但THHVE组的血流阻断时间长于Pringle组(27.0 min vs 20.0 min,P <0.001,表 2)。
|
|
表 2 两组患者的术中资料 Tab 2 Intraoperative data of patients in two groups |
2.3 术后资料
两组患者术后并发症主要有术后出血、胆漏、大量腹水、胸腔积液、切口感染、肺部感染以及肝功能不全(表 3)。THHVE组并发症发生率低于Pringle组(P=0.032),其中严重并发症发生率与Pringle组比较差异无统计学意义(P=0.689)。THHVE组患者术后无肝功能不全发生,Pringle组有1例患者发生肝功能不全,经支持治疗后好转。两组患者均无围手术期死亡。THHVE组患者术后中位住院时间为12.0 d,Pringle组为13.0 d,两组比较差异无统计学意义(P=0.071,表 3)。
|
|
表 3 两组患者术后资料 Tab 3 Postoperative data of patients in two groups |
THHVE组患者术后第1、第3、第7天的丙氨酸转氨酶水平均低于Pringle组(P <0.05);术后第7天总胆红素水平低于Pringle组(P=0.013),前白蛋白水平高于Pringle组(P=0.038,表 4)。
|
|
表 4 两组患者术后肝功能情况 Tab 4 Postoperative liver function of patients in two groups |
术后1个半月时THHVE组和Pringle组分别有62例(87.3%)和60例(83.3%)患者接受了辅助性TACE治疗(P=0.500)。两组患者在研究期间内均按时来我院复查或于当地医院进行检查,无失访患者。存活患者的最短随访时间为32个月。在随访期间,THHVE组和Pringle组分别有35例(49.3%)和44例(61.1%)患者出现肝内复发或者远处转移;其中两组因肝内复发行再手术切除者分别为1例和2例,行PRFA治疗者分别为6例和5例,先后接受TACE治疗者分别为30例和38例,因肝功能差仅给予保肝及口服化疗药物治疗者分别为2例和4例。THHVE组和Pringle组分别有4例和8例患者先后出现肺部转移,接受过放疗者分别为2例和4例,接受过支气管动脉灌注化疗者分别为2例和6例。THHVE组和Pringle组分别有2例和3例患者出现腹腔淋巴结转移,另分别有1例和2例患者给予了局部放疗。THHVE组有1例患者出现右侧肾上腺转移,接受了局部放疗。Pringle组有1例患者出现骨转移。两组患者中分别有4例和6例联合应用了索拉非尼治疗。所有复发患者均同时给予口服保肝药物治疗及中成药辅助治疗。两组复发患者的治疗策略无区别。
2.4 生存结果在随访期内共有59例患者死亡,其中THHVE组23例(32.4%),Pringle组36例(50.0%)。THHVE组患者的中位生存期>47个月,Pringle组为37个月,log-rank检验显示THHVE组患者的总生存期长于Pringle组(P=0.036,图 2A)。THHVE组和Pringle组的中位无瘤生存期分别为38和25个月,差异无统计学意义(P=0.078,图 2B)。
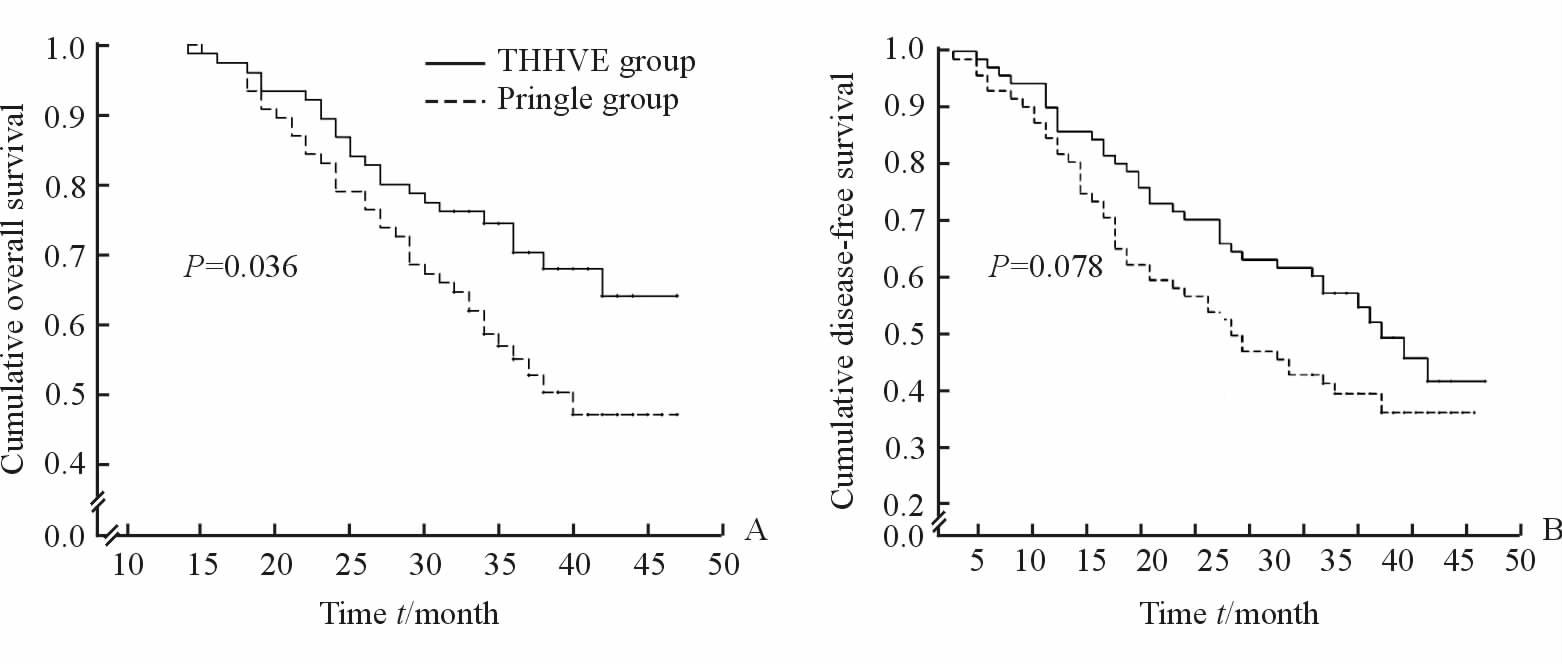
|
图 2 两组患者的总生存期(A)和无瘤生存期(B)比较 Fig 2 Overall survival (A) and disease-free survival (B) of the patients in the two groups |
用Cox比例风险回归模型对可能影响患者总生存期的预后因素进行分析,自变量包括患者性别、年龄、术前AFP>400 μg/L、HBV DNA(+)、肿瘤大小、多发肿瘤、肿瘤切缘 <1 cm、肉眼或镜下癌栓、合并肝硬化、合并慢性活动性肝炎、术中总出血量、是否输血以及采用的阻断方式(THHVE或Pringle法)。结果显示应用THHVE(RR=0.476,95%CI 0.279~0.812,P=0.006)、多发肿瘤(RR=2.200,95%CI 1.080~4.481,P=0.030)、肿瘤切缘 <1 cm(RR=2.155,95%CI 1.255~3.698,P=0.005)以及肉眼或镜下癌栓(RR=2.759,95%CI 1.481~5.139,P=0.001)是影响患者总生存期的独立因素,应用THHVE法的患者的死亡风险是应用Pringle法的47.6%。
3 讨论肝脏的血供非常丰富,肝切除术中容易发生大出血。大量出血及其导致的输血可明显增加术后并发症的发生率及死亡率,尤其是对于有肝硬化的患者[14]。输血也会增加患者术后肿瘤复发的风险[15]。因此在肝切除术中,有效控制术中出血是手术成功的关键。
Pringle法简便易行,可以有效减少术中出血,在我国被广泛应用。但该法易使残留肝脏发生缺血再灌注损伤,增加术后发生肝功能衰竭的风险[16];并且完全阻断门静脉系统的血液回流可导致胃肠道淤血、黏膜屏障功能破坏,发生细菌及毒素的移位[17],又会加重残肝损伤。对于合并门脉高压的患者,长时间肝门阻断还会增加上消化道出血及门静脉、肠系膜上静脉血栓形成的风险[6]。半肝入肝血流阻断虽可避免健侧半肝的缺血再灌注损伤,降低术后肝功能不全甚至肝衰的风险[18],但该法在断肝时会有大量来自未阻断侧肝脏的交通支的出血;尤其是对于有肝硬化的患者,其交通支更加丰富,出血量更多[6-7]。而且半肝入肝血流阻断和Pringle法都未阻断流出道血管,断肝时会有大量来自于肝静脉系统的反流出血,尤其是在中心静脉压(CVP)较高的时候[19]。全肝血流阻断(total hepatic vascular exclusion,THVE)及选择性全肝血流阻断(selective hepatic vascular exclusion,SHVE)虽可以控制肝静脉系统的反流出血,但前者需阻断肝上、肝下IVC,易引起全身血流动力学的不稳定,且手术操作复杂,并发症发生率明显高于Pringle法[3],很少常规应用;后者需要在肝外解剖出3根肝静脉的始端分别予以阻断[4],虽能保持下腔静脉通畅,但是技术难度较大,费时较多。
THHVE法既有半肝入肝血流阻断法的优点,又克服了其来自健侧肝脏交通支血管出血及肝静脉反流出血的缺点。根据本研究结果,在两组患者的基线资料、切除范围、术前实验室检查结果以及病理结果均具有可比性的情况下,应用THHVE法的患者术中总出血量及断肝过程中的出血量均低于应用Pringle法的患者,结果证实了在肝癌肝切除术中THHVE法较Pringle法更能有效地减少出血。此外,THHVE组在血流阻断时间长于Pringle组的情况下,术后第1、第3、第7天的丙氨酸转氨酶水平和术后第7天的总胆红素水平均低于Pringle组,前白蛋白水平高于Pringle组。结果证实了THHVE组术后的肝功能损害更轻、恢复更快。
THHVE组无与阻断方法相关的并发症发生和围手术期死亡病例,并发症总发生率低于Pringle组,证明了THHVE法在肝切除术中应用的安全性。我们认为,手术中更少的出血、对创面更加精细的处理、对残余肝脏更轻的缺血再灌注损伤以及避免长时间的门静脉淤血对THHVE组术后并发症发生率的降低都具有重要作用。
原发性肝癌最常见通过门静脉播散,在肝内形成转移癌结节,癌细胞还可通过肝静脉播散到全身,发生肺、骨、脑等其他部位的转移。手术操作过程中对肿瘤的挤压易导致癌细胞通过以上途径发生医源性转移。THHVE法阻断了肿瘤所在侧的肝静脉以及左、右肝之间的交通支血管,可以大大降低肿瘤从以上途径发生转移的概率。因此,THHVE法对减少肝癌患者的复发、转移具有潜在的肿瘤学优势。本研究随访结果也显示,THHVE组患者的中位生存期及中位无瘤生存期均长于Pringle组。多因素分析结果也显示,应用THHVE法是影响总生存期的独立因素之一,应用THHVE法患者的死亡风险仅为应用Pringle法的47.6%。
应用THHVE法还可以易化断肝。位于肝后IVC前壁及侧面的2根导尿管收紧后可以使从肝脏表面到肝后IVC的切面距离变短,还可以指示切除方向,能有效地保护IVC,避免切除过程中误伤,减少外科医生在切肝时因害怕损伤IVC而产生的精神压力[8, 20]。
应用THHVE法的关键步骤是盲法建立肝后隧道,该方法最早是在2001年由Belghiti等[8]报道。随后许多学者进行了大量的解剖学研究,发现在肝后IVC前壁10点到11点的位置,有一约1 cm宽的无血管区,通过这个空间进行钝性分离建立肝后隧道不会引起明显的出血,证实了该方法的安全性[20-21]。我们在应用中发现,经过适当的练习,该法并不难掌握。本研究中只有1例患者因肿瘤压迫IVC,分离过程十分困难,导致出血较多而放弃继续操作,其余患者均成功建立了肝后隧道,且没有与此相关的并发症发生。本研究所有病例均在5~8 min以内完成此操作,并不会因此而明显延长手术时间。THHVE法可应用于肿瘤位于半肝以内、切除范围不超过半肝的右肝或左肝肿瘤切除。因肿瘤压迫或侵犯IVC、炎症或手术导致的肝脏与肝后IVC紧密粘连等原因无法分离出肝后隧道者,该法则不能应用。
综上所述,本次随机对照研究不仅进一步证实了THHVE法在肝切除术中的应用具有减少术中出血、减轻术后肝功能损伤、降低并发症发生率等优点,还明确了THHVE法能够延长肝细胞癌患者的总生存期。因此,THHVE作为一种血流控制方法,在肝切除术中较Pringle法更具应用价值。
| [1] | PRINGLE J H. Notes on the arrest of hepatic hemorrhage due to trauma[J]. Ann Surg , 1908, 48 :541–549. DOI:10.1097/00000658-190810000-00005 |
| [2] | MAKUUCHI M, MORI T, GUNVÉN P, YAMAZAKI S, HASEGAWA H. Safety of hemihepatic vascular occlusion during resection of the liver[J]. Surg Gynecol Obstet , 1987, 164 :155–158. |
| [3] | KO S, KIRIHATAYA Y, MATSUMOTO Y, TAKAGI T, MATSUSAKA M, MUKOGAWA T, et al. Retrocaval liver lifting maneuver and modifications of total hepatic vascular exclusion for liver tumor resection[J]. World J Hepatol , 2016, 8 :411–420. DOI:10.4254/wjh.v8.i8.411 |
| [4] | FU S, LAU W, YANG Y, YUAN S, WANG Z, HUANG G, et al. Pringle manoeuvre versus selective hepatic vascular exclusion in partial hepatectomy for tumours adjacent to the hepatocaval junction: a randomized comparative study[J]. Int J Surg , 2014, 12 :768–773. DOI:10.1016/j.ijsu.2014.05.068 |
| [5] | SPOLVERATO G, PAWLIK T M. Liver-directed therapies: surgical approaches, alone and in combination with other interventions[J]. Am Soc Clin Oncol Educ Book , 2014 :101–110. |
| [6] | YANG Y, ZHAO L H, FU S Y, LAU W Y, LAI E C, GU F M, et al. Selective hepatic vascular exclusion versus Pringle maneuver in partial hepatectomy for liver hemangioma compressing or involving the major hepatic veins[J]. Am Surg , 2014, 80 :236–240. |
| [7] | HACKL C, SCHLITT H, RENNER P, LANG S. Liver surgery in cirrhosis and portal hypertension[J]. World J Gastroenterol , 2016, 22 :2725–2735. DOI:10.3748/wjg.v22.i9.2725 |
| [8] | BELGHITI J, GUEVARA O A, NOUN R, SALDINGER P F, KIANMANESH R. Liver hanging maneuver: a safe approach to right hepatectomy without liver mobilization[J]. J Am Coll Surg , 2001, 193 :109–111. DOI:10.1016/S1072-7515(01)00909-7 |
| [9] | 杨甲梅, 隋承军. 半肝血流完全阻断下无血肝切除术的临床应用:附14例报告[J]. 中华肝胆外科杂志 , 2007, 13 :297–299. |
| [10] | 隋承军, 徐峰, 沈伟峰, 阚彤, 谢峰, 耿利, 等. 半肝血流完全阻断法在肝细胞癌右肝切除术中的应用[J]. 中华肝胆外科杂志 , 2012, 18 :769–773. |
| [11] | 隋承军, 陆炯炯, 徐峰, 沈伟峰, 耿利, 谢峰, 等. 半肝血流完全阻断法在肝功能受损的肝细胞癌患者肝切除术中的应用[J]. 中华外科杂志 , 2013, 51 :331–334. |
| [12] | 童颖, 杨甲梅. 半肝血流完全阻断预防肝癌切除术中肿瘤播散的作用[J]. 中华肝胆外科杂志 , 2012, 18 :512–514. |
| [13] | DINDO D, DEMARTINES N, CLAVIEN P. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J]. Ann Surg , 2004, 240 :205–213. DOI:10.1097/01.sla.0000133083.54934.ae |
| [14] | GOUBRAN H A, ELEMARY M, RADOSEVICH M, SEGHATCHIAN J, EL-EKIABY M, BURNOUF T. Impact of transfusion on cancer growth and outcome[J]. Cancer Growth Metastasis , 2016, 9 :1–8. |
| [15] | SCHIERGENS T S, RENTSCH M, KASPAREK M S, FRENES K, JAUCH K W, THASLER W E. Impact of perioperative allogeneic red blood cell transfusion on recurrence and overall survival after resection of colorectal liver metastases[J]. Dis Colon Rectum , 2015, 58 :74–82. DOI:10.1097/DCR.0000000000000233 |
| [16] | VAN RIEL W G, VAN GOLEN R F, REINIERS M J, HEGER M, VAN GULIK T M. How much ischemia can the liver tolerate during resection?[J]. Hepatobiliary Surg Nutr , 2016, 5 :58–71. |
| [17] | SU Y, PAN H, GUO Z, ZHOU W, ZHANG B. Bacterial translocation and endotoxemia after Pringle maneuver in cirrhotic rats[J]. Dig Dis Sci , 2015, 60 :414–419. DOI:10.1007/s10620-014-3381-2 |
| [18] | NI J S, LAU W Y, YANG Y, PAN Z Y, WANG Z G, LIU H, et al. A prospective randomized controlled trial to compare Pringle manoeuvre with hemi-hepatic vascular inflow occlusion in liver resection for hepatocellular carcinoma with cirrhosis[J]. J Gastrointest Surg , 2013, 17 :1414–1421. DOI:10.1007/s11605-013-2236-z |
| [19] | HUGHES M, VENTHAM N, HARRISON E M, WIGMORE S J. Central venous pressure and liver resection: a systematic review and meta-analysis[J]. HPB (Oxford) , 2015, 17 :863–871. DOI:10.1111/hpb.12462 |
| [20] | GAUJOUX S, DOUARD R, ETTORRE G M, DELMAS V, CHEVALLIER J M, CUGNENC P H. Liver hanging maneuver:an anatomic and clinical review[J]. Am J Surg , 2007, 193 :488–492. DOI:10.1016/j.amjsurg.2006.04.006 |
| [21] | LIDDO G, BUC E, NAGARAJAN G, HIDAKA M, DOKMAK S, BELGHITI J. The liver hanging manoeuvre[J]. HPB (Oxford) , 2009, 11 :296–305. DOI:10.1111/j.1477-2574.2009.00068.x |
 2016, Vol. 37
2016, Vol. 37


