甲状腺相关眼病(thyroid-associated ophth-almopathy,TAO)是一种与自身免疫和炎症相关的疾病,在成年人眼眶病中最为常见[1],其发病机制复杂且不明确。目前针对TAO活动期的治疗手段主要为应用糖皮质激素[2]、局部放射[3-4]等对症方法。TAO的影响因素很多,包括遗传因素、种族、年龄、性别、放射性碘治疗、吸烟等,其中吸烟是TAO的重要影响因素[5-6]。流行病学研究发现,吸烟增加了TAO的发病率,也增加了重度TAO的发病风险[5],还有可能增加TAO的复发率[7]。
氧化应激(oxidative stress,OS)是细胞损害的重要因素之一,其在TAO的病理过程中发挥了重要的作用。TAO患者外周血中OS指标明显升高,甲状腺功能正常型TAO患者外周血中活性氧(reactive oxygen species,ROS)的含量也高于正常人群[8],而且ROS可以刺激体外培养的TAO患者眼眶成纤维细胞(orbital fibroblasts,OFs)增殖且呈剂量相关性[9]。
在吸烟TAO患者的尿液中,尼古丁代谢产物可替宁的含量和TAO的严重程度呈剂量相关性[10]。香烟烟雾提取物(cigarette smoke extract,CSE)可以激活巨噬细胞核因子-κB (NF-κB)通路,增加小鼠巨噬细胞细胞间黏附分子1(intercellular adhesion molecular-1,ICAM-1)的表达[11],但CSE是否对OFs有相似作用尚未得到证明。有学者提出通过应用烟雾与糖皮质激素拮抗性刺激NF-κB通路,从而减弱吸烟患者对于激素治疗的反应[12],但其具体机制尚不明确。
综上所述,吸烟作为TAO发病及进展中的首要危险因素,其与TAO的关系异常紧密,而OS作为TAO的一项重要病理机制,也可以通过多种途径参与TAO的病理过程。本研究通过检测OS指标ROS、丙二醛(malondialdehyde,MDA)及8-羟脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)的水平,探索CSE及尼古丁对TAO患者OFs OS作用的影响,检测CSE及尼古丁对OFs NF-κB通路的作用,并探索其作用机制。
1 材料和方法 1.1 主要试剂与仪器DMEM培养基、胎牛血清、胰酶购自美国Gibco公司,香烟购自江苏中烟工业有限责任公司,8-OHdG、MDA、ROS检测试剂盒购自南京建成生物工程研究所;3111 CO2恒温培养箱(Thermo),Mastercycler ep realplex PCR扩增热循环仪(Eppendorf),2000c核酸定量检测仪(NanoDrop)。
1.2 眼外肌来源TAO组患者的眼外肌来源于2015年1月至2015年3月在第二军医大学长征医院眼科行斜视矫正术的患者,共5例5眼,男性3例、女性2例,年龄39~71岁,符合TAO诊断标准,排除其他自身免疫病,所有患者均无吸烟史或已戒烟2年以上,术中根据患者病情需要取得标本。对照组眼外肌来源于2015年1月至2015年3月在第二军医大学长征医院眼科行斜视矫正术及眼睑整形术的患者,共3例3眼,男性2例、女性1例,年龄52~83岁,排除其他眼病及自身免疫病,无吸烟史或已戒烟2年以上,术中根据患者病情需要取得标本。上述操作均经第二军医大学长征医院伦理委员会同意,取得患者及家属知情同意并签署知情同意书。
1.3 眼外肌来源OFs原代培养及鉴定将手术获得的标本转移至存有DMEM培养液的离心管中,4 h 内运送至实验室。在超净台内将标本用PBS反复冲洗3次,用眼科剪剪成碎小组织块,将小组织块转移至新的无菌培养皿中,均匀平铺于皿底,盖好培养皿;在37 ℃、 5%CO2的孵箱内倒置5~6 h,待组织块贴壁后将培养皿轻轻翻转,沿边缘缓慢加入含体积分数为20%胎牛血清的DMEM培养液4~5 mL,静置培养。根据情况换液,平均3~4 d换液1次,4~10 d可见梭形成纤维细胞从组织块周围爬出,及时观察细胞生长、贴壁状态和组织块周围细胞的融合状态。待组织块周围爬满细胞且基本融合时可进行传代。细胞株均经免疫组化法鉴定,取4~9代细胞用于后续实验。
1.4 CSE的制备多孔玻板吸收管中各加入10 mL吸收液(水、甲醇、正己烷或二氯甲烷),滤嘴上放置一支香烟,连接好装置。打开大气采样器,流量调至约75 mL/min,点燃香烟;抽至距过滤嘴约0.25 cm处,取下香烟,继续抽吸2 min,尽量使残留在管路中的烟气可以被完全吸收。每次抽吸3支香烟,共抽吸15支。将吸收液转移至干净的100 mL玻璃瓶中,用2 mL吸收液洗涤吸收管2次,也转移至玻璃瓶中,定容至35 mL,得到未浓缩的CSE。吸收液通风橱中常温自然挥发,至体积约为3 mL,用吸收液定容至5 mL,过0.45 μm滤器,转移分装至样品瓶中,-80 ℃保存。
1.5 CSE和尼古丁对OFs细胞活性、8-OHdG、MDA、ROS水平的影响分别取TAO患者及对照患者来源的4~9代处于对数生长期的OFs,消化成单细胞悬液,细胞计数后按照1×106/mL的密度接种于96孔板中,每孔200 μL。接种24 h后换液,各孔分别加入10%CSE、0.5 μg/mL尼古丁、10 μg/mL尼古丁,即为CSE组、低浓度尼古丁组和高浓度尼古丁组,未加干预为阴性对照组。培养24、72 h后分别采用MTT法、ELISA、分光光度计法检测细胞活性、8-OHdG水平及MDA含量,24 h 时用酶标仪法检测ROS水平。
1.6 RT-PCR检测NF-κB mRNA的表达变化对照患者及TAO患者OFs培养24 h,TRIzol法抽提总RNA,并反转录成cDNA,-70 ℃保存备用,以GAPDH作为内参基因,设计扩增引物,引物序列如下:GAPDH F 5′-GTG AAC GTC CGA GTC AAC G-3′,R 5′-TGA GGT CAA TGA AGG GGT C-3′; NF-κB F 5′-GGA CCA GCA AAG GTT ATT GTT C-3′,R 5′-TTA TAC ACG CCT CTG TCA TTC G-3′;由上海生工生物工程技术服务有限公司合成。PCR循环条件。95 ℃ 30 s;95 ℃ 30 s,60 ℃ 30 s,共40个循环。采用SDS 2.3软件进行数据收集和分析,计算出标准化后的2-ΔΔCT值。
1.7 统计学处理应用SPSS 18.0软件进行统计学分析。所有数据均以x±s表示,组间比较采用非配对t检验。检验水准(α)为0.05。
2 结果 2.1 CSE对OFs活性的影响经CSE干预24、72 h 后,对照患者OFs活性较阴性对照组下降(P <0.05,P <0.01),而TAO患者OFs活性在较阴性对照组下降更为明显(P <0.01);经CSE干预24 h 后,TAO患者与对照患者OFs活性差异有统计学意义(P <0.05),提示TAO患者OFs对CSE作用更为敏感(图 1)。
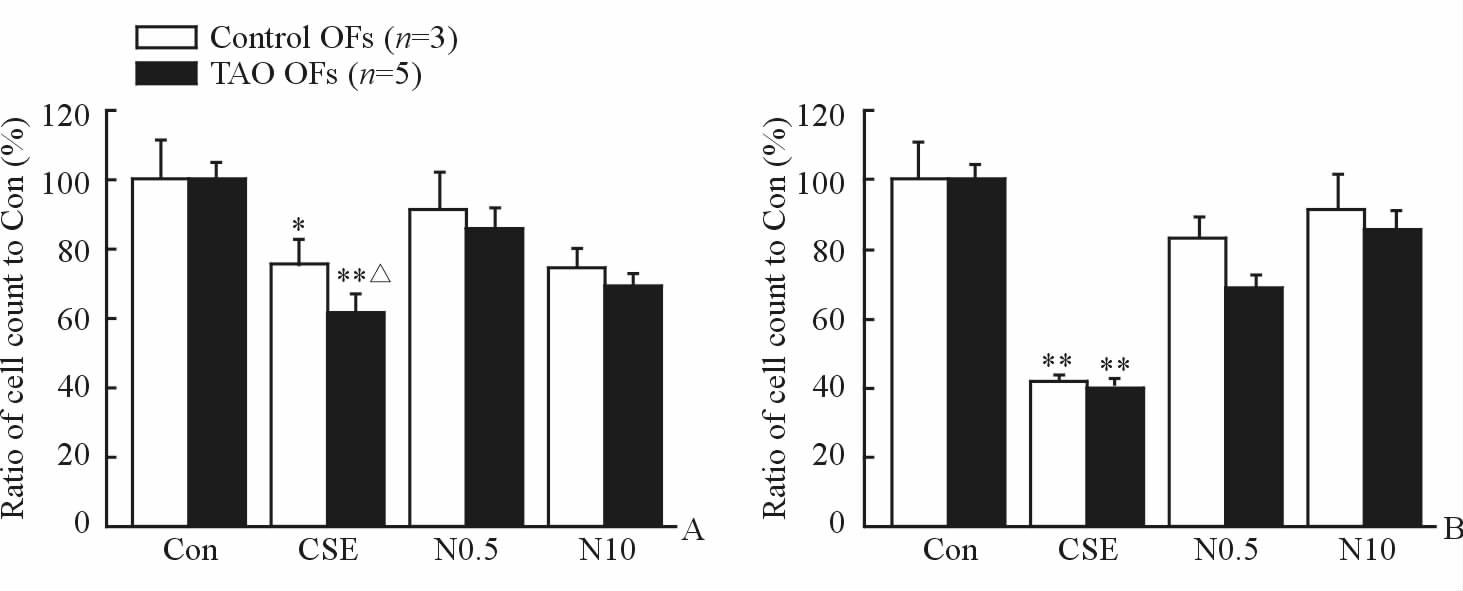
|
图 1 CSE及尼古丁分别干预OFs 24 h(A)和72 h(B)后对细胞活性的影响 Fig 1 Effect of CSE and nicotine on cell viability in OFs at 24 h (A) and 72 h (B) |
2.2 CSE和尼古丁对OFs的MDA含量的影响
CSE、不同浓度尼古丁干预24 h后,TAO与对照患者OFs的MDA含量与阴性对照组相比差异均无统计学意义(图 2A)。而CSE、不同浓度尼古丁干预72 h后,TAO与对照患者OFs的MDA含量均增加(P <0.01);而CSE刺激条件下TAO患者与对照患者OFs的MDA含量差异有统计学意义(P <0.05),提示TAO患者OFs对CSE刺激更为敏感(图 2B)。

|
图 2 CSE及尼古丁分别干预24 h(A)和72 h(B)对OFs MDA含量的影响 Fig 2 Effect of CSE and nicotine on MDA levels in OFs at 24 h (A) and 72 h (B) |
2.3 CSE和尼古丁刺激对OFs 的8-OHdG的影响
结果(图 3)表明,TAO患者及对照患者OFs在无干预条件下的8-OHdG基础水平差异有统计学意义(P <0.05)。高浓度尼古丁干预24 h(图 3A)后,TAO患者OFs的8-OHdG水平较阴性对照组升高(P <0.05)。低浓度尼古丁干预72 h(图 3B)后,TAO患者OFs的8-OHdG水平较阴性对照组升高(P <0.05),表明经时间累积后低浓度尼古丁也可以发挥作用。而对照患者OFs的8-OHdG水平经CSE干预后较阴性对照组增加(P <0.05)。
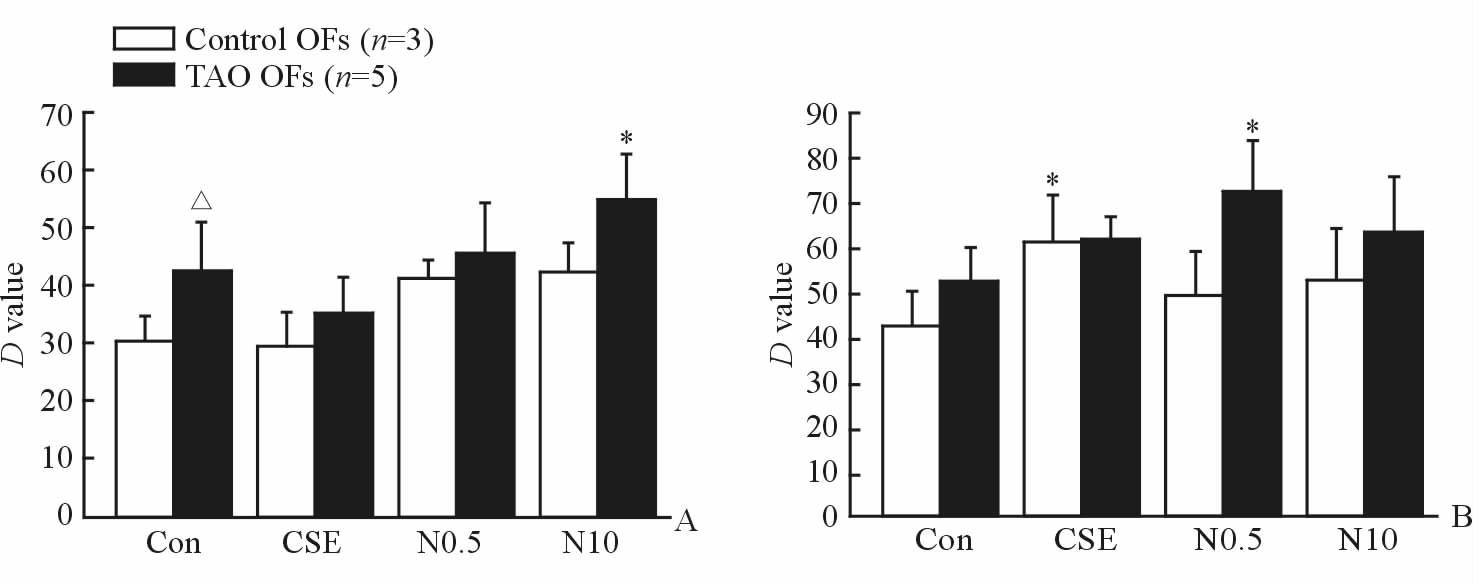
|
图 3 CSE及尼古丁分别干预24 h(A)和72 h(B)对OFs 8-OHdG水平的影响 Fig 3 Effect of CSE and nicotine on 8-OHdG levels in OFs at 24 h (A) and 72 h (B) |
2.4 尼古丁刺激对OFs的ROS水平的影响
高浓度尼古丁干预24 h后,TAO患者OFs的ROS水平较阴性对照组上升(P <0.01,图 4)。
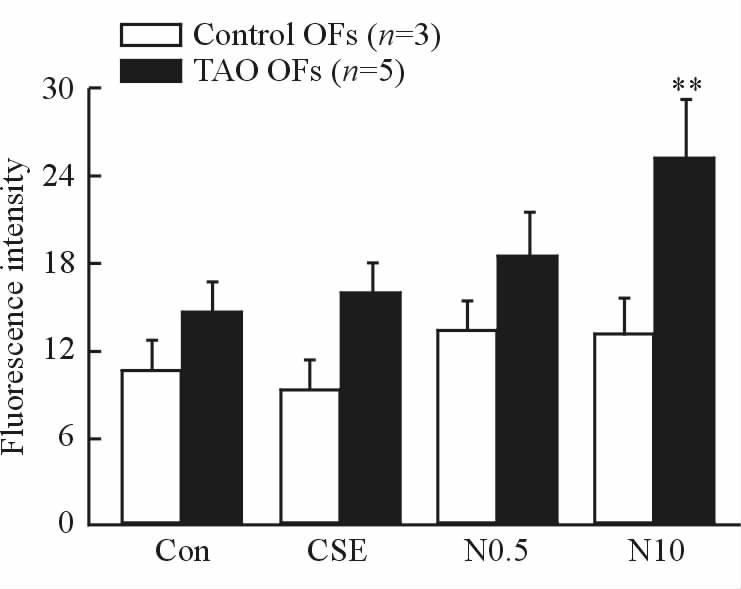
|
图 4 CSE及尼古丁分别干预24 h对OFs ROS水平的影响 Fig 4 Effect of CSE and nicotine on ROS generation in OFs at 24 h |
2.5 CSE和尼古丁刺激对OFs NF-κB表达的影响
干预24 h后,CSE TAO患者OFs中NF-κB mRNA的表达高于阴性对照组(P <0.05);而对照患者OFs CSE及高浓度尼古丁干预24 h后NF-κB mRNA的表达较阴性对照组均下降(P <0.05,图 5)。
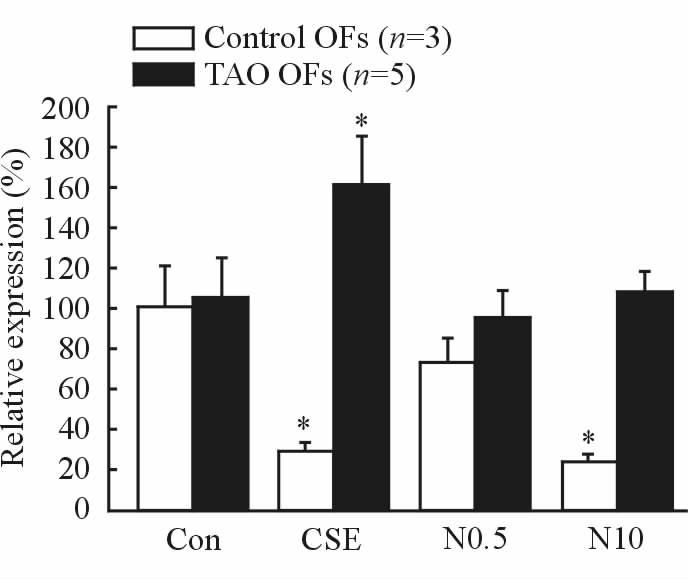
|
图 5 CSE及尼古丁分别干预24 h对OFs NF-κB表达水平的影响 Fig 5 Effect of CSE and nicotine on NF-κB expression in OFs at 24 h |
3 讨论
本研究以CSE和香烟中的主要成瘾性成分尼古丁作为刺激因素,利用TAO患者以及对照患者的OFs,在细胞水平上研究吸烟对TAO的作用机制。结果发现,单独给予CSE干预24 h后TAO患者OFs的细胞活力就已出现大幅度的下降,而干预72 h后TAO患者OFs活力仍显著下降。可见CSE可在较短时间内对TAO患者OFs发挥较强的损伤作用,随着时间累积,该作用依然存在。TAO患者OFs对CSE的作用相较于对照患者OFs更敏感,提示TAO的病理状态使OFs自我保护功能下降,导致其对吸烟的损害更敏感,其机制可能是细胞外部环境中激素等因子长期非正常表达使细胞内的一些通路长期处于非正常激活状态,因此影响了OFs的正常代谢机制。Burch等[13]研究发现,长期甲状腺功能异常会增加成纤维细胞内ROS的产生,导致成纤维细胞长期处于OS状态。Lu等[14]通过对多个TAO患者临床样本的研究证实IL-1β细胞分泌的黏性脂多糖会促进成纤维细胞内ROS含量的增加。
MDA是细胞内非酶系统产生的氧自由基通过攻击生物膜中多不饱和脂肪酸引发的脂质过氧化物,是间接检测非酶系统产生的氧自由基的有效方法。TAO患者以及对照患者OFs在各种刺激因素干预24 h后MDA含量均无显著变化;而干预72 h后,CSE及高、低浓度尼古丁干预的OFs中MDA的含量均增加,且TAO患者OFs对于CSE及低浓度尼古丁作用的敏感性强于对照患者OFs,可见CSE及尼古丁对TAO患者OFs的损伤机制与非酶系统产生的超氧化物细胞损伤机制有高度关联性。随着刺激时间的延长,低浓度尼古丁和CSE干预的OFs MDA含量均显著增加,表明吸烟对TAO的影响有一定的时间累积效应。
8-OHdG是ROS攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加合物,可作为OS对DNA损伤的检测指标。TAO患者OFs中8-OHdG的基础表达水平高于对照患者OFs,且高浓度尼古丁干预24 h后,可升高TAO患者OFs中8-OHdG的含量。随作用时间的延长,低浓度尼古丁干预的OFs中8-OHdG的水平增加,提示低浓度尼古丁可导致8-OHdG的缓慢积累,而高浓度的尼古丁则在短时间内即可促进8-OHdG的水平上升。提示尼古丁作用有一定的时间累积性,即使日常吸烟量较小的TAO患者,其疾病的发展也会受到吸烟的影响。
ROS不仅是OS的重要指标,也可通过介导OFs增殖在TAO的疾病过程中发挥作用。高浓度尼古丁干预后TAO患者OFs中ROS水平比阴性对照组上升,而对照患者OFs中ROS的水平在相同刺激条件下变化差异无统计学意义,说明尼古丁作为香烟的重要成分可通过OS反应参与TAO的病理过程。
NF-κB作为一种重要的转录因子,在炎症因子对细胞功能的调控[15]以及对OS的调控中[16]发挥重要作用。CSE干预24 h后,TAO患者OFs中NF-κB mRNA的表达上调,而尼古丁单独刺激对NF-κB mRNA的表达无显著影响。Campo等[17]报道脂质过氧化物可激活NF-κB和Caspase通路,从而调控细胞存活状态。CSE和尼古丁对于MDA含量的影响可能参与其中。TAO患者和对照患者OFs中NF-κB mRNA的表达在相同干预因素作用下相反,说明该靶点可能只在TAO的发病机制中发挥作用,TAO患者OFs受CSE中某种成分的影响,从而上调NF-κB表达,促进疾病发展,其具体的机制尚待进一步探索。
综上所述,本研究结果表明吸烟可导致OFs活性下降,上调OFs各种OS指标,可能通过激活OS参与TAO的病理过程,其中尼古丁发挥了重要作用。吸烟的上述作用有一定的时间累积效应,即使每日吸烟量较小,经时间累积之后依然会起作用,故在临床工作中应积极劝导患者戒烟,而不是减少吸烟量。此外,本研究表明吸烟可能通过介导NF-κB通路的激活而发挥作用,其具体机制较为复杂,尚需要进一步深入研究。
| [1] | HIROMATSU Y, EGUCHI H, TANI J, KASAOKA M, TESHIMA Y. Graves' ophthalmopathy: epidemiology and natural history[J]. Intern Med , 2014, 53 :353–360. DOI:10.2169/internalmedicine.53.1518 |
| [2] | MELCESCU E, HORTON W B, KIM D, VIJAYAKUMAR V, CORBETT J J, CROWDER K W, et al. Graves orbitopathy: update on diagnosis and therapy[J]. South Med J , 2014, 107 :34–43. DOI:10.1097/SMJ.0000000000000038 |
| [3] | LERAY B, IMBERT P, THOUVENIN D, BOUTAULT F, CARON P. [Diagnosis and treatment of dysthyroid orbitopathy: a multidisciplinary disease][J]. J Fr Ophtalmol , 2013, 36 :874–885. DOI:10.1016/j.jfo.2013.07.004 |
| [4] | VILAR-GONZÁLEZ S, LAMAS-OLIVEIRA C, FAGÚNDEZ-VARGAS M A, NÚÑEZ- QUINTANILLA AT, PÉREZ-ROZOS A, MERAYO-LLOVES J, et al. [Thyroid orbitopathy, an overview with special attention to the role of radiotherapy][J]. Endocrinol Nutr , 2015, 62 :188–199. DOI:10.1016/j.endonu.2014.12.004 |
| [5] | STAN M N, BAHN R S. Risk factors for development or deterioration of Graves' ophthalmopathy[J]. Thyroid , 2010, 20 :777–783. DOI:10.1089/thy.2010.1634 |
| [6] | THORNTON J, KELLY S P, HARRISON R A, EDWARDS R. Cigarette smoking and thyroid eye disease: a systematic review[J]. Eye (Lond) , 2007, 21 :1135–1145. DOI:10.1038/sj.eye.6702603 |
| [7] | KIMBALL L E, KULINSKAYA E, BROWN B, JOHNSTON C, FARID N R. Does smoking increase relapse rates in Graves' disease?[J]. J Endocrinol Invest , 2002, 25 :152–157. DOI:10.1007/BF03343979 |
| [8] | ZARKOVIĆ M. The role of oxidative stress on the pathogenesis of Graves' disease[J]. J Thyroid Res , 2012, 2012 :302537. |
| [9] | BARTALENA L, TANDA M L, PIANTANIDA E, LAI A. Oxidative stress and Graves' ophthalmopathy: in vitro studies and therapeutic implications[J]. Biofactors , 2003, 19 (3/4) :155–163. |
| [10] | CZARNYWOJTEK A, ZGORZALEWICZ-STACHOWIAK M, FLOREK E, PIEKOSZEWSKI W, WARMUZ-STANGIERSKA I, KULIŃ SKA-NIEDZIELA I, et al. [The level of cotinine-marker of tobacco smoking, in patients with hyperthyroidism][J]. Endokrynol Pol , 2006, 57 :612–618. |
| [11] | 许建英, 杜永成, 庞敏, 徐永健. 香烟烟雾提取物通过活化NF-κB上调小鼠巨噬细胞ICAM-1表达[J]. 中国病理生理杂志 , 2006, 22 :1843–1845. |
| [12] | URSU H I, GHEORGHIU M L. Oxidative stress, nuclear factor-κB pathway and current smoking in Graves' ophthalmopathy[J]. Eur Thyroid J , 2013, 2 :69–70. DOI:10.1159/000347235 |
| [13] | BURCH H B, LAHIRI S, BAHN R S, BARNES S. Superoxide radical production stimulates retroocular fibroblast proliferation in Graves' ophthalmopathy[J]. Exp Eye Res , 1997, 65 :311–316. DOI:10.1006/exer.1997.0353 |
| [14] | LU R, WANG P, WARTOFSKY L, SUTTON B D, ZWEIER J L, BAHN R S, et al. Oxygen free radicals in interleukin-1β-induced glycosaminoglycan production by retro-ocular fibroblasts from normal subjects and Graves' ophthalmopathy patients[J]. Thyroid , 1999, 9 :297–303. DOI:10.1089/thy.1999.9.297 |
| [15] | MALDONADO M D, GARCÍA-MORENO H, GONZÁLEZ-YANES C, CALVO J R. Possible involvement of the inhibition of NF-κB factor in anti-inflammatory actions that melatonin exerts on mast cells[J]. J Cell Biochem , 2016, 117 :1926–1933. DOI:10.1002/jcb.v117.8 |
| [16] | ISMAIL N, ISMAIL M, IMAM M U, AZMI N H, FATHY S F, FOO J B, et al. Mechanistic basis for protection of differentiated SH-SY5Y cells by oryzanol-rich fraction against hydrogen peroxide-induced neurotoxicity[J]. BMC Complement Altern Med , 2014, 14 :1–11. DOI:10.1186/1472-6882-14-1 |
| [17] | CAMPO G M, AVENOSO A, CAMPO S, D'ASCOLA A, TRAINA P, SAMÀ D, et al. NF-κB and caspases are involved in the hyaluronan and chondroitin-4-sulphate-exerted antioxidant effect in fibroblast cultures exposed to oxidative stress[J]. J Appl Toxicol , 2008, 28 :509–517. DOI:10.1002/(ISSN)1099-1263 |
 2016, Vol. 37
2016, Vol. 37


