2. 第二军医大学长征医院器官移植科, 上海 200003
2. Department of Organ Transplantation, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
随着社会经济的发展和人类生活水平的提高,糖尿病的发病率逐年升高。根据国际糖尿病联合会的报告,2014年全球糖尿病患者已超过3.87亿[1],其中65%左右的患者死于心血管并发症[2]。糖尿病性心肌病(diabetic cardiomyopathy,DCM)是一种主要的糖尿病并发症,其导致的心力衰竭被认为是造成糖尿病患者死亡的主要因素之一。越来越多的证据显示,肥大细胞脱颗粒释放的各种介质所介导的炎症反应在高血压、缺血性心肌病(ischemic cardiomyopathy,ICM)等导致的心肌纤维化、心脏重构过程中起到关键的作用[3-4]。本研究通过分析循环中类胰蛋白酶水平与DCM的相关性,进一步研究肥大细胞激活与DCM的心脏重构的关系,为临床预防DCM提供可能的干预靶点。
1 资料和方法 1.1 研究对象选取2012年8月至2013年3月在第二军医大学长征医院心内科就诊的DCM患者26例作为DCM组,ICM患者32例作为ICM组,同时选取健康志愿者20例作为健康对照组。本试验经第二军医大学长征医院医学伦理委员会审批通过。DCM诊断标准:(1)糖尿病病程5年以上;(2)既往无心脏病史;(3)排除高血压、甲状腺功能亢进等;(4)冠状动脉造影或心脏CTA检查排除冠心病;(5)至少出现以下情况之一:心脏扩大、各类心律失常、慢性心功能不全。ICM诊断标准:(1)有明确冠心病史,有1次或以上心肌梗死(有或无Q波心梗);(2)影像学结果显示心脏明显扩大;(3)存在心功能不全征象和(或)实验室依据;(4)排除冠心病并发症及某些机械性并发症,如室间隔穿孔、心室壁瘤和乳头肌功能不全导致的二尖瓣关闭不全等;(5)除外由其他原因引起的心脏扩大或心力衰竭。排除标准:(1)试验前1个月内出现感染;(2)合并严重慢性疾病;(3) 肝、肾功能不良;(4)每天酒精摄入量超过20 g;(5)拒绝参加该研究者。
1.2 数据收集人口统计学特征(性别、年龄)和体检测量数据(身高、体质量、腰围、臀围、血压)均于受试者采血当天清晨安静状态下获得。其他详细资料以病史依据为准。
1.3 血标本收集和处理所有受试者均禁食8 h以上,于清晨抽取肘静脉血10 mL,由我院检验科测定血常规、肝肾功能、血糖、总胆固醇、三酰甘油、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)。另抽取2 mL静脉血注入乙二胺四乙酸抗凝管,将采集的血标本置于离心机中,2~8 ℃ 1 000×g离心15 min;取上层血浆,-80 ℃冰箱冷冻保存,待检测血浆中类胰蛋白酶水平。
1.4 类胰蛋白酶水平的测定运用人胰蛋白酶酶联免疫吸附实验(enzyme-linked immune sorbent assay,ELISA)试剂盒(古朵生物,中国)测定各受试者血浆中的类胰蛋白酶水平。采用ELX800酶标仪(BioTek,美国)测定450 nm波长下的光密度值。
1.5 统计学处理应用SPSS 13.0 软件进行统计分析。计量数据以 x±s 表示,组间比较采用单因素方差分析(one-way ANOVA);计数资料以百分率(%)表示,组间比较采用χ2检验;相关性分析采用Pearson相关分析。检验水准(α)为0.05。
2 结 果 2.1 各组受试者的一般资料健康对照组、ICM组和DCM组受试者的一般资料、体检所测参数及用药情况见表 1。3组受试者在年龄、性别、吸烟人数占比、血压、体质量指数(body mass index,BMI)、腰围、臀围及腰臀比方面差异均无统计学意义。在用药情况方面,ICM组和DCM组患者均常规使用他汀类降脂药、口服降压药及阿司匹林。DCM组患者与ICM组相比,使用β受体阻滞剂的比例较少,使用血管紧张素酶抑制剂或血管紧张素Ⅱ受体拮抗剂(ACEI/ARB)及钙拮抗剂(CCB)类降压药的比例相对较高;有76.9%(20/26)的DCM患者同时使用胰岛素控制血糖。
|
|
表 1 各组受试者一般资料的比较 |
2.2 各组受试者生化指标的比较
健康对照组、ICM组和DCM组受试者的生化指标检测结果如表 2所示。3组受试者的空腹血糖、糖化血红蛋白、总胆固醇、HDL-C和三酰甘油差异均无统计学意义,ICM组及DCM组患者LDL-C水平均低于健康对照组(P<0.05)。此外,ICM组及DCM组患者的血肌酐水平均高于健康对照组,其中DCM组与健康对照组相比差异具有统计学意义(P<0.05)。
|
|
表 2 各组受试者生化指标检测结果的比较 |
2.3 各组受试者血浆类胰蛋白酶水平的比较
健康对照组、ICM组和DCM组受试者血浆类胰蛋白酶水平分别为(2.37±0.56)、(6.81±0.94)和(7.19±0.62) μg/L。ICM组和DCM组患者的血浆类胰蛋白酶水平均高于健康对照组(P<0.01);DCM组患者的血浆类胰蛋白酶水平略高于ICM组,但差异无统计学意义。
2.4 血浆类胰蛋白酶水平与空腹血糖的相关性分析将 所有受试者按空腹血糖水平不同进行分层,结果空腹血糖≤6.0 mmol/L、6.1~7.0 mmol/L、7.1~11.1 mmol/L、>11.1 mmol/L组分别有59、8、9、2例,各组血浆类胰蛋白酶水平分别为(5.27±3.11)、(6.70±1.74)、(7.15±0.92)和7.23 μg/L,表明各受试者血浆类胰蛋白酶水平随空腹血糖水平升高而升高,但组间差异无统计学意义(P=0.09)。Pearson相关性分析显示,血浆类胰蛋白酶水平与空腹血糖呈正相关(r=0.637,P<0.01;图 1)。
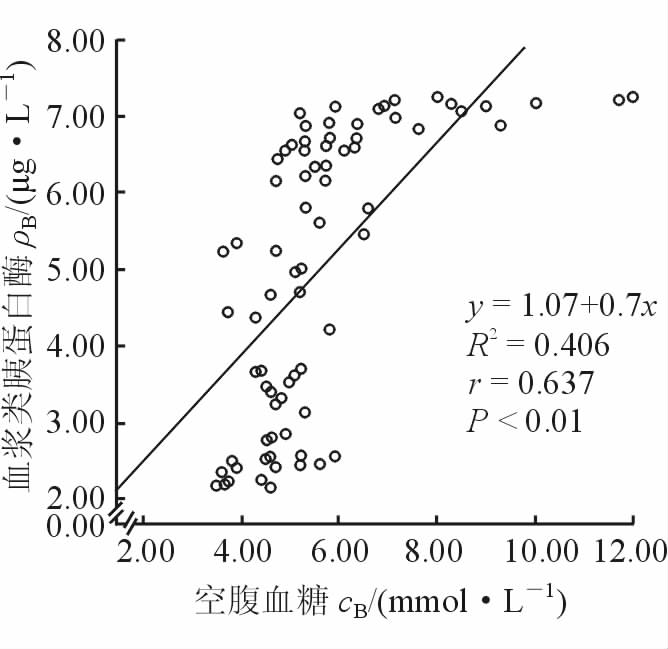
|
图 1 血浆类胰蛋白酶水平与空腹血糖间的相关性 |
3 讨 论
心肌纤维化是DCM心室重构的主要病理改变。高血糖状态引起代谢紊乱、胰岛素抵抗、微血管病变、肾素-血管紧张素系统变化及心脏自主功能障碍,导致心肌组织胶原沉积、心肌纤维化和心肌重构,最终进展至心力衰竭和死亡[5-8]。对其机制的进一步研究有利于改善DCM患者的预后。而研究显示,肥大细胞在器官纤维化、动脉粥样硬化斑块形成、高血压或心肌缺血导致的心肌病、心脏重构中发挥关键作用,是调节心脏重构的关键细胞[9-11]。已有研究在人类和动物的心肌病心肌纤维化中观察到肥大细胞密度以及脱颗粒的增加[12-13]。被激活的肥大细胞脱颗粒释放多种细胞因子 、趋化因子(如IL-8)、蛋白酶(半胱氨酸组织蛋白酶和基质金属蛋白酶)以及细胞特异性蛋白酶(糜酶和类胰蛋白酶)[14-15。动物实验表明,肥大细胞能直接参与肥胖和糖尿病等代谢性疾病的发病过程,并在其中发挥关键作用[16-17]。DCM心肌组织中肥大细胞的密度增加[18],因此推测肥大细胞也参与了DCM心肌纤维化的过程。本课题组前期在链脲佐菌素(STZ)诱导的糖尿病大鼠模型中证实,应用肥大细胞膜稳定剂奈多罗米可以改善糖尿病心肌纤维化[19]。而对于糖尿病通过何种机制引起肥大细胞脱颗粒、导致心肌纤维化,目前尚无文献报道。
类胰蛋白酶是肥大细胞特异性蛋白酶,属丝氨酸蛋白酶家族。类胰蛋白酶一般预先合成并储存在肥大细胞颗粒内,经脱颗粒释放到细胞外,激活基质金属蛋白酶前体,降解趋化因子、脂蛋白及纤连蛋白[20],刺激成纤维细胞增殖和胶原蛋白合成,是组织纤维化的重要参与蛋白[21]。Moreno等[22]研究证实,存在动脉粥样硬化斑块患者的血循环中类胰蛋白酶水平升高。因此本研究选择ICM患者作为阳性对照,检测DCM组、ICM组和健康对照组受试者血浆类胰蛋白酶的水平。结果显示DCM组、ICM组患者的血浆类胰蛋白酶水平均高于健康对照组,DCM组患者血浆类胰蛋白酶水平稍高于ICM组,表明在糖尿病患者中,肥大细胞对类胰蛋白酶的释放增加。Li等[23]在SD大鼠的主动脉缩窄模型中证实,类胰蛋白酶通过自分泌的方式激活肥大细胞、促进糜酶的释放,参与心肌纤维化,这可能是类胰蛋白酶参与心肌纤维化的机制之一。本研究进一步对所有受试者进行汇总分析,结果显示类胰蛋白酶水平与空腹血糖之间存在正相关,这为探讨肥大细胞激活与糖尿病心肌纤维化的机制研究提供了方向。
糖尿病患者长期高血糖状态可导致机体中大量的终末糖基化产物(advanced glycation end products,AGEs)堆积。AGEs的堆积可以导致慢性炎症反应,引起心肌纤维化和心肌重构。Sick等[24]报道AGEs可以刺激肥大细胞脱颗粒。因此,推测肥大细胞参与DCM的机制可能为糖尿病导致心肌组织中AGEs的堆积,刺激心脏肥大细胞脱颗粒,释放类胰蛋白酶,进而引起心肌胶原合成和组织纤维化增加。本研究首次在临床患者中证实了肥大细胞激活与DCM的相关性,为DCM的预防和治疗提供了方向。
| [1] | International Diabetes Federation. IDF diabetes atlas 2014 update[S/OL]. http://www.idf.org/diabetesatlas |
| [2] | GRUNDY S M, BENJAMIN I J, BURKE G L, CHAIT A, ECKEL R H, HOWARD R V, et al. Diabetes and cardiovascular disease: a statement for healthcare professionals from the American Heart Association[J]. Circulation , 1999, 100 :1134–1146. DOI:10.1161/01.CIR.100.10.1134 |
| [3] | JANICKI J S, BROWER G L, LEVICK S P. The emerging prominence of the cardiac mast cell as a potent mediator of adverse myocardial remodeling[J]. Methods Mol Biol , 2015, 1220 :121–139. DOI:10.1007/978-1-4939-1568-2 |
| [4] | LI J, JUBAIR S, JANICKI J S. Estrogen inhibits mast cell chymase release to prevent pressure overload-induced adverse cardiac remodeling[J]. Hypertension , 2015, 65 :328–334. DOI:10.1161/HYPERTENSIONAHA.114.04238 |
| [5] | BUGGER H, BODE C. The vulnerable myocardium. Diabetic cardiomyopathy[J]. Hamostaseologie , 2015, 35 :17–24. |
| [6] | ANEJA A, TANG W H, BANSILAL S, GARCIA M J, FARKOUH M E. Diabetic cardiomyopathy: insights into pathogenesis, diagnostic challenges, and therapeutic options[J]. Am J Med , 2008, 121 :748–757. DOI:10.1016/j.amjmed.2008.03.046 |
| [7] | TRACHANAS K, SIDERIS S, AGGELI C, POULIDAKIS E, GATZOULIS K, TOUSOULIS D, et al. Diabetic cardiomyopathy: from pathophysiology to treatment[J]. Hellenic J Cardiol , 2014, 55 :411–421. |
| [8] | PAPPACHAN J M, VARUGHESE G I, SRIRAMAN R, ARUNAGIRINATHAN G. Diabetic cardiomyopathy: pathophysiology, diagnostic evaluation and management[J]. World J Diabetes , 2013, 4 :177–189. |
| [9] | ZHANG D, SPIELMANN A, WANG L, DING G, HUANG F, GU Q, et al. Mast-cell degranulation induced by physical stimuli involves the activation of transient-receptor-potential channel TRPV2[J]. Physiol Res , 2012, 61 :113–124. |
| [10] | HVGLE T. Beyond allergy: the role of mast cells in fibrosis[J]. Swiss Med Wkly , 2014, 144 :w13999. |
| [11] | LEVICK S P, MELÉNDEZ G C, PLANTE E, MCLARTY J L, BROWER G L, JANICKI J S. Cardiac mast cells: the centerpiece in adverse myocardial remodeling[J]. Cardiovasc Res , 2011, 89 :12–19. DOI:10.1093/cvr/cvq272 |
| [12] | LEVICK S P, MCLARTY J L, MURRAY D B, FREEMAN R M, CARVER W E, BROWER G L, et al. Cardiac mast cells mediate left ventricular fibrosis in the hypertensive rat heart[J]. Hypertension , 2009, 53 :1041–1047. DOI:10.1161/HYPERTENSIONAHA.108.123158 |
| [13] | LIU J, DIVOUX A, SUN J, ZHANG J, CLÉMENT K, GLICKMAN J N, et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice[J]. Nat Med , 2009, 15 :940–945. DOI:10.1038/nm.1994 |
| [14] | PEJLER G, ABRINK M, RINGVALL M, WERNERSSON S. Mast cell proteases[J]. Adv Immunol , 2007, 95 :167–255. DOI:10.1016/S0065-2776(07)95006-3 |
| [15] | SATOMURA K, YIN M, SHIMIZU S, KATO Y, NAGANO T, KOMEICHI H, et al. Increased chymase in livers with autoimmune disease: colocalization with fibrosis[J]. J Nippon Med Sch , 2003, 70 :490–495. DOI:10.1272/jnms.70.490 |
| [16] | ZHANG J, SHI G P. Mast cells and metabolic syndrome[J]. Biochim Biophys Acta , 2012, 1822 :14–20. DOI:10.1016/j.bbadis.2010.12.012 |
| [17] | HE A, SHI G P. Mast cell chymase and tryptase as targets for cardiovascular and metabolic diseases[J]. Curr Pharm Des , 2013, 19 :1114–1125. |
| [18] | PATELLA V, DE CRESCENZO G, LAMPARTER-SCHUMMERT B, DE ROSA G, ADT M, MARONE G. Increased cardiac mast cell density and mediator release in patients with dilated cardiomyopathy[J]. Inflamm Res , 1997, 46 (Suppl 1) :S31–S32. |
| [19] | HUANG Z G, JIN Q, FAN M, CONG X L, HAN S F, GAO H, et al. Myocardial remodeling in diabetic cardiomyopathy associated with cardiac mast cell activation[J/OL]. PLoS One, 2013, 8: e60827. doi: 10.1371/journal.pone.0060827 |
| [20] | XIANG M, SUN J, LIN Y, ZHANG J, CHEN H, YANG D, et al. Usefulness of serum tryptase level as an independent biomarker for coronary plaque instability in a Chinese population[J]. Atherosclerosis , 2011, 215 :494–499. DOI:10.1016/j.atherosclerosis.2011.01.006 |
| [21] | ABE M, KUROSAWA M, ISHIKAWA O, MIYACHI Y, KIDO H. Mast cell tryptase stimulates both human dermal fibroblast proliferation and type Ⅰ collagen production[J]. Clin Exp Allergy , 1998, 28 :1509–1517. DOI:10.1046/j.1365-2222.1998.00360.x |
| [22] | MORENO M, PUIG J, SERRANO M, MORENO-NAVARRETE J M, ORTEGA F, RICART W, et al. Circulating tryptase as a marker for subclinical atherosclerosis in obese subjects[J/OL]. PLoS One, 2014, 9: e97014. doi: 10.1371/journal.pone.0097014 |
| [23] | LI J, JUBAIR S, LEVICK S P, JANICKI J S. The autocrine role of tryptase in pressure overload-induced mast cell activation, chymase release and cardiac fibrosis[J]. IJC Metab Endocr , 2016, 10 :16–23. DOI:10.1016/j.ijcme.2015.11.003 |
| [24] | SICK E, BREHIN S, ANDRÉ P, COUPIN G, LANDRY Y, TAKEDA K, et al. Advanced glycation end products (AGEs) activate mast cells[J]. Br J Pharmacol , 2010, 161 :442–455. DOI:10.1111/j.1476-5381.2010.00905.x |
 2016, Vol. 37
2016, Vol. 37


