2. 福建医科大学附属第一医院麻醉科, 福州 350005
2. Department of Anesthesia, the First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, Fujian, China
脑动脉瘤锁孔手术中应用肌源性运动诱发电位(motor evoked potential,MEP)监测在降低运动功能损伤中的作用已得到证实。直接大脑皮质电刺激(direct cortical stimulation,DCS)和经颅电刺激(transcranial electric stimulation,TES)是目前术中MEP监测最常采用的刺激技术。DCS具有局部皮质刺激、刺激电量小、减少体动等优点[1-2],但其锁孔手术骨窗小,难以应用。与DCS相比,TES不需暴露大脑运动皮质和中断手术操作,并可连续监测运动传导通路的完整性;但由于颅骨电阻较大,其所需的刺激电量较大,有可能导致皮质下运动传导通路直接激活[3-4],出现假阴性的结果。本研究将31例前循环动脉瘤锁孔入路显微夹闭手术患者以经颅骨内电极(cranial peg-screw electrode,CPSE)阈值刺激模式进行术中MEP监测,取得了良好的监测效果,现将初步研究结果报告如下。
1 资料和方法 1.1 一般资料选取2012年1月至2014年3月在福建医科大学附属第一医院神经外科确诊为大脑前循环动脉瘤患者31例,行锁孔入路显微夹闭手术。经医院伦理委员会批准后,在患者知情同意情况下,术中行肌源性MEP、体感诱发电位(somatosensory evoked potentials,SEP)监测。31例患者术前均无运动功能障碍及意识障碍,其中男性14例、女性17例,平均年龄(51.00±10.63)岁(31~70);未破裂2例,第1次出血28例,第2次出血1例。Hunt-Hess分级Ⅰ级2例,Ⅱ级29例。29例行CT检查,发现蛛网膜下隙出血。26例术前经全脑数字减影血管造影(digital subtraction angiography,DSA)明确诊断,5例经计算机断层扫描血管造影术(computed tomographic angiography,CTA)确诊。31例患者共有脑动脉瘤36个,其中后交通动脉动脉瘤12个、前交通动脉动脉瘤11个、大脑中动脉动脉瘤6个、脉络膜前动脉动脉瘤4个、颈内动脉动脉瘤3个。本研究排除术前有植入心脏起博器、电子耳蜗等生物电子装置,或癫疒 间 发作、颅骨缺损和严重心肺肝肾疾病等病史的患者。
1.2 手术及麻醉方法31例患者均经翼点锁孔入路行动脉瘤显微夹闭手术。所有患者均采用异丙酚1.5~2.5 mg/kg、芬太尼3~4 μg/kg、顺阿曲库铵0.2~0.4 mg/kg静脉注射行麻醉诱导,3~4 min 后进行气管插管。麻醉维持全静脉麻醉联合部分神经肌肉阻滞方案,采用靶控输注技术(target controlled infusion,TCI)静脉持续输注异丙酚2~4 mg/(kg·h)、 瑞芬太尼4~8 μg/(kg·h)、顺阿曲库铵0.05~0.10 mg/(kg·h),避免额外单次给予麻醉药物。采用四联刺激肌肉收缩试验(train of four twitch test,TOF)监测所有患者的神经肌肉阻滞程度。术中连续监测患者有创动脉血压、心率、脉搏血氧饱和度、呼气末二氧化碳分压及体温。必要时适当提高手术室温度以防止患者体温过低。
1.3 阈值刺激模式和CPSE-MEP监测方法阈值刺激即运用最小的刺激电压且术中至少能在1块目标肌肉上引出肌源性MEP,波幅大于20 μV。以麻醉后40 min的MEP波形为基线,警报标准为刺激阈值高于基础阈值100 V以上(提示运动传导通路即将发生不可逆的损伤[5])。手术过程中连续监测MEP的变化,当MEP变化达警报标准时报告术者,术者根据术中具体情况采取相应的干预措施。采用EpochXP术中监护系统(美国Axon公司)记录诱发电位信号,电刺激采用外接电刺激器(D-185; Digitimer,Welwyn,Garden City,UK)。麻醉诱导插管后,摆放患者的体位,放置刺激和记录电极。按国际脑电学会制定10/20系统,阳极刺激电极放在 C3/C4或C1/C2前1~2 cm,阴极放在对侧相应部位。手术侧刺激电极选用颅骨内螺钉电极[6](图 1),消毒铺巾后,用灭菌手摇钻在颅骨上钻一直径约3 mm、深约6 mm的小孔,置入螺钉电极。非手术侧刺激电极选用颅骨外螺旋塞电极。刺激采用恒压经颅连续短串电刺激:5~7个单相方波,阳极刺激,持续时间300 μs,刺激间隔2 ms(重复频率500 Hz),最大刺激电压100~400 V。使用皮下针电极记录电极,同时记录从双侧肱二头肌、拇短展肌、胫前肌和拇展肌诱发的肌源性MEP。
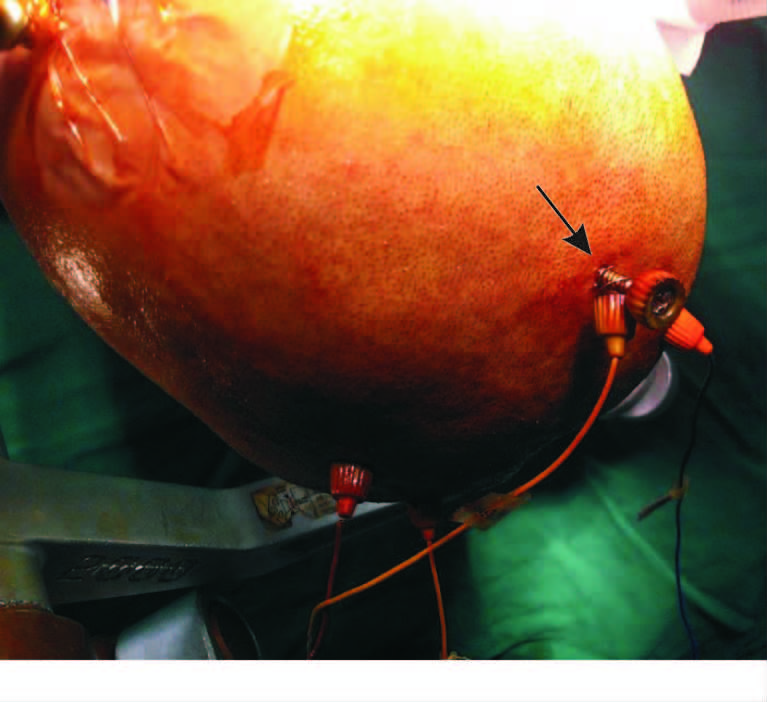
|
图 1 颅骨内螺丝钉电极(箭头所示)的放置 Fig 1 Placement of CPSE (arrow) |
1.4 TOF监测
监测神经肌肉反应活动,排除肌松剂对肌源性MEP的影响。用每间隔0.5 s的连续4个2 Hz电刺激刺激左侧正中神经,记录电极置于左侧拇短展肌。术中要至少能引出2个反应波形。
1.5 术中患者体动和术后神经功能结果判定若患者术中出现MEP刺激引起的暂时性、反射性肢体活动,或明显的头部运动(头部活动大于1 mm,通过手术视频来量化和测量),均认为是不可接受的体动[7]。术前和术后当天、次日、第3天和1周时分别检查患者的意识水平、感觉和肢体肌力。术后第2天仍有单个或多个肢体肌力与术前相比肌力评定(manual muscle testing,MMT)下降≥2级则定义为新的运动功能障碍,1周内有恢复为暂时性,2个月内未恢复为永久性[8];术后当天肢体肌力恢复,而后由于其他原因导致肢体肌力下降的病例除外。
1.6 数据分析术中电生理监测数据和重要事件均被记录并保存。将上述数据与患者术后运动功能状况的相关性及并发症等进行前瞻性研究,分析在部分神经肌肉阻滞下CPSE-MEP对神经功能监测的可行性、安全性、敏感性、特异性,以及对其手术策略的影响。
2 结 果 2.1 阈值刺激模式下CPSE-MEP监测的刺激阈值分布31例患者术中手术侧与非手术侧均行MEP监测。手术侧采用CPSE,28例能成功引出MEP,基础刺激阈值为100~380 V,平均(194.71±70.71) V,见图 2。其余3例提高刺激电压至 400 V 以上,双侧目标肌肉MEP仍未能引出,其中2例术中持续静脉推注顺阿曲库铵>0.1 mg/(kg·h),TOF未见反应波形,考虑神经肌肉阻滞程度较深所致;另1例术中TOF可见2个反应波形,排除麻醉因素,手术结束后发现为手术侧刺激电极脱落所致。非手术侧采用TES,在相同刺激强度下仅有21例能成功引出MEP。所有患者均未出现MEP监测引起的癫疒 间 发作、心律失常、术中知晓等不良事件,亦未见刺激电极装置引起的头皮灼伤、头皮感染、脑膜炎、电极断裂、硬膜外或硬膜下血肿等并发症。
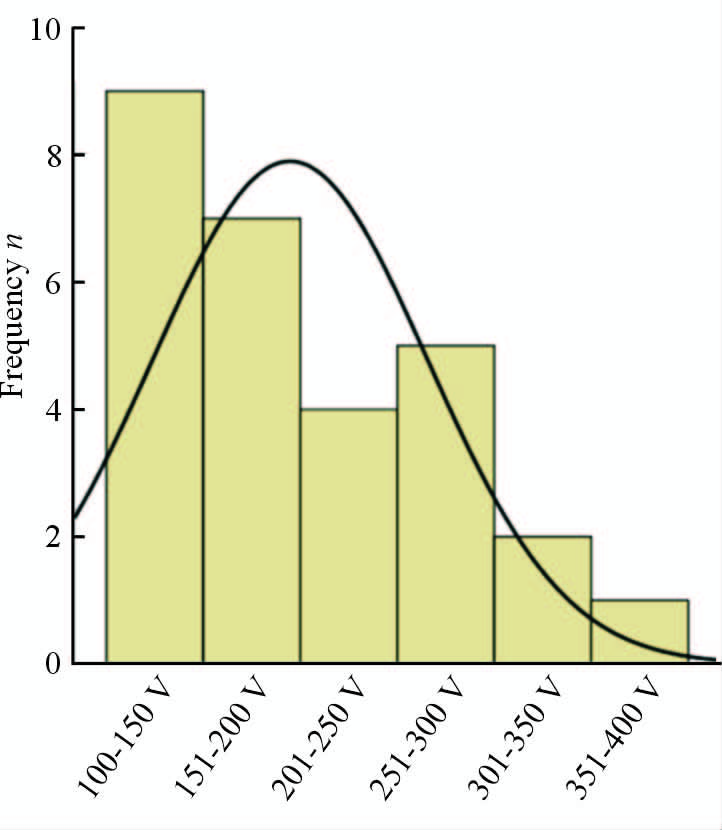
|
图 2 28例患者的CPSE-MEP监测刺激阈值分布 Fig 2 Basic stimulation threshold distributions for CPSE-MEP in 28 patients |
2.2 阈值刺激模式CPSE-MEP监测的体动
本研究采用异丙酚和瑞芬太尼静脉麻醉维持术中全身麻醉,加用少量非去极化肌松剂顺阿曲库铵,按常规颅脑手术标准剂量的1/3持续静脉推注,神经肌肉阻滞控制TOF值为2~3。本研究加用靶控输注技术、TOF监测及监测双侧电位来保持麻醉稳定。28例患者术中MEP分化良好,刺激阈值稳定,监测期间生命征平稳,未见咬管、咬舌或全身抽动等体动事件;仅1例予电刺激同时出现肉眼可见的颞肌收缩,但不干扰手术操作。
2.3 阈值刺激模式CPSE-MEP监测运动功能的敏感性和特异性排除仪器故障及麻醉影响,28例患者中有5例术中CPSE-MEP出现异常,其中2例为可逆性的阈值上升,术后无新的运动功能障碍;3例动脉瘤夹闭后出现不可逆的阈值上升或波形消失,立即采用调整动脉瘤夹及脑压板位置等干预措施后未恢复,其中2例术后出现永久性轻瘫(典型病例见图 3),1例术后未见新的神经功能障碍。阈值刺激模式下CPSE-MEP监测运动功能的敏感性为100%(2/2),特异性为96.30%(26/27)。见表 1。

|
图 3 典型病例影像图及CPSE-MEP监测 Fig 3 A typical case: imaging and CPSE-MEP |
|
|
表 1 28例患者术中CPSE-MEP变化与术后运动功能的关联性 Tab 1 Relevance of intraoperative CPSE-MEP variation with postoperative motor function in 28 patients |
3 讨 论
脑动脉瘤锁孔手术中联合应用肌源性MEP及SEP监测在降低载瘤动脉的临时阻断、载瘤及邻近重要血管的误夹、过度脑牵拉、血管痉挛或小穿支血管损害等原因导致的永久性神经功能损伤中的作用已得到证实,并且MEP对在监测皮质下由缺血导致的运动功能损伤的敏感性[8-10]。然而TES-MEP监测时需较高的电刺激强度(仅有约20%的电流可进入颅内,甚至头皮和颅内之间电流密度的衰减可达30倍[3]),可能出现深部皮质下运动传导通路直接激活,出现假阴性结果[1, 11]。
Watanabe等[6]提出以CPSE的刺激方式在脑和脊髓肿瘤手术中进行MEP监测。颅骨内螺钉电极更靠近皮质表面,电阻小,可使刺激电流有效穿过颅骨,所需刺激电流更少,刺激更集中,在复合麻醉下也能够安全、有效地进行MEP监测;随后Goto等[12]也将该技术成功应用于后颅窝肿瘤术中面神经MEP监测,证实其可行性和安全性良好。本研究中CPSE-MEP监测基础刺激阈值为100~380 V,平均(194.71±70.71)V,多数病例在100~150 V时即可成功诱发出MEP波形,非手术侧TES能成功引出MEP波形的有21例。CPSE-MEP监测刺激成功率明显高于TES-MEP监测,刺激强度也低于文献报道的刺激阈值300~400 V;本组病例未见由螺钉电极装置引起的脑脊液漏、电极断裂、出血和感染等并发症,证实其可行性和安全性良好。
MEP监测的特异性和敏感性与术中MEP警报标准的应用有关[8]。现采用的MEP警报标准主要有2种:(1)MEP波幅降低大于基线的50%或者80%;(2)以MEP波形的“有或无”作为损伤的指标。然而由于波形的变异性、易受麻醉剂影响及高度敏感性,术中肌源性MEP的警报标准仍存在争议[5]。Calancie等[13-14]对采用TES-MEP行术中神经电生理监测的大样本脊髓手术患者进行研究,发现反复电刺激MEP阈值逐渐升高者,往往出现在目标肌肉信号完全消失前的数分钟至数小时内,而这些患者术后伴有轻度肢体偏瘫。Irie等[9]报道在行TES-MEP监测时使用500 V的刺激强度出现了6例假阴性。而降低刺激电量,使用接近于阈值的刺激能够预防深部皮质脊髓纤维激活,使经颅MEP监测更准确,因此推荐使用最低的刺激强度[1, 10]。本研究由此提出第3种阈值模式警报标准,认为阈值模式对中枢运动系统功能完整性的判读有很好的敏感性和特异性,也能尽早地提醒术者予以适当干预。
本研究采用阈值模式作为术中CPSE-MEP的警报标准。28例患者中有5例术中MEP出现异常,采取干预措施后,2例为可逆性的阈值上升,术后无新的运动功能障碍;3例为不可逆的阈值上升或波形消失,其中2例术后出现永久性轻瘫,1例术后未见新的神经功能障碍。由此可得阈值刺激模式CPSE-MEP监测运动功能的敏感性为100%(2/2),特异性为96.30%(26/27),未见假阴性结果。提示术中MEP刺激阈值变化与术后运动功能之间具有强关联性,能有效降低皮质下运动传导通路泛化的发生,降低假阴性率。
TES-MEP监测时成串电刺激可能诱发患者肌肉颤动而引起体动[7]。2013年美国神经电生理监测协会发表的术中MEP监测共识指出:对多脉冲刺激引起的体动可能造成损伤的担心在手术中是公认的、广泛存在的;出现明显体动时,只能通过选择合适的时机或与术者沟通并暂停手术再行MEP监测[5]。大约1%~10%的患者由于强烈的肌肉颤动导致其在动脉瘤分离或夹闭时无法连续进行MEP监测[10, 15-18]。这种体动将干扰手术操作,使术者分心,尤其在脑血管手术中使保护性监测受到限制[19-20]。因此,如何在不影响监测成功率及敏感性的前提下降低体动的发生,将有助于MEP监测的广泛开展。
本研究采用阈值刺激模式下CPSE-MEP监测,多数患者刺激强度在100~150 V之间,最大限度地避免了刺激强度大对患者体动的影响。28例患者术中MEP分化良好,刺激阈值稳定,监测期间生命体征平稳,未见咬管、咬舌或全身抽搐等体动事件;仅1例予电刺激同时出现肉眼可见的颞肌收缩,但并不干扰手术操作。表明在以全静脉麻醉为基础、加用部分神经肌肉阻滞剂的麻醉维持方案下行CPSE-MEP监测可减少MEP监测的体动,减少对手术操作的干扰。
综上所述,在脑动脉瘤手术中采用阈值刺激模式进行CPSE-MEP监测是可行、安全可靠的,对脑缺血所致运动功能损伤具有良好的敏感性和特异性,可作为常规TES-MEP监测的一种替代方法。
| [1] | SZELENYI A, LANGER D, BECK J, RAABE A, FLAMM E S, SEIFERT V, et al. Transcranial and direct cortical stimulation for motor evoked potantial monitoring in intracerebral aneurysm surgery[J]. Clin Neurophysiol , 2007, 37 :391–398. DOI:10.1016/j.neucli.2007.09.006 |
| [2] | YEON J Y, SEO D W, HONG S C, KIM J S. Transcranial motor evoked potential monitoring during the surgical clipping of unruptured intracranial aneurysms[J]. J Neurol Sci , 2010, 15 :29–34. |
| [3] | LEVY W J, YORK D H, MCCAFFREY M, TANZER F. Motor evoked potentials from trans-cranial stimulation of the motor cortex in humans[J]. Neurosurgery , 1984, 15 :287–302. DOI:10.1227/00006123-198409000-00001 |
| [4] | BARTLEY K, WOODFORTH I J, STEPHEN J P, BURKE D. Corticospinal volleys and compound muscle action potentials produced by repetitive transcranial stimulation during spinal surgery[J]. Clin Neurophysiol , 2002, 113 :78–90. DOI:10.1016/S1388-2457(01)00711-8 |
| [5] | MACDONALD D B, SKINNER S, SHILS J, YINGLING C. Intraoperative motor evoked potential monitoring-a position statement by the American Society of Neurophysiological Monitoring[J]. Clin Neurophysiol , 2013, 124 :2291–2316. DOI:10.1016/j.clinph.2013.07.025 |
| [6] | WATANABE K, WATANABE T, TAKAHASHI A, SAITO N, HIRATO M, SASAKI T. Transcranial electrical stimulation through screw electrodes for intraoperative monitoring of motor evoked potentials[J]. J Neurosurg , 2004, 100 :155–160. DOI:10.3171/jns.2004.100.1.0155 |
| [7] | HEMMER L B, ZEENI C, BEBAWY J F, BENDOK B R, COTTON M A, SHAH N B, et al. The incidence of unacceptable movement with motor evoked potentials during craniotomy for aneurysm clipping[J]. World Neurosurgery , 2012, 5 :1–6. |
| [8] | GUO L, GELB A W. The use of motor evoked potential monitoring during cerebral aneurysm surgery to predict pure motor deficits due to subcortical ischemia[J]. Clin Neurophysiol , 2011, 122 :648–655. DOI:10.1016/j.clinph.2010.09.001 |
| [9] | IRIE T, YOSHITANI K, OHNISHI Y, SHINZAWA M, MIURA N, KUSAKA Y, et al. The efficacy of motor-evoked potentials on cerebral aneurysm surgery and new-onset postoperative motor deficits[J]. J Neurosurg Anesthesiol , 2010, 22 :247–251. DOI:10.1097/ANA.0b013e3181de4eae |
| [10] | NEULOH G, SCHRAMM J. Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular Doppler ultrasonography in cerebral aneurysm surgery[J]. J Neurosurg , 2004, 100 :389–399. DOI:10.3171/jns.2004.100.3.0389 |
| [11] | BARTLEY K, WOODFORTH I J, STEPHEN J P, BURKE D. Corticospinal volleys and compound muscle action potentials produced by repetitive transcranial stimulation during spinal surgery[J]. Clin Neurophysiol , 2002, 113 :78–90. DOI:10.1016/S1388-2457(01)00711-8 |
| [12] | GOTO T, MURAOKA H, KODAMA K, HARA Y, YAKO T, HONGO K, et al. Intraoperative monitoring of motor evoked potential for the facial nerve using a cranial peg-screw electrode and a "threshold-level" stimulation method[J]. Skull Base , 2010, 20 :429–433. DOI:10.1055/s-0030-1261270 |
| [13] | CALANCIE B, MOLANO M R. Alarm criteria for motor-evoked potentials: what's wrong with the "presence-or-absence" approach?[J]. Spine , 2008, 33 :406–414. DOI:10.1097/BRS.0b013e3181642a2f |
| [14] | CALANCIE B, HARRIS W, BRINDLE G F, GREEN B A, LANDY H J. Threshold-level repetitive transcranial electrical stimulationfor intraoperative monitoring of central motor conduction[J]. J Neurosurg , 2001, 95 :161–168. |
| [15] | HISHINUMA N, TANAKA S, KAWAMATA M, KAWAGUCHI M, YOSHITANI K, UCHINO H, et al. Current status of intraoperative motor evoked potential monitoring: a questionnaire study[J]. Masui , 2012, 61 :1291–1298. |
| [16] | SLOAN T B. Muscle relaxant use during intraoperative neurophysiologic monitoring[J]. J Clin Monit Comput , 2013, 27 :35–46. DOI:10.1007/s10877-012-9399-0 |
| [17] | KAN Q, HAN R Q. Effects of muscle relaxants on motor evoked potentials monitoring during intracranial surgery in functional area[J]. Chin J Rehabil Theory Pract , 2009, 15 :279–280. |
| [18] | MOTOYAMA Y, KAWAGUCHI M, YAMADA S, NAKAGAWA I, NISHIMURA F, HIRONAKA Y, et al. Evaluation of combined use of transcranial and direct cortical motor evoked potential monitoring during unruptured aneurysm surgery[J]. Neurol Med Chir(Tokyo) , 2011, 51 :15–22. DOI:10.2176/nmc.51.15 |
| [19] | SLOAN T B, JANIK D, JAMESON L. Multimodality monitoring of the central nervous system using motor-evoked potentials[J]. Curr Opin Anaesthesiol , 2008, 21 :560–564. DOI:10.1097/ACO.0b013e32830f1fbd |
| [20] | SZELÉNYI A, LANGER D, KOTHBAUER K, DE CAMARGO A B, FLAMM E S, DELETIS V. Monitoring of muscle motor evoked potentials during cerebral aneurysm surgery: intraoperative changes and postoperative outcome[J]. J Neurosurg , 2006, 105 :675–681. DOI:10.3171/jns.2006.105.5.675 |
 2016, Vol. 37
2016, Vol. 37


