2. 同济大学附属同济医院血液科, 上海 200065
2. Department of Hematology, Tongji Hospital, Tongji University, Shanghai 200065, China
造血(hemopoiesis)是一个非常复杂的过程,具有严格的时间和空间特异性。小鼠原始造血发生于胎龄7.5 d(embryonic day 7.5,E7.5)卵黄囊(yolk sac,YS)血岛[1],永久造血起源于E10.5主动脉-性腺-中肾(aorta-gonad-mesonephros,AGM)区[2],随后迁移至胎肝(fetal liver,FL)、脾脏和骨髓(bone marrow,BM) [3]。不同造血组织来源的红系造血祖细胞(colony forming unit-erythroid,CFU-E)能分化为成熟的血细胞,维持正常的血液循环系统,从而反映造血干细胞(hematopoietic stem cell,HSC)数量的变化,对于理解小鼠个体发育中造血系统的形成具有重要的借鉴作用[4]。
造血与造血微环境和信号通路密切相关。维甲酸(retinoic acid,RA)信号通路在胚胎发育、细胞分化及免疫中具有重要作用[5],有研究表明RA参与调控小鼠胚胎YS造血发育和AGM区造血的形成[6-7]。本实验以小鼠胚胎YS、AGM区、FL和成年小鼠BM为研究对象,检测RA受体(RA receptors,RARs)及其合成酶在小鼠胚胎造血不同阶段、不同造血位点的转录水平,以期为小鼠胚胎造血发育中RA信号分子机制的研究奠定基础。
1 材料和方法 1.1 实验小鼠6~8周龄雌、雄性清洁级ICR小鼠,体质量28~35 g,购自上海西普尔-必凯实验动物有限公司[动物生产许可证号:SCXK(沪)2013-0016;使用许可证号:SYXK(沪)2012-0031],饲养于同济大学附属同济医院实验动物中心。开展的所有实验动物研究均符合2006年国家科学技术部发布的《关于善待实验动物的指导性意见》的要求。
1.2 试剂与实验器材磷酸盐缓冲液(PBS)、4%多聚甲醛(PFA)、0.25%胰酶、胎牛血清(FBS)、红细胞裂解液、H-E染料、分析天平、70目尼龙过滤网、眼科剪2把、眼科镊子2把、胰岛素针2支、35 mm和100 mm培养皿、15 mL 离心管。解剖显微镜、光学显微镜、切片机、ABI 7900HT 实时定量PCR仪、Eppendorf 5702R低温离心机。
1.3 方法 1.3.1 孕鼠胚胎造血部位及成年小鼠BM的获取于傍晚将ICR雌、雄小鼠按3∶1比例合笼过夜,次日清晨将观察到有阴道栓的雌鼠予以分笼喂养,记为E0.5。分别于E9.5取出YS,E10.5和E11.5取出AGM区,E13.5、E14.5和E17.5取出FL。孕鼠胚胎造血部位获取方法:颈椎脱臼处死妊娠小鼠,立即用75%乙醇喷洒腹部,剪开腹腔,定位2个子宫角,剪断子宫颈,剪下子宫系膜,用镊子将子宫拉出体腔,立即放入含10% FBS的PBS培养皿中。在解剖显微镜下分别剥除胎膜和胎盘,取E9.5 YS;截取胎鼠前、后肢芽中间部分,去除背部体节和肠系膜等,分离获取E10.5和E11.5 AGM区;打开胎鼠胸腔,暴露内脏,小心分离E13.5、E14.5和E17.5 FL。成年小鼠BM获取方法:颈椎脱臼处死6周龄雌鼠,立即置于75%乙醇中浸泡3~5 min,使用眼科剪去除双下肢皮毛及软组织,截取双下肢股骨及胫骨,剪开骨骼两端后使用含10% FBS的PBS冲洗骨髓腔,收集冲洗液。
1.3.2 BM红细胞的去除取新鲜BM于4 ℃ 500×g离心5 min,弃上清。加入1 mL红细胞裂解液,轻轻吹打混匀,冰上裂解10 min。500×g离心5 min,弃红色上清,加入1 mL PBS重悬细胞沉淀。
1.3.3 E11.5胎鼠 AGM区的H-E染色将E11.5小鼠前、后肢芽中间部分用4% PFA固定,6 h后换15%蔗糖溶液脱水,12 h后换30%蔗糖溶液继续脱水,24 h后进行标本横断面冰冻切片,行H-E染色。
1.3.4 实时荧光定量PCR检测RARs相关基因的表达使用TRIzol®试剂(美国生命技术公司)分别提取不同时间点小鼠胚胎YS、AGM区、FL和成年小鼠BM的总RNA,用分光光度计测量RNA浓度。
使用PrimeScriptTM RT试剂盒(RR047A,TaKaRa公司)进行RNA反转录,具体步骤如下: 400 ng RNA,加入2.0 μL 5×gDNA Eraser Buffer,1.0 μL gDNA Eraser,用RNase-free水补齐至10 μL。42 ℃反应2 min后立即放置冰上。在上一步反应完成的10 μL体系基础上,加入1.0 μL PrimeScriptTM RT Enzyme Mix,1.0 μL RT Primer Mix,4.0 μL 5×PrimeScriptTM Buffer,用4.0 μL的RNase-free水补齐至20 μL。37 ℃反应15 min,85 ℃反应5 s,4 ℃终止反应。
采用上海翊圣生物科技有限公司销售的HieffTM qPCR SYBR® Green Master Mix(High Rox Plus)行实时荧光定量PCR,检测RARs不同亚型RAR-α、RAR-β、RAR-γ及其合成酶视黄醛脱氢酶1(retinal dehydrogenase 1,Raldh1)和Raldh2的表达。具体反应体系如下:Master Mix(High Rox Plus)5 μL,上游引物0.2 μL,下游引物0.2 μL,cDNA 50 ng,用RNase-free水补齐至10 μL。应用ABI 7900HT PCR仪进行反应: 95 ℃ 5 min预变性;95 ℃解链10 s、60 ℃反应30 s,40个循环。以GAPDH作为内参基因,用2-ΔΔCT法计算各基因的相对表达量。各基因引物序列见表 1。每个样本(YS、AGM区、FL和BM)均取3只孕鼠/成年小鼠,每只孕鼠取7个胚胎的YS、AGM区和FL。实验重复3次。
|
|
表 1 各基因引物序列 Tab 1 List of primers used for quantitative real-time PCR |
1.4 统计学处理
应用SPSS 20.0软件进行统计学分析,各组数据均以x±s表示,各时间点不同造血部位基因表达量的比较采用单因素方差分析(one-way ANOVA)。检验水准(α)为0.05。
2 结果 2.1 E11.5胎鼠AGM区的解剖过程腹腔可见“Y”字形串珠状子宫,约8~12枚。显微镜下可见此时的胚胎血液循环已经建立。子宫与胎盘相连,YS包裹与卵黄动脉、脐带相连的胚体。AGM区为去除背侧神经管后的下方条形组织,中空结构,背主动脉明显。见图 1。
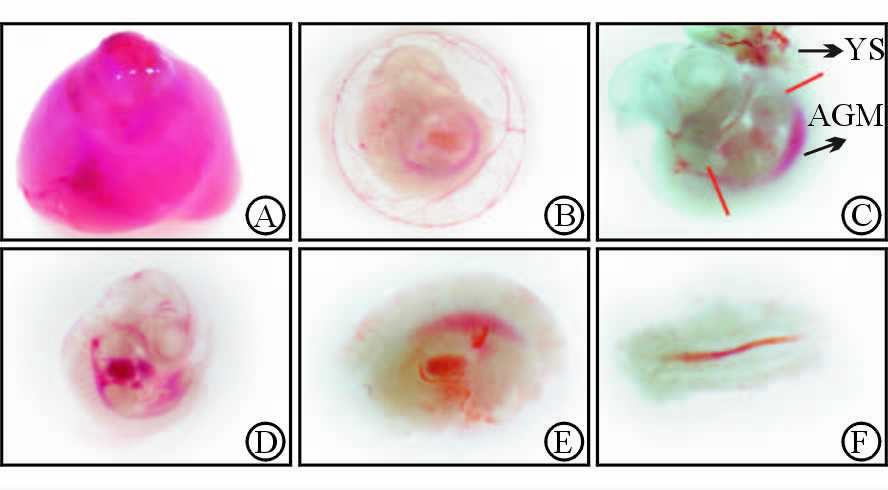
|
图 1 E11.5胎鼠AGM区的解剖示意图 Fig 1 Image of anatomy E11.5 mouse AGM region |
2.2 E11.5胎鼠AGM区H-E染色结果
E11.5胎鼠前后肢芽中间部分横断面切片中可分辨出明显的神经管顶板、背主动脉、中肾管(Wolffian管)及中肾旁管(Müllerian管),背主动脉腔内可见较多的造血细胞,且主动脉血管内皮细胞连接造血细胞(图 2)。
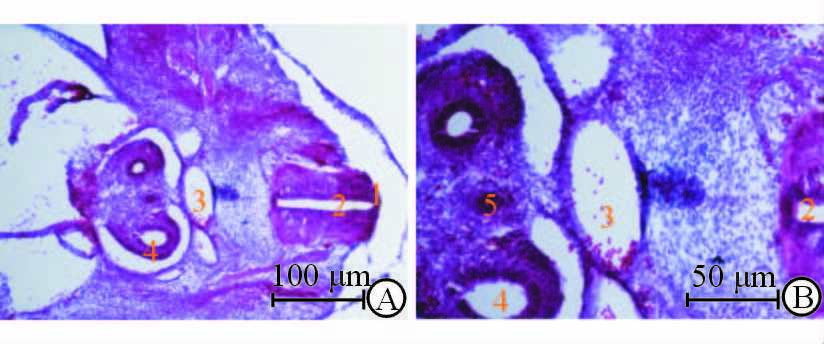
|
图 2 E11.5小鼠AGM区H-E染色结果 Fig 2 H-E staining of E11.5 mouse AGM region |
2.3 RARs相关基因在胎鼠YS、AGM区、FL和成年小鼠BM中的表达
运用实时荧光定量PCR技术分析小鼠胚胎YS、AGM区、FL和成年小鼠BM中RARs不同亚型及其合成酶在时间和空间上的表达差异,结果(图 3)显示RAR-α、RAR-β、RAR-γ、Raldh1和Raldh2在这4种造血组织中均有表达。

|
图 3 实时荧光定量PCR检测RARs不同亚型及其合成酶的表达 Fig 3 The expression of RARs and its synthetase were assessed by quantitative RT-PCR |
E10.5 AGM区中RAR-α、RAR-β、RAR-γ及Raldh1、Raldh2的表达水平低于E9.5 YS组(P<0.01);E11.5 AGM区中RAR-α、RAR-β、RAR-γ及Raldh1、Raldh2的表达较E10.5 AGM区升高(P<0.01)。
E13.5~E17.5 FL内RAR-α、RAR-β、RAR-γ及Raldh1、Raldh2的表达水平低于E11.5 AGM区(P<0.01)。E13.5~E17.5 FL内RAR-β、RAR-γ及Raldh1、Raldh2的表达水平比较差异无统计学意义。RAR-α在E14.5 FL中的表达高于E13.5 FL(P<0.01)和E17.5 FL(P<0.05)。在成年小鼠BM中,RAR-α、RAR-β、RAR-γ及Raldh1、Raldh2的表达水平均高于E17.5 FL(P<0.01)。
3 讨论RA是一类氧化代谢产物,在胚胎发育、器官形成、细胞分化及免疫效应中发挥着重要的作用[5]。而RA对胚胎造血具体机制的深入研究或许可促进血液病学临床治疗方面的重大进展。RA主要通过其胞核受体来发挥作用,目前共发现RARs和维甲酸X受体(RXRs)两大类子受体家族,每类受体家族均包括α、β和γ 3种亚型及多种异构体[8]。Raldh1、Raldh2和Raldh3是小鼠胚胎发育时期的RA合成酶,其中Raldh2是RA合成的关键酶[9]。在小鸡和小鼠视网膜发育过程中,Raldh2和Raldh3在视网膜色素上皮细胞和腹侧神经视网膜中均有表达;其中,Raldh3主要分布于小鼠早期胚胎头部神经节隆起部位,在上皮细胞中高表达,而与胚胎造血没有直接关系[10]。
小鼠胚胎造血发育表现为不同造血位点在不同发育阶段连续发生的过程。HSC是存在于不同造血组织中的始祖细胞,能增殖、分化为各系造血祖细胞,如CFU-E等,再进一步分化为成熟的血细胞,维持正常的血液循环系统。文献报道,不同造血组织来源的CFU-E反映了HSC数量的变化,以便我们更好地理解小鼠个体发育中造血系统的形成[4, 11]。因此,本研究以既往报道的CFU-E、原始红细胞集落形成单位(primitive erythroid colony forming cells,EryP-CFC)以及脾集落形成单位(colony forming unit-spleen,CFU-S)等来解释RA与胚胎造血的相关性。近年来,研究发现RA除参与调节胚胎发育外,还能够调控胎鼠E10.5和E11.5 AGM区造血的形成[12],但目前有关RARs不同亚型及其合成酶在小鼠胚胎造血发育中的表达水平变化规律的研究并不完整,因此,本实验进一步探讨小鼠胚胎造血发育不同阶段RAR-α、RAR-β、RAR-γ、Raldh1和Raldh2的表达规律。
Goldie等[6]研究发现Raldh2基因敲除导致小鼠E9.5 YS血管缺陷。Palis等[1]将E7 YS来源的造血细胞接种至甲基纤维素造血分化培养基上进行造血集落培养,收集到首个表达胚胎和成体珠蛋白的EryP-CFC,EryP-CFC产生的集落由大量有核原始红细胞组成。EryP-CFC仅局限于YS,到E8.25时数量达到高峰,而CFU-E产生的集落仅由少量永久红细胞组成,到E9.5时数量达到高峰[1]。由此说明YS短暂地参与永久造血。在本实验中,RARs在胎鼠E9.5 YS中相对高表达,与Palis等[1]研究中的造血发育中E9.5 YS来源的CFU-E数量峰值重叠,推测RA与原始造血相关,且短暂参与永久红细胞的形成。
到E10.5和E11.5时,YS中的CFU-E数量明显降低,永久造血祖细胞逐渐迁移至AGM区并大量增殖、分化。11 d后,CFU-S11数量不断增加,E11.0 AGM区来源的CFU-S11对永久造血的贡献最大,是迁移至循环系统中造血细胞最主要的来源[13]。在本实验中,E11.5 AGM区中RAR-α、RAR-β、RAR-γ、Raldh1和Raldh2基因一致高表达,且表达比较稳定。此外,其在E11.5 AGM区的表达量较E10.5 AGM区升高,与文献报道的E11.0 AGM区来源的CFU-S11对永久造血具有最大贡献[13]相符合。这也进一步验证了RA与胚胎早期造血密切相关,并在原始造血和永久造血中具有重要作用。
研究发现小鼠胚胎E18.0 BM中集落形成细胞(colony forming cells,CFCs)数量非常少,共约有103,小鼠出生4 d后,CFCs数量也仅约104,随后CFCs数量急剧上升,直至成年小鼠水平。而小鼠胚胎E18.0 FL中95%为CFCs,从出生开始,FL中CFCs逐渐减少,直至不再出现。提示造血祖细胞的扩增是有限的,CFCs并非完全从FL向BM迁移[14]。Huang等[15]研究发现RA信号通路主要成员(包括RARs、RXRs、Raldh1和Raldh2)在小鼠肝脏发育不同时期表达,其中RAR-α在E14.5 FL中高表达,RAR-β在围产期表达很低,RAR-γ在胚胎期几乎检测不到,出生后表达逐渐增加。本实验E13.5 FL中RAR-α、RAR-β、RAR-γ、Raldh1和Raldh2基因表达量降低,且在E13.5~E17.5 FL中RAR-β、RAR-γ、Raldh1和Raldh2基因均低表达,样本间表达量差异无统计学意义,到成年小鼠时BM中的RA信号相关基因上调。因此,推测RA对FL的造血形成作用较小,且RA并非完全影响从FL向BM迁移的造血过程。此外,E14.5 FL中RAR-α表达上调,到E17.5时表达下调,这正说明了RAR-α对FL永久造血作用的重要性。
本实验以RARs为切入点,研究RARs不同亚型RAR-α、RAR-β、RAR-γ及其合成酶Raldh1和Raldh2在胚胎造血不同发育阶段的表达变化,从时间和空间角度分析了小鼠胚胎造血发育时RARs对造血形成的影响,为今后相关信号通路的分子机制研究奠定了基础。但本研究仅是建立在对胚胎组织特定基因mRNA表达水平上的分析,尚需进一步进行细胞及分子水平的验证。
| [1] | PALIS J, ROBERTSON S, KENNEDY M, WALL C, KELLER G. Development of erythroid and myeloid progenitors in the yolk sac and embryo proper of the mouse[J]. Development , 1999, 126 :5073–5084. |
| [2] | BRUIJN M F, SPECK N A, PEETERS M C, DZIERZA K E. Definitive hematopoietic stem cells first develop within the major arterial regions of the mouse embryo[J]. EMBO J , 2000, 19 :2465–2474. DOI:10.1093/emboj/19.11.2465 |
| [3] | YOSHIMOTO M, YODER M C. Developmental biology: birth of the blood cell[J]. Nature , 2009, 457 :801–803. DOI:10.1038/457801a |
| [4] | BARMINKO J, REINHOLT B, BARON M H. Development and differentiation of the erythroid lineage in mammals[J]. Dev Comp Immunol , 2016, 58 :18–29. DOI:10.1016/j.dci.2015.12.012 |
| [5] | EVANS T R, KAYE S B. Retinoids: present role and future potential[J]. Br J Cancer , 1999, 80 (1/2) :1–8. |
| [6] | GOLDIE L C, LUCITTI J L, DICKINSON M E, HIRSCHI K K. Cell signaling directing the formation and function of hemogenic endothelium during murine embryogenesis[J]. Blood , 2008, 112 :3194–3204. DOI:10.1182/blood-2008-02-139055 |
| [7] | CHANDA B, DITADI A, ISCOVE N N, KELLER G. Retinoic acid signaling is essential for embryonic hematopoietic stem cell development[J]. Cell , 2013, 155 :15–27. DOI:10.1016/j.cell.2013.09.012 |
| [8] | MENÉNDEZ-GUTIÉRREZ M P, RÖSZER T, FUENTES L, NÚÑEZ V, ESCOLANO A, REDONDO J M, et al. Retinoid X receptors orchestrate osteoclast differentiation and postnatal bone remodeling[J]. J Clin Invest , 2015, 125 :809–823. DOI:10.1172/JCI77186 |
| [9] | FITCH S R, KIMBER G M, WILSON N K, PARKER A, MIRSHEKAR-SYAHKAL B, GÖTTGENS B, et al. Signaling from the sympathetic nervous system regulates hematopoietic stem cell emergence during embryogenesis[J]. Cell Stem Cell , 2012, 11 :554–566. DOI:10.1016/j.stem.2012.07.002 |
| [10] | LI H, WAGNER E, MCCAFFERY P, SMITH D, ANDREADIS A, DRÄGER U C. A retinoic acid synthesizing enzyme in ventral retina and telencephalon of the embryonic mouse[J]. Mech Dev , 2000, 95 (1/2) :283–289. |
| [11] | QIU C, OLIVIER E N, VELHO M, BOUHASSIRA E E. Globin switches in yolk sac-like primitive and fetal-like definitive red blood cells produced from human embryonic stem cells[J]. Blood , 2008, 111 :2400–2408. DOI:10.1182/blood-2007-07-102087 |
| [12] | RHINN M, DOLLÉ P. Retinoic acid signalling during development[J]. Development , 2012, 139 :843–858. DOI:10.1242/dev.065938 |
| [13] | MEDVINSKY A, DZIERZAK E. Definitive hematopoiesis is autonomously initiated by the AGM region[J]. Cell , 1996, 86 :897–906. DOI:10.1016/S0092-8674(00)80165-8 |
| [14] | WOLBER F M, LEONARD E, MICHAEL S, ORSCHELL-TRAYCOFF C M, YODER M C, SROUR E F. Roles of spleen and liver in development of the murine hematopoietic system[J]. Exp Hematol , 2002, 30 :1010–1019. DOI:10.1016/S0301-472X(02)00881-0 |
| [15] | HUANG J, BI Y, ZHU G H, HE Y, SU Y, HE B C, et al. Retinoic acid signalling induces the differentiation of mouse fetal liver-derived hepatic progenitor cells[J]. Liver Int , 2009, 29 :1569–1581. DOI:10.1111/liv.2009.29.issue-10 |
 2016, Vol. 37
2016, Vol. 37


