烟雾病(Moyamoya disease,MMD)是一种以颅底双侧大动脉进行性狭窄甚至闭塞为特征的先天性脑血管疾病。MMD 的诊断需要排除动脉粥样硬化、动脉炎等其他原因导致的烟雾样改变,特别是临床常见的动脉粥样硬化烟雾综合征(atherosclerotic Moyamoya syndrome,AS-MMS)。MMD和AS-MMS的发病机制、治疗及预后均不同。AS-MMS需要抗血小板、调脂稳定斑块等药物治疗,外科治疗效果不佳[1-2];而MMD药物治疗无效,需要外科手术治疗。因此,两者的鉴别诊断有重要的临床意义,决定着患者的治疗方案及预后。数字减影血管造影(digital substraction angiography,DSA)、计算机断层扫描血管成像(computed tomography angiography,CTA)及磁共振血管成像(magnetic resonance angiography,MRA)等传统动脉影像检查均关注血管内径,无法正确评估血管外径及管壁情况。高分辨率磁共振成像(high-resolution magnetic resonance imaging,HR-MRI)是利用“黑血”和“白血”技术直接观察脑血管壁、血管腔,模拟大体病理的活体诊断方法,不仅可以评估管腔狭窄程度,还可以评估血管壁的病理改变及重塑现象。本研究旨在应用HR-MRI技术分析比较MMD和AS-MMS成年患者大脑中动脉(middle cerebral artery,MCA)管壁成像的特征,阐明MMD和AS-MMS的影像学鉴别要点。
1 对象和方法 1.1 研究对象回顾性分析2012年3月至2015年8月第二军医大学长海医院临床确诊的MMD和AS-MMS成年患者各24例的临床资料。MMD诊断标准参照2012年日本厚生省MMD研究委员会修订的诊治指南[3]:(1)颈内动脉(ICA)终末段和(或)大脑前动脉(ACA)和(或)MCA起始段狭窄或闭塞;(2)闭塞动脉周围有异常血管网;(3)上述表现应为双侧。并排除动脉粥样硬化、自身免疫性疾病等。AS-MMS患者是具有至少2个或以上动脉粥样硬化危险因素(年龄>60岁、高血脂、糖尿病、高血压病),且颈部超声或头部CTA提示存在动脉粥样硬化的单侧或双侧ICA末端狭窄或闭塞,或合并ACA和(或)MCA起始段出现异常血管网类似烟雾样改变的患者[4]。所有患者均采用3.0T磁共振仪(HDX platform,GE Healthcare,Milwaukee)行HR-MRI:首先获得3D-TOF图像,随后对MCA M1段由内至外采用12层覆盖,后进行T2WI扫描。测量血管管径时,将图像放大2.5倍,采用电子尺测量,精确度至0.1 mm。
1.2 临床资料分析由2位专科医生分别分析2组患者的所有临床资料,包括基线资料、头部CTA、超声、DSA等,根据上述诊断标准确认诊断。诊断一致后再对比分析2组患者的年龄、性别、发病形式、糖尿病、高脂血症、高血压、既往卒中史。根据DSA造影结果对MMD组患者进行Suzuki分级。
1.3 HR-MRI结果判断所有HR-MRI影像结果由2名不知道临床诊断的专科医生进行阅读分析。测量MCA最狭窄处(闭塞血管测量闭塞前一层面)血管的内、外径,管壁厚度,管壁形态,信号强度,增强效应,以及MCA附近微小血管结构。血管的内径和外径、管壁厚度、管壁形态以及附近微小血管结构评价均在T2WI成像上进行;增强效应评价在T1WI增强成像上进行。重构指数(remodeling index,RI)计算公式为:RI(%)=最窄层面血管面积/参考层面血管面积×100%,根据RI将病变分为阳性重构(RI≤0.95)和阴性重构(RI≥1.05),0.95<RI<1.05则为无明显重构[5]。参考层面血管面积使用病变近心段正常层面面积[6]。
1.4 统计学处理采用SPSS 18.0软件进行数据分析。计量资料均符合正态分布,以x±s表示,组间比较采用t检验。计数资料以百分比表示,组间比较采用χ2检验。以上统计均采用双侧检验,检验水准(α)为0.05。采用ROC曲线分析MCA血管外径对MMD和AS-MMS的鉴别诊断价值。
2 结 果 2.1 两组患者一般情况MMD组和AS-MMS组患者各24例,临床资料见表 1。MMD组患者平均年龄低于AS-MMS组(P<0.05)。MMD组男性10例,AS-MMS组男性16例,两组性别构成比差异有统计学意义(P<0.05)。MMD组患者的危险因素(高血压病、糖尿病、高脂血症、吸烟史和既往卒中史)均低于AS-MMS组(P<0.05)。
|
|
表 1 MMD组和AS-MMS组患者基线资料 Tab 1 The baseline data of patients in MMD and AS-MMS groups |
2.2 两组患者MRA和HR-MRI结果分析
MRA结果显示,MMD组24例患者均表现为双侧MCA重度狭窄(或闭塞)(血管管径缩窄≥70%或信号丢失、未见管腔);AS-MMS组患者双侧MCA重度狭窄(或闭塞)14例,单侧MCA重度狭窄(或闭塞)10例。HR-MRI显示MMD组患者MCA血管内、外径[(1.24±0.48)、(2.70±0.44) mm]均小于AS-MMS组[(1.79±0.52)、(3.31±0.54) mm],其中两组血管外径差异有统计学意义(P<0.05)。MMD组患者MCA管壁厚度较AS-MMS组增厚[(1.99±0.32) mm vs (1.39±0.57) mm,P<0.05]。MMD组有8例患者MCA显示有增强效应,其中6例为环形增强;AS-MMS组有12例患者有增强效应,其中10例为局灶性半月形增强。两组MCA增强效应比较差异有统计学意义(P<0.05)。MMD组患者平均RI低于AS-MMS组,差异有统计学意义[(0.86±0.12) vs (1.05±0.21),P<0.05],其中MMD组多为阴性重构(79.17%,19/24),AS-MMS组多为阳性重构(75.00%,18/24)。MMD组患者中有20例(83.33%)HR-MRI可见MCA附近微小血管结构,而AS-MMS组有6例(24.17%),两组比较差异有统计学意义(P<0.05)。MMD组和AS-MMS组典型患者的HR-MRI影像学资料分别见图 1、2。
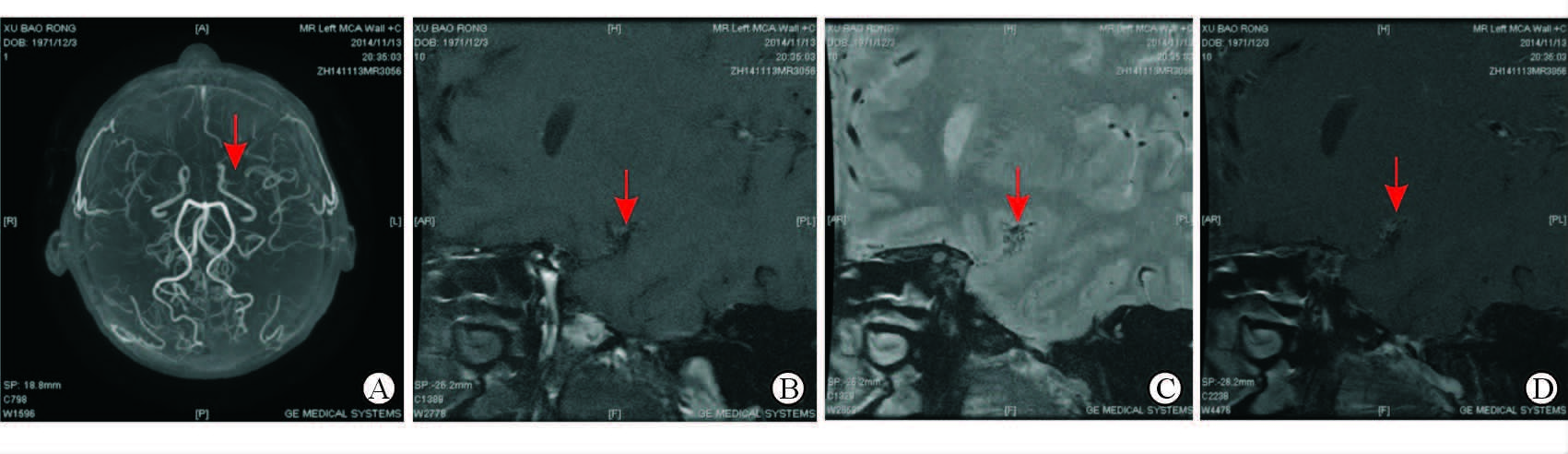
|
图 1 1例MMD患者的HR-MRI资料 Fig 1 HR-MRI of an MMD patient |
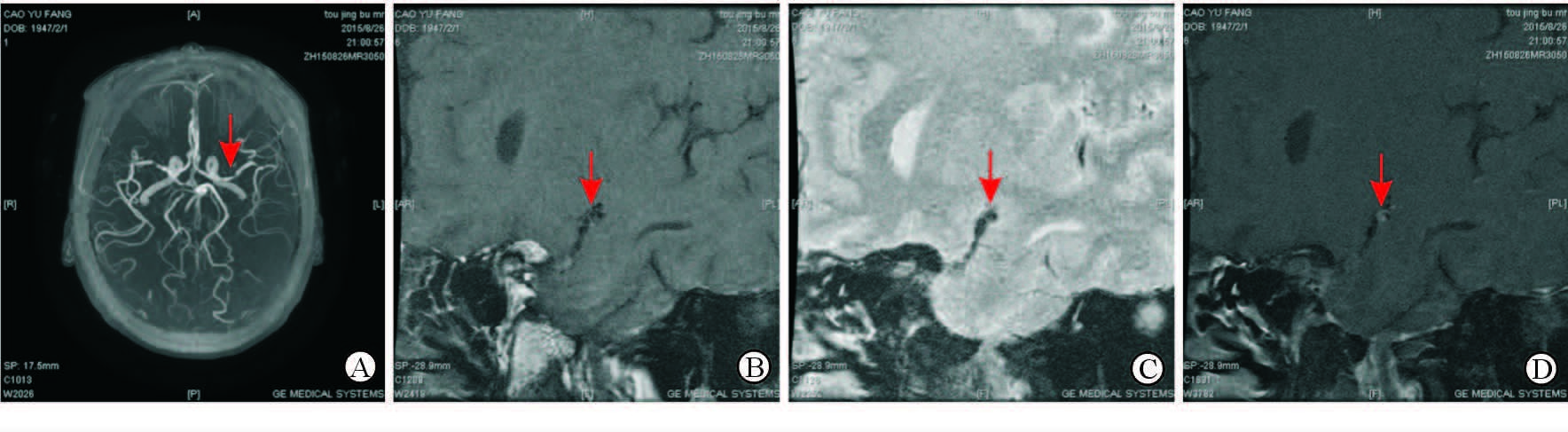
|
图 2 1例AS-MMS患者HR-MRI资料 Fig 2 HR-MRI of an AS-MMS patient |
2.3 MMD组患者的Suzuki分级与RI
根据DSA造影结果对MMD组患者进行Suzuki分级,结果表明3级(11例)最多,再依次为4级(7例)、2级(4例)、5级(2例),无1级和6级患者。2~5级患者RI分别为0.91±0.15、0.85±0.12、0.84±0.05、0.87±0.11,差异均无统计学意义。
2.4 MMD组和AS-MMS组患者的MCA外径和RI根据HR-MRI结果可见,MMD组患者MCA外径和RI均较小,两组分布有明显差异(图 3)。对患者MCA外径进行ROC曲线分析,结果(图 4)表明两组患者的MCA外径界限为3.13 mm,即MCA外径≤3.13 mm时为MMD的可能性较大,>3.13 mm 时为AS-MMS的可能性较大(敏感度90.7%,特异度64.0%)。
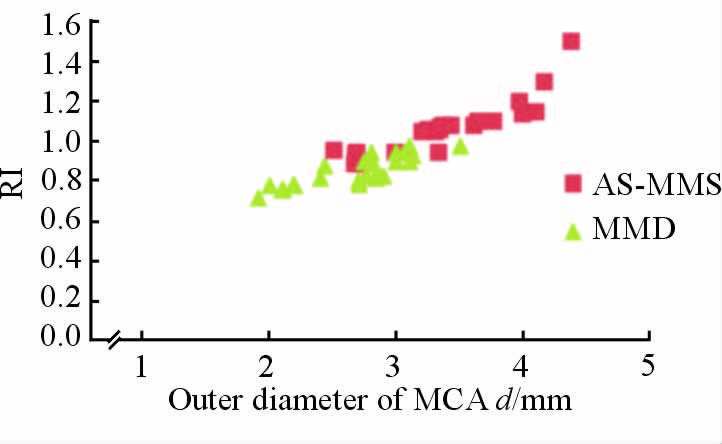
|
图 3 两组患者MCA血管外径与RI散点图 Fig 3 The scatter diagram of MCA outer diameter and RI in two groups |
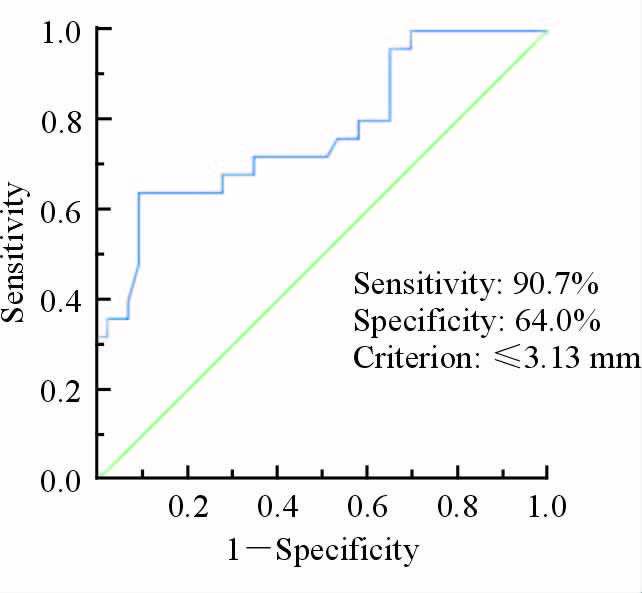
|
图 4 两组患者MCA血管外径ROC曲线 Fig 4 The ROC curve of outer diameter of MCA in two groups |
3 讨论
本研究结果显示两组患者的HR-MRI特征差异较大,HR-MRI常常能提示MMD和AS-MMS的诊断。HR-MRI显示成年MMD患者的MCA外径较小、管壁厚,常呈阴性重构,无增强效应,偶有环形增强,MCA附近多有微小血管结构;而AS-MMS患者的MCA外径常呈阳性重构,多有增强效应,特别是局灶性增强,MCA附近少有微小血管结构。Takagi等[7]对比了MMD和非MMD患者MCA的尸检结果,发现MMD患者的MCA外径较非MMD患者小。Kaku等[8]使用MRI 3D重建技术发现MMD患者的ICA和MCA M1段的外径明显小于动脉粥样硬化患者,且认为这种血管改变反映了MMD的病理变化。MMD和AS-MMS组患者的影像学差异首先基于两类疾病发病机制的不同。AS-MMS是动脉粥样硬化所致,动脉粥样硬化的病理改变主要是纤维帽、脂核、炎性细胞浸润、钙化、坏死和斑块内出血等[9];而MMD患者MCA的主要病理改变是不断增多的平滑肌细胞导致内膜增厚[10]。HR-MRI不同的影像信号的展现出不同的病理改变。其次,在动脉粥样硬化过程中,随着斑块的逐渐增大,AS-MMS患者的血管会通过阳性重构,即管腔向外增粗来保证管腔的直径;而MMD随着内膜不断增厚,血管腔早期则会出现狭窄,血管中膜变薄,从而表现为阴性重构。这与Kim等[11]报道的MMD患者的HR-MRI显示MCA管壁无明显增强及增厚一致。同时,随着动脉的狭窄闭塞,MMD患者颅底会出现异常烟雾样血管网[12],因此通过HR-MRI可以看到狭窄闭塞血管附近有很多微小血管;而动脉粥样硬化血管附近却很少观察到。可见HR-MRI既可以显示颅内血管壁及其附近结构,也能显示血管壁的成分,更为接近病理活检结果,具有直观又准确的特点。
HR-MRI可以体现患者的血管重塑特征,这是其较其他影像学检查的又一优点。血管重塑包括阳性重构和阴性重构,由RI来决定,是鉴别MMD和AS-MMS的重要参数。本研究显示MMD组患者的MCA外径变小,进而血管面积减少,RI≤0.95而呈现阴性重构。这与Ryoo等[13]的研究结果一致。此外,血管的重构方式与斑块稳定性有关。在既往动脉粥样硬化的HR-MRI研究中,不论是冠状动脉还是MCA,阳性重构多见于症状性狭窄患者,而阴性重构多见于无症状患者[14]。此现象提示症状性狭窄较无症状性狭窄患者的斑块更不稳定而易破裂。阳性重构较阴性重构有更大的斑块面积和斑块负荷[5]。MMD患者发生卒中多是因为缺血失代偿及烟雾样血管破裂等病理改变,这也与本研究中AS-MMS组患者局灶性增强发生率高于MMD组这一结果符合,提示症状性动脉粥样硬化更易发生阳性重构且斑块不稳定。
综上所述,HR-MRI可以从颅内血管的结构、成分、附属结构等方面进行评估,用于MCA狭窄不同病因的鉴别。MMD和AS-MMS都是动态变化的疾病,在早期很相似而很难鉴别,通过HR-MRI可以初步判断病因。MCA外径≤3.13 mm、管壁呈同心圆增厚、狭窄附近见多发微血管结构时需要考虑为MMD可能性大。本研究也存在较多局限,如病例数少、没有病理对照等,将来需要更深入的研究来对MCA的狭窄原因进行鉴别以指导临床治疗。
| [1] | POWERS W J, CLARKE W R, GRUBB R L Jr, VIDEEN T O, ADAMS H P Jr, DERDEYN C P; COSS Investigators. Extracranial-intracranial bypass surgery for stroke prevention in hemodynamic cerebral ischemia: the carotid occlusion surgery study: a randomized trial[J]. JAMA , 2011, 306 :1983–1992. DOI:10.1001/jama.2011.1610 |
| [2] | MARSHALL R S, FESTA J R, CHEUNG Y K, PAVOL M A, DERDEYN C P, CLARKE W R, et al. Randomized evaluation of carotid occlusion and neurocognition (RECON) trial: main results[J]. Neurology , 2014, 82 :744–751. DOI:10.1212/WNL.0000000000000167 |
| [3] | FUKUI M. Guidelines for the diagnosis and treatment of spontaneous occlusion of the circle of Willis ('moyamoya'disease). Research Committee on Spontaneous Occlusion of the Circle of Willis (Moyamoya Disease) of the Ministry of Health and Welfare, Japan[J]. Clin Neurol Neurosurg , 1997, 99 (Suppl 2) :S238–S240. |
| [4] | Research Committee on the Pathology and Treatment of Spontaneous Occlusion of the Circle of Willis; Health Labour Sciences Research Grant for Research on Measures for Infractable Diseases. Guidelines for diagnosis and treatment of moyamoya disease (spontaneous occlusion of the circle of Willis)[J]. Neurol Med Chir (Tokyo) , 2012, 52 :245–266. DOI:10.2176/nmc.52.245 |
| [5] | MA N, JIANG W J, LOU X, MA L, DU B, CAI J F, et al. Arterial remodeling of advanced basilar atherosclerosis: a 3-tesla MRI study[J]. Neurology , 2010, 75 :253–258. DOI:10.1212/WNL.0b013e3181e8e714 |
| [6] | SAMUELS O B, JOSEPH G J, LYNN M J, SMITH H A, CHIMOWITZ M I. A standardized method for measuring intracranial arterial stenosis[J]. AJNR Am J Neuroradiol , 2000, 21 :643–646. |
| [7] | TAKAGI Y, KIKUTA K, NOZAKI K, HASHIMOTO N. Histological features of middle cerebral arteries from patients treated for moyamoya disease[J]. Neurol Med Chir (Tokyo) , 2007, 47 :1–4. DOI:10.2176/nmc.47.1 |
| [8] | KAKU Y, MORIOKA M, OHMORI Y, KAWANO T, KAI Y, FUKUOKA H, et al. Outer-diameter narrowing of the internal carotid and middle cerebral arteries in moyamoya disease detected on 3D constructive interference in steady-state MR image: is arterial constrictive remodeling a major pathogenesis?[J]. Acta Neurochir (Wien) , 2012, 154 :2151–2157. DOI:10.1007/s00701-012-1472-4 |
| [9] | GLAGOV S, WEISENBERG E, ZARINS C K, STANKUNAVICIUS R, KOLETTIS G J. Compensatory enlargement of human atherosclerotic coronary arteries[J]. N Engl J Med , 1987, 316 :1371–1375. DOI:10.1056/NEJM198705283162204 |
| [10] | FUKUI M, KONO S, SUEISHI K, IKEZAKI K. Moyamoya disease[J]. Neuropathology , 2000, 20 (Suppl) :S61–S64. |
| [11] | KIM J M, JUNG K H, SOHN C H, PARK J, MOON J, HAN M H, et al. High resolution MR technique can distinguish moyamoya disease from atherosclerotic occlusion[J]. Neurology , 2013, 80 :775–776. DOI:10.1212/WNL.0b013e3182825162 |
| [12] | XU W H, LI M L, NIU J W, FENG F, JIN Z Y, GAO S. Deep tiny flow voids along middle cerebral artery atherosclerotic occlusions: a high-resolution MR imaging study[J]. J Neurol Sci , 2014, 339 :130–133. DOI:10.1016/j.jns.2014.01.042 |
| [13] | RYOO S, CHA J, KIM S J, CHOI J W, KI C S, KIM K H, et al. High-resolution magnetic resonance wall imaging findings of moyamoya disease[J]. Stroke , 2014, 8 :2457–2460. |
| [14] | KIM Y J, LEE D H, KWON J Y, KANG D W, SUH D C, KIM J S, et al. High resolution MRI difference between moyamoya disease and intracranial atherosclerosis[J]. Eur J Neurol , 2013, 20 :1311–1318. DOI:10.1111/ene.12202 |
 2016, Vol. 37
2016, Vol. 37


