吴茱萸碱(evodiamine,EVO)是从芸香科植物吴茱萸成熟果实中提取的一种色胺吲哚类生物碱[1]。研究表明EVO具有抗肿瘤、降血压、抗炎镇痛、减肥、调节内分泌等多种药理活性[2-4],其中抗肿瘤作用是近年来的研究热点。EVO抗肿瘤机制有多种,如阻滞肿瘤细胞周期,改变周期相关蛋白的表达[5];阻断肿瘤细胞信号通路,抑制肿瘤细胞的侵袭和转移等[6]。然而,游离EVO具有水溶性差、半衰期短、口服生物利用度低等不足[7],限制了其在临床上的应用。
研究者们试图通过各种制剂技术改善EVO的缺点。柳珊等[8]采用单一的磷脂复合物技术将EVO制备成EVO磷脂复合物,改善了其口服生物利用度;严春临等[9]将吴茱萸次碱制备成环糊精包合物,增加了吴茱萸次碱的溶解度和生物利用度。但这些单一的制剂技术并未很好解决EVO的不足。研究表明,将多个药物载体组合形成的新载体可能兼具单个载体的优点,联合应用多种制剂技术使得药物具有协同作用[10]。本实验同时采用羟丙基-β-环糊精与磷脂2个药物载体,联合应用包合物技术、磷脂复合物技术及纳米乳技术,将EVO与羟丙基-β-环糊精、磷脂在一定条件下形成EVO-羟丙基-β-环糊精磷脂复合物,然后制备成新型纳米乳(evodiamine novel nano emulsion,ENNE),希望能同时解决EVO水中溶解度低、生物半衰期短、口服生物利用度低等问题。
1 材料和方法 1.1 药品、试剂、设备和动物EVO(纯度>99%,武汉远城科技发展有限公司),羟丙基-β-环糊精(江苏泰兴新鑫医药辅料有限公司),卵磷脂(德国Lucas Meyer公司),单辛酸甘油酯(河南正通化工有限公司),聚氧乙烯氢化蓖麻油(南京都莱生物技术有限公司),PEG-400(国药集团化学试剂有限公司),甲醇(色谱纯,美国新天地科技有限公司),其他试剂均为分析纯;LC-20A型高效液相色谱仪(日本岛津公司),AB204S电子分析天平(瑞士Mettler Toledo仪器公司),HWCL-3型集热式恒温磁力搅拌器(郑州长城科工贸有限公司),G-16医用离心机(北京白洋医疗器械有限公司),VOS-30A型真空干燥箱[施都凯设备(上海)有限公司];雄性SD大鼠12只,体质量(250±20) g,由第三军医大学实验动物中心提供[动物生产许可证号:SCXK(渝)2012-0005]。
1.2 ENNE的制备分别称量适量EVO、羟丙基-β-环糊精238 mg、卵磷脂136 mg溶于20 mL无水乙醇中,置于50 ℃水浴中磁力搅拌3 h,40 ℃旋转蒸发除去无水乙醇,真空干燥得固体。分别称取上述固体86 mg、单辛酸甘油酯4.40 g、PEG400 3.75 g、聚氧乙烯氢化蓖麻油1.25 g于烧杯,置于恒温水浴锅中搅拌混匀后,缓慢滴入0.6 g水,继续恒温水浴搅拌,待溶液变澄清后超声除去气泡,即得外观澄明且伴有蓝色乳光的油包水型ENNE。
1.3 EVO混悬液的制备[11]称取适量EVO于25 mL 容量瓶中,加入适量0.5% 羧甲基纤维素钠水溶液,超声混匀,最后加入0.5% 羧甲基纤维素钠水溶液稀释至刻度,即得EVO混悬液。
1.4 给药方案及样品采集将12只雄性SD大鼠随机平均分成参比组与受试组,给药前禁食12 h,灌胃给药,参比组给予EVO混悬液(100 mg/kg),受试组给予ENNE(相当于EVO 100 mg/kg)[12],两组分别于给药前取空白血,分别于给药后5 min、10 min、15 min、30 min、45 min、1 h、2 h、5 h、8 h、12 h、24 h、48 h、72 h从大鼠眼底取血0.3 mL,收集的血液样品置于含少许肝素的离心管,3 187×g离心10 min,收集上层血浆备用。
1.5 血浆样品的处理精密量取血浆样品200 μL,加入甲醇800 μL,涡旋3 min后,4 250×g离心10 min,吸取上清液,真空干燥挥去甲醇,用150 μL 甲醇复溶,9 562×g离心5 min,取上清液。
1.6 色谱条件色谱柱:Hypersil ODS2 C18柱(4.6 mm×250 mm,5 μm;大连依利特分析仪器有限公司);柱温:25 ℃;流动相:甲醇-0.1%甲酸水溶液(66∶34,体积比);流速:1.0 mL/min;进样体积:100 μL;检测波长:225 nm。
1.7 溶液的制备精密称取EVO 10 mg,置于100 mL容量瓶中,用甲醇溶解稀释至刻度,作为贮备液;精密量取EVO贮备液1 mL,置10 mL容量瓶中,用甲醇稀释至刻度,即得EVO对照品溶液。精密量取适量EVO对照品溶液,用甲醇稀释成8、16、30、60、120、240、480、1 000、2 400 ng/mL系列对照溶液,室温放置备用。
1.8 方法学考察 1.8.1 方法的专属性取EVO对照品溶液、空白血浆、血浆样品、EVO对照品+空白血浆各200 μL,按1.5项下方法操作,按1.6项下色谱条件进行分析,记录色谱图。
1.8.2 线性关系考察精密吸取空白血浆样品100 μL,分别加入不同浓度的EVO系列对照溶液100 μL,即得4、8、15、30、60、120、240、500、1 200 ng/mL系列模拟血浆样品溶液,按1.5项下方法操作,按1.6项下条件进行分析,记录色谱图。以EVO浓度(X)对峰面积(Y)进行线性回归,得回归方程。
1.8.3 回收率考察取空白血浆100 μL,加入EVO对照品溶液,分别配制成低、中、高3个质量浓度(8、60、500 ng/mL)的血浆样品各5份,按1.5项下方法操作,按1.6项下条件进行分析,记录峰面积,通过标准曲线计算实测浓度(Cr),以实测浓度与理论浓度之比(Cr/Cs)考察方法回收率。
1.8.4 精密度考察取空白血浆100 μL,加入EVO对照品溶液,配制成低、中、高3个质量浓度(8、60、500 ng/mL)的EVO血浆样品各5份,按1.5项下方法操作,按1.6项下条件进行分析,记录峰面积,分别在同一天内连续测定考察日内精密度,连续测定3 d考察日间精密度。
1.8.5 稳定性考察精密量取空白血浆100 μL,加入EVO对照品溶液配成低、中、高3个质量浓度(8、60、500 ng/mL)的血浆样品各5份,室温放置8 h、1 d、3 d后,按1.5项下方法操作,按1.6项下条件进行分析,计算RSD,考察血浆样品室温稳定性。精密量取空白血浆样品100 μL,加入EVO对照品溶液配成低、中、高3个质量浓度(8、60、500 ng/mL)的血浆样品各5份,-20 ℃冷冻保存7、14、30 d后,按1.5项下方法操作,按1.6项下条件进行分析,计算RSD,考察生物样品-20 ℃冻存的稳定性。
1.9 ENNE的药代动力学与生物等效性以血药浓度对时间绘制血药浓度-时间曲线,实验数据分别采用DAS 2.1.1 软件与统计矩法处理,计算非房室模型与房室模型时ENNE与EVO的主要药动学参数,根据公式F(相对生物利用度)=AUCENNE/AUCEVO×100%计算ENNE的相对生物利用度。达峰时间(peak time,Tmax)、峰浓度(peak concentration,Cmax)采用实测值。采用DAS 2.1.1软件将AUC0-t、AUC0-∞ 及Cmax经对数转换后进行双单侧t检验和[1-2α] 90%置信区间考察,比较ENNE与EVO的生物等效性。
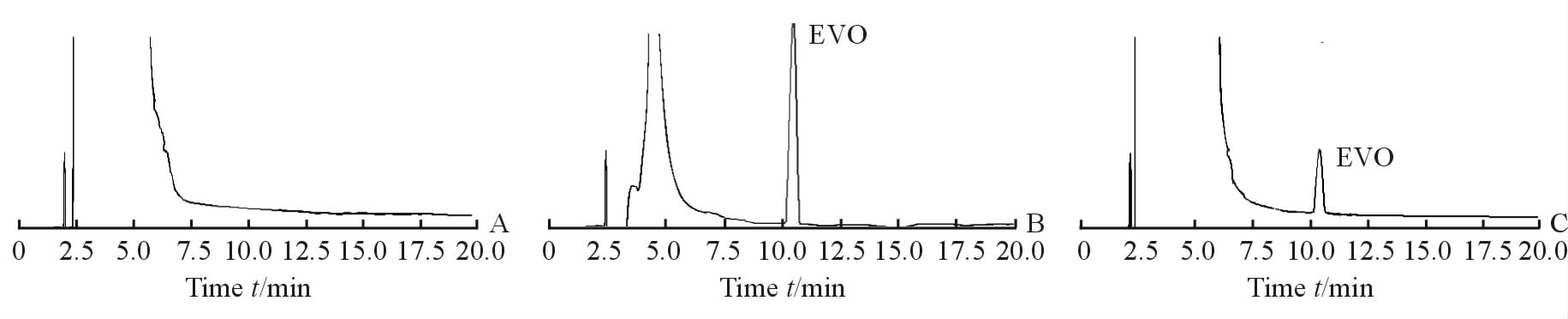
2 结 果 2.1 方法学考察 2.1.1 专属性EVO对照品、空白血浆、血浆样品色谱图结果见图 1。结果表明,血浆中的内源性物质及其他杂质对EVO色谱峰无干扰,EVO的峰形良好,对称因子为0.98,EVO的保留时间为10.45 min。
|
图 1 专属性色谱图 Fig 1 Chromatogram of specificity |
2.1.2 线性关系考察
所得回归方程为Y=185.09X+247.67,r=0.999 9。结果表明,血浆中EVO的质量浓度在4~1 200 ng/mL范围内浓度与峰面积呈良好的线性关系,符合体内分析方法学要求。当信噪比为3时血浆中EVO的检测限为1 ng/mL,当信噪比为10时定量限为4 ng/mL。
2.1.3 回收率血浆样品中EVO浓度为8、60、500 ng/mL时测得的方法回收率分别为(99.95±1.49)%、(101.61±1.05)%、(101.54±1.19)%,结果表明该方法回收率良好。
2.1.4 精密度血浆样品中低、中、高3个质量浓度(8、60、500 ng/mL) EVO的日内精密度分别为7.62%、5.51%、2.28%,日间精密度分别为8.77%、6.92%、3.49%,结果表明该分析方法的精密度良好。
2.1.5 稳定性低(8 ng/mL)、中(60 ng/mL)、高(500 ng/mL)质量浓度的EVO血浆样品室温放置8 h、1 d、3 d后计算得到RSD分别为10.42%、9.68%、5.73%;低(8 ng/mL)、中(60 ng/mL)、高(500 ng/mL)质量浓度EVO血浆样品-20 ℃放置7、14、30 d后计算得到RSD分别为10.84%、8.73%、5.75%。结果表明,计算所得的RSD均<15%,血浆样品在室温下放置3 d内和-20 ℃冻存30 d内稳定性好,能够保证血浆样品完成测定。
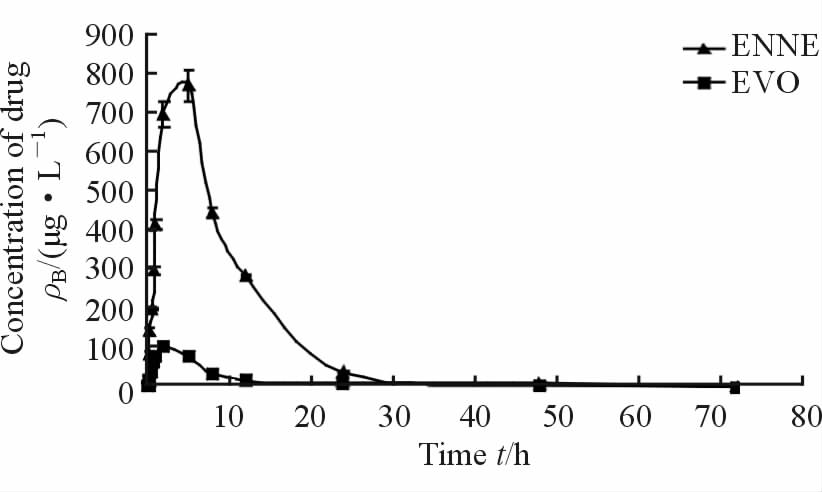
2.2 ENNE的药代动力学研究 2.2.1 平均血药浓度-时间曲线的绘制结果见图 2。ENNE与EVO灌胃给药后在大鼠体内均有吸收、分布和消除过程,ENNE在约3 h内完成吸收分布,Cmax约为773 μg/L,EVO在约2 h内完成吸收分布,Cmax约为107 μg/L;随后EVO进入消除相,在约24 h时血药浓度几乎为0,但此时ENNE的血药浓度约为39 μg/L,约在30 h时ENNE血药浓度几乎为0。结果表明,ENNE比EVO吸收好,能够在大鼠体内缓慢地释放药物,并能在较长时间内维持较高的血药浓度。
|
图 2 灌胃后ENNE与EVO的血药浓度-时间曲线图 Fig 2 The concentration-time curves of ENNE and EVO after intragastric administration |
2.2.2 ENNE主要药动学参数
由表 1中非房室模型参数可见,ENNE的Cmax约是EVO的7倍,Tmax约是EVO的2倍,MRT0-∞约是EVO的1.1倍,计算得到ENNE的相对生物利用度是EVO的934.71%。
|
|
表 1 ENNE与EVO的主要药动学参数 Tab 1 The main pharmacokinetic parameters of ENNE and EVO |
根据偏差分析最小原则和权重残差平方和(R2)拟合度越接近1的拟合模型判断最优房室模型,结果判断ENNE与EVO均符合二室模型。由表 1可见,房室模型与非房室模型的Tmax与Cmax一致。由房室模型主要参数计算得到ENNE的相对生物利用度是EVO的932.27%。结果表明,采用房室模型与非房室模型分析所得药动学参数基本一致。
2.2.3 生物等效性分析结果显示,ENNE的AUC0-t和AUC0-∞经对数转换后[1-2α] 90%置信区间分别为132.9%~134.4%、132.7%~133.8%,不在等效标准80%~125%范围内;ENNE的Cmax对数转换后[1-2α] 90%置信区间为140.9%~143.4%,不在等效标准70%~143%范围内;Tmax采用实测值,对Tmax进行Wilcoxon非参数检验,结果表明ENNE和EVO差异有统计学意义(P=0.001)。ENNE与EVO的主要药代参数之间的差异有统计学意义,但受试周期和受试个体之间的差异没有统计学意义。按照生物等效性标准判定,ENNE与EVO不具有生物等效性。
3 讨 论本研究成功建立了HPLC法测定大鼠血浆中EVO的含量,血浆中基质与溶剂均对EVO血浆样品的测定无干扰,该方法专属性强、准确度高,能够满足体内样品分析的要求。
羟丙基-β-环糊精是一种低毒、安全、有效的药用辅料,将EVO与羟丙基-β-环糊精制成包合物能改善药物水溶性差等问题[13]。磷脂是生物膜的主要成分,广泛用作药物载体,能使药物顺利通过细胞膜,促进药物吸收[14]。纳米乳能增加难溶性药物的溶解度,使药物在体内有一定的缓释作用[15]。本研究采用羟丙基-β-环糊精与磷脂2个药物载体,联合应用包合物技术、磷脂复合物技术及纳米乳技术,将EVO制备成新型纳米乳ENNE,并通过计算房室模型与非房室模型主要药代动力学参数研究了ENNE与EVO的药代动力学行为。结果表明,采用房室模型与非房室模型分析药代动力学参数所得结果基本一致。ENNE的Cmax为(773.07±38.24) μg/L,约是EVO的7倍,Tmax为(5±0) h,约是EVO的2倍,将EVO制成ENNE促进了EVO的吸收,延长了Tmax。EVO口服吸收差,Cmax较ENNE低,使得EVO在大鼠体内维持时间短,而ENNE的包封率高,在大鼠体内消除慢,清除率低,半衰期长,达到Cmax后能够长时间维持较高浓度,从而减少给药次数,提高患者顺应性。
本研究由房室模型和非房室模型的药动学参数计算的ENNE相对生物利用度分别为932.27%与934.71%,Hu等[16]发现EVO超分子纳米乳在大鼠体内的相对生物利用度为630.35%,结果表明ENNE比EVO超分子纳米乳的相对生物利用度提高得更多。经生物等效性分析,ENNE与EVO不具有生物等效性,ENNE的生物利用度高于EVO。本研究首次将EVO制备成ENNE并研究了其体内药代动力学行为,为药物新剂型研究提供一定的参考依据。
| [1] | 杨志欣, 孟永海, 王秋红, 杨炳友, 匡海学. 吴茱萸药理作用及其物质基础研究概况[J]. 中华中医药学刊 , 2011, 29 :2415–2417. |
| [2] | 张秋方, 杨奕樱. 吴茱萸碱药理作用的研究近况[J]. 贵阳中医学院学报 , 2013, 35 :36–38. |
| [3] | 张醇, 梁华平. 吴茱萸碱抗肿瘤活性研究进展[J]. 中国新药杂志 , 2010, 19 :1558–1562. |
| [4] | YU H, JIN H, GONG W, WANG Z, LIANG H. Pharmacological actions of multi-target-directed evodiamine[J]. Molecules , 2013, 18 :1826–1843. DOI:10.3390/molecules18021826 |
| [5] | FANG C, ZHANG J, QI D, FAN X, LUO J, LIU L, et al. Evodiamine induces G2/M arrest and apoptosis via mitochondrial and endoplasmic reticulum pathways in H446 and H1688 human small-cell lung cancer cells[J/OL]. PLoS One, 2014, 9: e115204. doi: 10.1371/journal.pone.0115204 |
| [6] | SHEN H, ZHAO S, XU Z, ZHU L, HAN Y, YE J. Evodiamine inhibits proliferation and induces apoptosis in gastric cancer cells[J]. Oncol Lett , 2015, 10 :367–371. |
| [7] | 张志仙, 蒋美玲, 王欣慧, 李云展, 龚国清. 吴茱萸碱的药理学研究进展[J]. 现代生物医学进展 , 2014, 14 :4189–4195. |
| [8] | 柳珊, 杨林, 廖红, 赵德璋, 张景勍. 吴茱萸碱纳米复合物的药代动力学和生物利用度研究[J]. 第三军医大学学报 , 2013, 35 :325–327. |
| [9] | 严春临, 张季, 侯勇, 薛贵平, 王树, 赵青亚. 吴茱萸次碱羟丙基-β-环糊精包合物的制备工艺研究[J]. 中国中药杂志 , 2014, 39 :828–832. |
| [10] | 唐勤, 顾勇, 李纳, 郭倩, 徐晓玉, 张继芬. 姜黄素磷脂复合物壳聚糖微球在大鼠体内药动学研究[J]. 中草药 , 2013, 44 :1939–1943. |
| [11] | 杨梅, 张景勍, 李娜, 罗见春, 胡雪原. 去甲氧基姜黄素纳米乳在大鼠体内的药代动力学研究[J]. 第三军医大学学报 , 2015, 37 :346–350. |
| [12] | HU J, SUN L, ZHAO D, ZHANG L, YE M, TAN Q, et al. Supermolecular evodiamine loaded water-in-oil nanoemulsions: enhanced physicochemical and biological characteristics[J]. Eur J Pharm Biopharm , 2014, 88 :556–564. DOI:10.1016/j.ejpb.2014.06.007 |
| [13] | 高振珅, 王兰. 姜黄素羟丙基-β-环糊精包合物的制备及其性质研究[J]. 中草药 , 2012, 43 :1951–1956. |
| [14] | 丁冬梅, 张振海, 蒋艳荣, 贾晓斌. 中药磷脂复合物的研究进展[J]. 中国中药杂志 , 2013, 38 :2046–2050. |
| [15] | 李艳萍, 张志荣. 纳米乳的研究进展及其应用[J]. 华西药学杂志 , 2010, 25 :485–488. |
| [16] | HU J, CHEN D, JIANG R, TAN Q, ZHU B, ZHANG J. Improved absorption and in vivo kinetic characteristics of nanoemulsions containing evodiamine-phospholipid nanocomplex[J]. Int J Nanomedicine , 2014, 7 :4411–4420. |
 2016, Vol. 37
2016, Vol. 37


