PRKAG2心脏综合征是一种罕见的常染色体显性遗传病,是由于编码单磷酸腺苷(adenosine monophosphate,AMP) 激活蛋白激酶(AMP-activated protein kinase,AMPK) γ2亚基的PRKAG2基因遗传性缺陷,从而导致不同临床表现度的多种心脏表型,典型表现为心室预激、进展性传导系统疾病和心脏肥大[1]。目前研究认为,PRKAG2心脏综合征是一种由于AMPK活性紊乱导致糖原沉积的心脏代谢性疾病[2]。本研究通过包装人PRKAG2(R302Q)突变型的腺病毒并感染乳鼠心肌细胞,为进一步研究基因PRKAG2(R302Q)突变的功能以及PRKAG2心脏综合征的发病机制奠定基础。
1 材料和方法 1.1 主要材料与试剂293细胞由本实验室自行保存,大肠杆菌DH5α感受态细胞由本实验室自行制备,突变型人PRKAG2(R302Q)的真核表达载体pPRKAG2 (R302Q)-IRES2-EGFP由笔者自行构建;腺病毒重组及表达质粒pDNOR221和pAD/CMV/V5-DEST(Invitrogen公司);plentinum pfx 聚合酶、重组酶、脂质体lipo2000(Invitrogen公司);Taq聚合酶[生工生物工程(上海)股份有限公司];限制性内切酶PacⅠ(NEB公司);普通质粒小抽试剂盒、琼脂糖凝胶DNA 回收试剂盒和PCR清洁试剂盒(Axygen公司);TRIzol试剂(Invitrogen公司);反转录酶(Promega公司),DMEM培养基及血清(Gibco公司),链霉素/青霉素(Sigma公司),PRKAG2抗体(Abcam公司)。
1.2 BP重组引物设计与合成设计含重组位点的BP重组引物。上游引物:F1,5′-GGG GAC AAG TTT GTA CAA AAA AGC AGG CTT CGC CAC CAT GGG AAG CGC GGT TAT GG-3′;下游引物:R1,5′-GGG GAC CAC TTT GTA CAA GAA AGC TGG GTC TTA CTT GTA CAG CTC GTC CAT GCC -3′。以上引物由生工生物工程(上海)股份有限公司合成。
1.3 PRKAG2 (R302Q)突变型腺病毒载体的BP重组及鉴定以PRKAG2(R302Q)突变型的真核表达载体pPRKAG2(R302Q)-IRES2-EGFP为模板,采用BP重组引物F1/R1扩增目标序列。PCR 体系如下:模板质粒0.5 μL,10 μmol/L的F1和R1引物各2 μL,plentinum pfx聚合酶0.2 μL,10 mmol/L dNTP 1 μL,50 mmol/L MgSO4 1 μL,10 × Buffer 5 μL,无菌双蒸水加至50 μL。反应体系在冰上配制,混匀,瞬时离心后置PCR 仪,95℃预变性3 min;95℃变性30 s,58℃退火30 s,68℃延伸180 s,进行30个循环;最后68℃延伸10 min。琼脂糖凝胶电泳分离PCR产物,并用Axygen胶回收试剂盒回收目的片段。
使用Invitrogen的BP重组系统将扩增得到的目的片段PRKAG2 (R302Q)-IRES-EGFP重组到中间载体pDONR221上,BP重组反应体系:BP重组PCR产物2 μL,pDONR221 vector 1 μL,BP clonase Ⅱ enzyme mix 2 μL,无菌双蒸水加至10 μL,25℃反应过夜后加入1 μL蛋白酶K,37℃反应10 min。
取5.0 μL重组反应液转化大肠杆菌DH5α感受态细胞。次日挑取单菌落,置于20 μL 无菌水中溶解,取1 μL 菌液作为模板,F1/R1为引物进行菌落PCR,PCR 体系如下:模板1 μL,10 μmol/L的F1和R1引物各2 μL,Taq酶0.5 μL,10 mmol/L dNTP 1 μL,25 mmol/L MgCl2 1.5 μL,10×Buffer 1.5 μL,无菌双蒸水加至15 μL。反应体系在冰上配制,混匀,瞬时离心后置PCR仪,95℃预变性3 min;95℃变性30 s,58℃退火30 s,72℃延伸180 s,进行30个循环;最后72 ℃延伸10 min。将PCR鉴定呈阳性的克隆接到LB培养液中,摇菌过夜,次日抽提质粒送测。
1.4 突变型PRKAG2(R302Q)腺病毒载体的LR重组及鉴定使用Invitrogen的LR重组系统将pDONR221-R302Q-IRES-EGFP中间载体上携带的目的片段重组到腺病毒载体pAd/CMV/V5-DEST,LR重组反应体系:pDONR221-R302Q-IRES-EGFP质粒1 μL,pAd/CMV/V5-DEST质粒1 μL,LR clonase Ⅱ enzyme mix 2 μL,无菌双蒸水加至10 μL。25℃反应过夜后加入1 μL蛋白酶K,37℃反应10 min。
取5.0 μL重组反应液转化大肠杆菌DH5α感受态细胞。次日,挑取单菌落,置于20 μL 无菌水中溶解,取1 μL 菌液作为模板,F1/R1为引物进行菌落PCR,PCR 体系如下:模板1 μL,10 μmol/L的F1和R1引物各2 μL,Taq酶0.5 μL,10 mmol/L dNTP 1 μL,25 mmol/L MgCl2 1.5 μL,10 ×Buffer 1.5 μL,无菌双蒸水加至15 μL。反应体系在冰上配制,混匀,瞬时离心后置PCR仪,95℃预变性3 min;95℃变性30 s,58℃退火30 s,72℃延伸180 s,进行30个循环;最后72℃延伸10 min。将PCR鉴定呈阳性的克隆接到LB培养液中,摇菌过夜,次日抽提质粒送测。
1.5 突变型PRKAG2 (R302Q)腺病毒包装、扩增及检测将5 ×105的293细胞接种至6孔板,培养条件为 DMEM+10%胎牛血清(FBS)+1%链霉素/青霉素,5% CO2、95%湿润空气、37℃培养。第2天细胞融合度约50%。PacⅠ酶将pAD-PRKAG2 (R302Q)-IRES2-EGFP质粒线性化后,采用脂质体lipo2000转染293细胞。转染8 h后,换新鲜完全培养液继续培养,48 h后观察细胞状态,用胰酶消化细胞传至10 cm细胞培养板,每2 d换新鲜培养液,7 d可看到明显的病毒斑出现。
至大量细胞崩解脱落,将细胞培养上清及细胞碎片收集于离心管中放于超低温冰箱冷冻,2 h后取出至37℃融解,如此反复冻融两次裂解细胞。将反复冻融的病毒液1 500×g离心15 min后,每100 μL感染10 cm皿293细胞1皿,共计感染25皿,将初始得到的腺病毒继续扩增,至细胞崩解后收集病毒液过滤,于4℃ 50 000×g离心2 h,浓缩液按照50 μL小量分装保存于超低温冰箱。
采用TCID50法检测病毒滴度,将浓缩获得的病毒液梯度稀释至10-6~10-13 共8个梯度,准备96孔板293细胞一板,每个梯度稀释10孔细胞,培养8 d后观察细胞病变率,计算病毒滴度。
1.6 原代SD乳鼠心肌细胞的分离和培养用75%乙醇对乳鼠[SCXK(沪) 2007-0003]胸部消毒2次,用1把无菌剪刀剪开左侧胸部皮肤,用第2把无菌剪刀剪开胸腔并剪断动脉等,取出心脏并去除心室以外的心脏组织,低温条件下用D-Hank’s液清洗3遍,以去除血凝块等杂质。将心肌剪碎为约1 mm×1 mm×1 mm大小的组织块,加入预先配好的6 mL消化液,混匀,将液体及组织块转入锥形瓶,置入37℃水浴摇床中消化4 min,用无菌塑料吸管轻轻吹打1 min,转入离心管,离心1 min(70×g);弃上清液,沉淀的组织中加入6 mL消化液再次37℃水浴消化6 min,轻轻吹打,离心1 min(70×g);收集上清液(含心肌细胞),沉淀的心肌组织继续进行消化。如此反复5次,分别收集含有心肌细胞的上清液,每次收集的上清液中加入1 mL FBS终止消化,离心6 min(300×g),弃上清,试管底部沉淀即为实验所需的SD乳鼠心肌细胞。
用DMEM/F12+10%FBS+双抗配制的培养液将非心肌细胞的杂物用重悬的方法沉淀,吸取上层细胞悬液(为心肌细胞),将其转入细胞培养皿,置入细胞培养箱(5% CO2、37℃)进行培养。收集5次消化后的重悬液体,用200目筛网过滤,除去未消化完的组织块,将过滤的液体移入培养瓶,培养1.5 h,利用差速贴壁的方法将心肌细胞和成纤维细胞分离。将上层的液体(含心肌细胞)吸出,放于试管中(等待种植),用细胞计数板计算细胞数量,调整心肌细胞的密度为5×105/mL,将其种植于6孔板中,48 h后更换培养液,其后每24小时更换培养液1次,至第72小时,心肌细胞连接成片、同步化有序波动后,可进行腺病毒感染。
1.7 PRKAG2 (R302Q)突变型腺病毒感染SD乳鼠心肌细胞后的蛋白质印迹法检测将PRKAG2(R302Q)突变型及阴性对照腺病毒按照感染复数(MOI)为20感染6孔板5.0×105/mL密度乳鼠心肌细胞,培养条件为DMEM/F12+10%FBS+1%链霉素/青霉素、5% CO2、95%湿润空气、37℃。并于72 h收样,经蛋白裂解及定量,取20 μg上样电泳,电转PVDF膜后进行蛋白质印迹法检测。5%脱脂奶粉室温封闭1.5 h,PRKAG2 兔多抗按稀释比1∶250于4℃孵育过夜;PBST 洗膜5 min;羊抗兔二抗稀释比1∶5 000室温孵育1 h,PBST 洗膜5 min×4 次,与增强化学发光试剂(ECL)反应2 min,X线胶片压片曝光1 min。
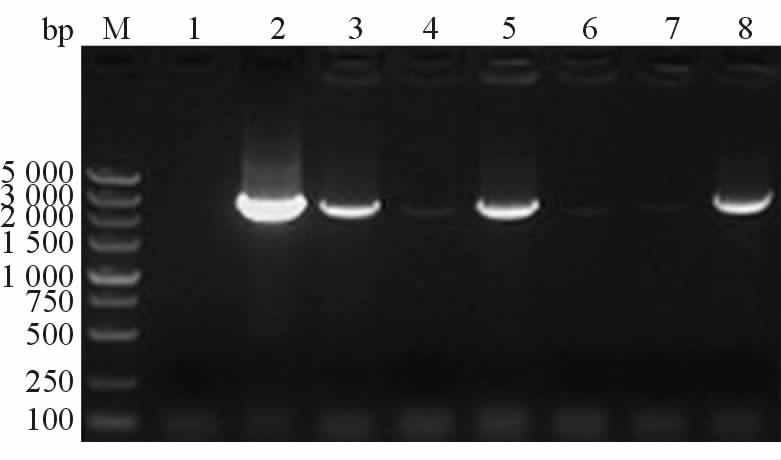
1.8 统计学处理 采用SPSS 14.0统计软件对实验数据进行分析,所有数据均以 x±s 表示,采用t检验,检验水准(α)为0.05。 2 结 果 2.1 人突变型基因PRKAG2(R302Q)的BP重组鉴定经BP重组扩增得到的阳性片段PRKAG2 (R302Q)-IRES2-EGFP与中间载体pDONR221进行BP重组,将重组反应液转化大肠杆菌DH5α感受态细胞,进行菌落PCR鉴定,结果如图 1,阳性克隆送测结果经比对与原序列完全一致。
|
图 1 中间载体pDONR221-PRKAG2 (R302Q)- IRES-EGFP的PCR鉴定 Fig 1 Colony PCR verification of pDONR221- PRKAG2[R302Q]-IRES-EGFP M:DNA marker;1:Negative control (ddH2O as template); 2: Positive control, pPRKAG2(R302Q)-IRES2-EGFP as template;3-8: Six clones, lane 3, 5, and 8 are positive clones |
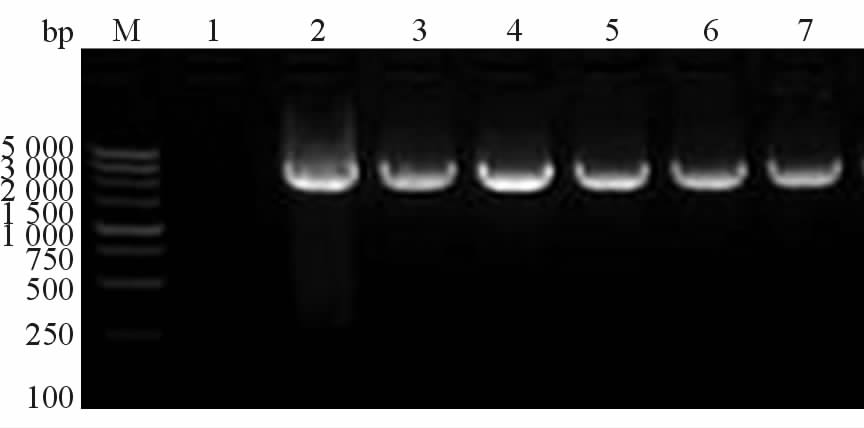
LR重组系统将pDONR221-PRKAG2 (R302Q)-IRES2-EGFP中间载体上携带的目的片段重组到腺病毒载体pAd/CMV/V5-DEST,将重组反应液转化大肠杆菌DH5α感受态细胞,进行菌落PCR鉴定,结果如图 2,阳性克隆送测结果经比对与原序列完全一致。
|
图 2 腺病毒载体pAD-PRKAG2(R302Q)- IRES2-EGFP的菌落PCR鉴定 Fig 2 Colony PCR verification of pAD-PRKAG2 (R302Q) -IRES2-EGFP M:DNA marker;1:Negative control (ddH2O as template); 2: Positive control , pPRKAG2(R302Q)-IRES2-EGFP as template;3-7: All of five clones are positive clones |
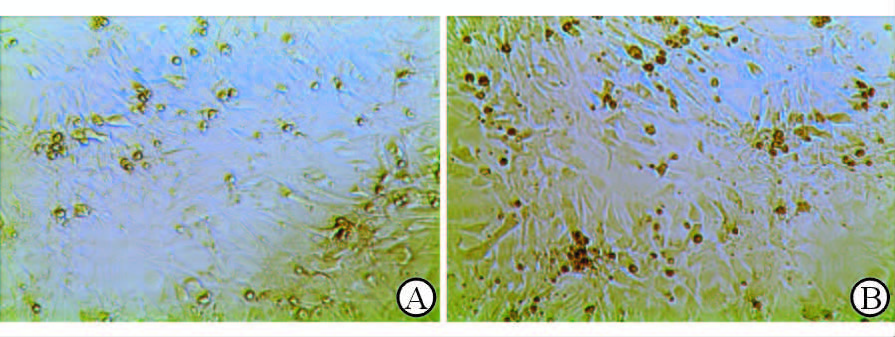
12 h时细胞多数贴于培养皿上,仅仅少数心肌细胞有偶尔跳动。48 h后观察细胞,其互相融合接触形成网格形状(图 3A),跳动增强,搏动有力。96 h后观察,整片培养皿的细胞融成一片(图 3B),跳动速率80~100次/min。
|
图 3 乳鼠心肌细胞的原代分离培养 Fig 3 Culture of the neonatal rat cardiomyocytes A: 48 h; B: 96 h. Original magnification: ×100 |
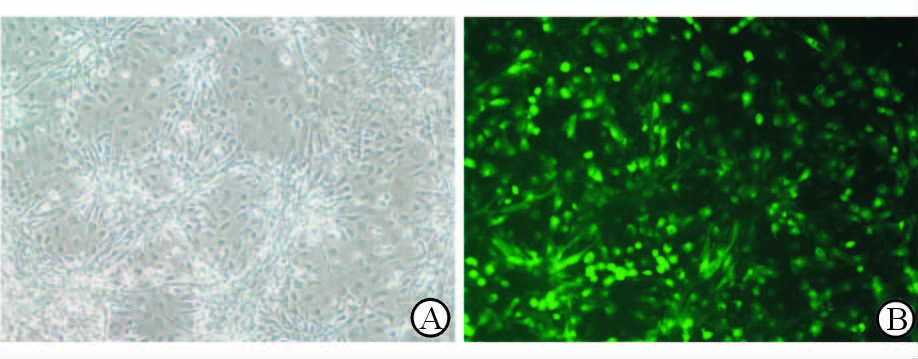
经检测AD-PRKAG2(R302Q)-IRES2-EGFP腺病毒的滴度为6.5×1011 IU/mL。 按照MOI=30感染SD乳鼠心肌细胞感染率可达到80%以上,白光及荧光照片见图 4。
|
图 4 腺病毒AD-PRKAG2 (R302Q)-IRES2- EGFP感染乳鼠心肌细胞 Fig 4 Neonatal rat cardiomyocytes infection with AD-PRKAG2(R302Q)-IRES2-EGFP A: White light;B: Flourescence. Original magnification: ×100 |
检测发现,AD-PRKAG2 (R302Q)-IRES2-EGFP腺病毒感染组相对乳鼠心肌细胞和阴性对照病毒感染组,PRKAG2表达量增高(腺病毒感染组:1.52±0.04,乳鼠心肌细胞:1.08±0.08,阴性对照组:1.13±0.02),差异有统计学意义(P < 0.05),见图 5。
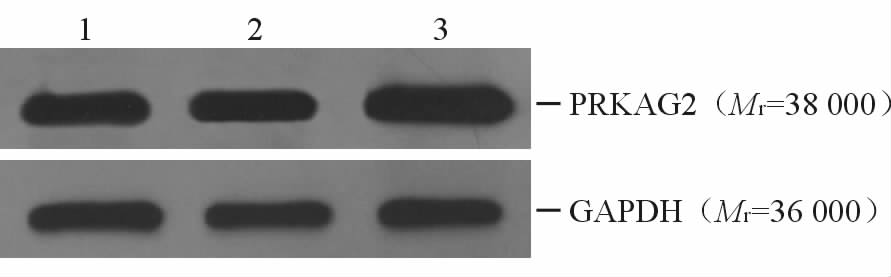
|
图 5 腺病毒AD-PRKAG2(R302Q)-IRES2-EGFP感染乳鼠心肌细胞的蛋白质印迹法检测 Fig 5 Western blotting analysis verifying AD-PRKAG2(R302Q)-IRES2-EGFP infection of neonatal rat cardiomyocytes 1: Neonatal rat cardiomyocytes as blank control;2:Neonatal rat cardiomyocytes infected with AD-EGFP as negative control;3:Neonatal rat cardiomyocytes infected with AD-PRKAG2 (R302Q)-IRES2-EGFP |
PRKAG2基因是AMPK γ2亚基的编码基因,其突变可使AMPK活性紊乱,导致糖原沉积的心脏代谢性疾病,调节AMPK活性可使心脏获益[3]。Cheung等[4]首先确定并克隆了PRKAG2的cDNA,该基因包括16个外显子并且至少包含30万个碱基。另一种不同转录起始于第4个内含子,其转录产物与外显子5~16相对应,转录产物的全长及截短部分则分别代表了PRKAG2a及PRKAG2b,它们均在心脏组织高度表达[5, 6]。5个错义突变及1个移码突变已经在PRKAG2的密码序列中被发现,在7个家系的研究中发现最常见的突变是302位的精氨酸被谷胺酰胺所代替(R302Q),不同的临床表现可能与特异性的突变相对应[7]。另外Mohun等[8]研究发现,钠/葡萄糖协同转运蛋白1 (SGLT1)在糖原累积过程中也会升高,将其敲低可减弱PRKAG2心脏综合征症状,其作用仅次于PRKAG2突变。
PRKAG2心脏综合征的患者均被证实有PRKAG2基因突变。迄今为止,已发现的突变已有数十种之多,不排除在后续的研究中发现新的突变。所有这些突变都是形成PRKAG2心脏综合征的重要因素,所以对于这些基因突变进行研究,进而阐述其发病机制及药物靶点显得尤为重要。
本实验室前期研究发现,突变位点G100S区别于之前发现的所有突变位点,位于非CBS区域,对G100S突变进行体外细胞功能研究,明确了这一突变位点在汉族人PRKAG2心脏综合征家系心律失常发病中的作用通路[9]。Michael等[10]在过表达PRKAG2(N488I) 突变的转基因鼠上发现了与具有该突变的人相似的心肌病和电生理表型。Kim等[11]则在PRKAG2(N488I)突变的转基因鼠上发现不依赖于糖原累积的心肌疾病,即PRKAG2基因突变的疾病新机制。Banerjee等[12]构建了PRKAG2 (T400N)突变的转基因鼠模型,观察到过度的糖原沉积、心脏肥大、预激等表型,同时他们发现PRKAG2(T400N)转基因鼠的心脏AMPK活性存在双相变化,早期激活,随后受到抑制,最后又恢复到野生型水平。
针对PRKAG2(R302Q)突变位点,Sidhu等[13]成功构建了PRKAG2(R302Q)突变型小鼠,该转基因小鼠表现出与人类相似的家系型WPW预激综合征,为心脏传导系统和通路的研究提供了基础。Tan等[14]研究发现了PRKAG2(R302Q)预激综合征与马海姆纤维之间的联系,这些发现支持了PRKAG2可能参与心脏传导系统的新观点。刘湘玮等[15]发现,PRKAG2基因R302Q突变导致同胞兄弟出现不同的临床表现,即使在同一家系中R302Q突变也会引起PRKAG2心脏综合征,显示其具有显著的异质性。最新研究中,张亚平等[16]利用PRKAG2(R302Q)腺病毒感染H9C2大鼠心肌细胞,发现R302Q 突变导致心肌细胞内糖原贮积,而钙离子稳态并未受到影响,无钙超载现象发生。Pu等[17]通过全外显子测序和PCR测序确认,一个中国疾病家系的突变位点为PRKAG2(R302Q),此突变位点与心肌肥大和WPW预激综合征有关,该项工作为探索心肌肥大的原因以及临床诊断和预后评估提供了理论基础。
本研究选取突变型PRKAG2(R302Q)作为研究对象,包装可表达突变型PRKAG2(R302Q)的腺病毒,将其感染乳鼠心肌细胞后,经蛋白质印迹法检测,发现突变型PRKAG2(R302Q)过表达明显,从而为进一步的细胞水平研究以及后续的动物水平研究提供了良好的工作基础。
| [1] | Gollob M H, Green M S, Tang A S, Roberts R. PRKAG2 cardiac syndrome: familial ventricular preexcitation,conduction system disease,and cardiac hypertrophy[J].Curr Opin Cardiol, 2002, 17: 229-234. |
| [2] | Gollob M H. Glycogen storage disease as a unifying mechanism of disease in the PRKAG2 cardiac syndrome[J]. Biochem Soc Trans, 2003, 31(Pt 1): 228-231. |
| [3] | Harada M, Nattel S N, Nattel S. AMP-activated protein kinase: potential role in cardiac electrophysiology and arrhythmias[J]. Circ Arrhythm Electrophysiol, 2012, 5: 860-867. |
| [4] | Cheung P C, Salt I P, Davies S P, Hardie D G, Carling D. Characterization of AMP-activated protein kinase gamma-subunit isoforms and their role in AMP binding[J]. Biochem J, 2000, 346(Pt 3): 659-669. |
| [5] | Gollob M H, Seger J J, Gollob T N, Tapscott T, Gonzales O, Bachinski L, et al. Novel PRKAG2 mutation in the genetic syndrome of ventricular preexcitation and conduction defects with childhood onset and absence of cardiac hypertrophy[J]. Circulation, 2001, 104: 3030-3033. |
| [6] | Lang T, Yh L, Tu Q, Jiang J, Chen Z, Xin Y, et al. Molecular cloning,genomic organization,and mapping of PRKAG2, a heart abundant gamma2 subunit of 5'-AMP-activated prorein kinase, to human chromosome 7q36[J]. Genomics, 2000, 70: 258-263. |
| [7] | Arad M, Benson D W, Perez-Atayde A R, McKenna W J, Sparks E A, Kanter R J, et al. Constitutively active AMP kinase mutations cause glycogen storage disease mimicking hypertrophic cardiomyopathy [J]. J Clin Invest, 2002, 109: 357-362. |
| [8] | Mohun R, Sharma R K, Stephen D, So Jung L, David D, Huang X Y, et al. Transgenic knockdown of cardiac sodium/glucose cotransporter 1 (SGLT1) attenuates PRKAG2 cardiomyopathy, whereas transgenic overexpression of cardiac SGLT1 causes pathologic hypertrophy and dysfunction in mice[J]. J Am Heart Assoc, 2014, 3: 845-847. |
| [9] | Zhang B L, Xu R L, Zhang J, Zhao X X, Wu H, Ma L P, et al. Identification and functional analysis of a novel PRKAG2 mutation responsible for Chinese PRKAG2 cardiac syndrome reveal an important role of non-CBS domains in regulating the AMPK pathway[J]. J Cardiol, 2013, 62: 241-248. |
| [10] | Michael A, Moskowitz I P, Patel V V, Ahmad F, Ferhaan A, Sawyer D B, et al. Transgenic mice overexpressing mutant PRKAG2 define the cause of Wolff-Parkinson-White syndrome in glycogen storage cardiomyopathy[J]. Circulation, 2003, 107: 2850-2856. |
| [11] | Kim M, Hunter R W, Garcia-Menendez L, Gong G, Yang Y Y, Kolwicz S C Jr, et al. Mutation in the γ2-subunit of AMP-activated protein kinase stimulates cardiomyocyte proliferation and hypertrophy independent of glycogen storage[J].Circ Res, 2014, 114: 966-975. |
| [12] | Banerjee S K, Ramani R, Saba S, Rager J, Tian R, Mathier M A, et al. A PRKAG2 mutation causes biphasic changes in myocardial AMPK activity and does not protect against ischemia[J]. Biochem Biophys Res Commun, 2007, 360: 381-387. |
| [13] | Sidhu J S, Rajawat Y S, Rami T G, Gollob M H, Wang Z, Yuan R, et al. Transgenic mouse model of ventricular preexcitation and atrioventricular reentrant tachycardia induced by an AMP-activated protein kinase loss-of-function mutation responsible for Wolff-Parkinson-White syndrome[J]. Circulation, 2005, 111: 21-29. |
| [14] | Tan H L, van der Wal A C, Campian M E, Kruyswijk H H, Bram T H J, van Doorn D J, et al. Nodoventricular accessory pathways in PRKAG2-dependent familial preexcitation syndrome reveal a disorder incardiac development[J]. Circ Arrhythm Electrophysiol, 2008, 1: 276-281. |
| [15] | 刘湘玮, 王 聪, 孙爱军, 王 鹏, 管丽华, 程蕾蕾,等. PRKAG2基因R302Q突变致同胞兄弟不同临床表现的研究[J]. 中国分子心脏病学杂志, 2013, 2: 486-488. |
| [16] | 张亚平, 颜 彦, 宋振举, 童朝阳. PRKAG2心脏综合征中R302Q突变对心肌细胞糖原和钙离子稳态的影响[J]. 中国临床医学, 2015, 4: 479-481. |
| [17] | Pu T, Guo Q, Cao R, Xu R, Sun K, Chen S. Using exome sequencing to identify the cause of myocardial hypertrophy in a Chinese family[J]. Mol Med Rep, 2015, 12: 3662-3666. |
 2016, Vol. 37
2016, Vol. 37


