2. 第二军医大学长海医院妇产科, 上海 200433
2. Department of Obstetrics and Gynecology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
βB2晶体蛋白(βB2 crystallin,CRYBB2)主要在晶状体表达,对维持晶状体的屈光度及透明性起重要作用。有研究发现βB2基因敲除(KO)会引起年龄相关性白内障的发生[1]。除了晶状体外,CRYBB2还能在晶状体外表达并具有重要功能,如可在视网膜、脑和睾丸组织表达[2, 3, 4, 5]。尤其令人惊奇的是,Lampi等[6]研究发现,βB2基因敲除小鼠在睾丸组织中表现出形态和功能的异常,表明βB2基因可以调控小鼠睾丸发育,并对雄性小鼠的生殖产生影响。此外,βB2基因敲除后,睾丸组织精原细胞增殖和凋亡紊乱,小鼠生精功能发生障碍,同时血清睾酮含量下降,小鼠精子生成障碍[7];而Gao等[8]研究发现,与野生型(WT)小鼠相比,βB2基因敲除小鼠中某些与细胞周期和凋亡相关的蛋白质(如Bcl-2、 CDK4和CCND2等)在基因水平表达量下降,提示βB2基因在睾丸的发育过程中可能起重要作用,但是具体的调控机制尚不清楚。
长链非编码RNA(lncRNA)是一类长度大于200 个核苷酸(nt)、由RNA聚合酶Ⅱ转录而来的、不编码蛋白的RNA分子,可以调控基因转录、蛋白质翻译、基因组DNA翻译后修饰[9]。LncRNA表达的变化跟年龄以及人类疾病相关[10, 11, 12, 13]。有研究表明lncRNA HOTAIR的过表达与肝细胞癌的复发、结直肠癌的不良预后以及胃肠道间质瘤的发生有关[14, 15, 16];lncRNA通过定向调控下游靶基因的表达来调节细胞功能[17];此外,lncRNA在调控胚胎发育[18]、X染色体失活和基因组印迹方面[19]也有一定的作用。
本研究对βB2基因敲除和WT小鼠的睾丸组织实施基因芯片分析,采用生物信息学方法分析其lncRNA及mRNA表达的差异;并通过实时荧光定量PCR(qRT-PCR)技术确认差异表达的lncRNA和mRNA,探讨在小鼠睾丸的发育过程中lncRNA是否调控βB2的功能,进而影响小鼠睾丸的发育。
1 材料和方法 1.1 小鼠模型的建立第二军医大学长海医院中心实验室和美国iGTL ( in Genious Targeting Laboratory) 实验室的Wei Weng博士合作,利用基因同源重组技术,建立了βB2晶体蛋白KO的小鼠模型,并成功在国内进行繁殖[20]。WT小鼠为C57BL/C小鼠,由第二军医大学实验动物中心[SCXK(军)2002-011]提供。
1.2 样本准备分别取3只8~9周大的雄性βB2 晶体蛋白KO小鼠(KO组)和3只同龄对照的雄性正常WT小鼠(WT组),乙醚麻醉后采用颈椎脱臼法将其处死,取其睾丸组织准备后续实验。
1.3 样品总RNA抽提与检测取上述睾丸组织,加入RNA抽提试剂TRIzol(Invitrogen公司)。按照试剂说明,分别抽提两组小鼠睾丸组织的总RNA,然后用NanoDrop ND-1000和琼脂糖凝胶电泳检测鉴定总RNA的纯度及质量,合格RNA进一步纯化用于芯片杂交。
1.4 cDNA样品合成、标记和杂交由上海敏芯信息科技有限公司实施芯片检测及协助进行数据分析。利用Agilent公司提供的试剂盒将总RNA合成cDNA,然后用荧光标记合成cRNA探针,使用紫外分光光度计检测荧光标记效率,以保证后续芯片实验结果的可靠性。将标记的cRNA与Agilent小鼠表达谱(8×60 K)芯片杂交,之后进行洗涤。芯片结果采用Agilent扫描仪进行扫描,利用Feature Extraction进行处理分析。
1.5 生物学意义分析采用基因本体 (GO,http://www.geneontology.org/)方法,从生物学进程、细胞元件及分子功能3个层面对差异表达的lncRNA和mRNA进行功能生物学富集分析;然后,利用KEGG通路分析工具(http://www.genome.jp/kegg/)寻找差异lncRNA和mRNA所属的生物学过程以及信号通路。结合统计学数据,运用相关矩阵法构建lncRNA-mRNA共表达的调控网络图。
1.6 qRT-PCR采用TRIzol试剂提取βB2基因敲除小鼠以及WT小鼠睾丸组织的总RNA,使用反转录试剂盒(TaKaRa)将RNA反转录为cDNA。随后以此cDNA为模板进行qRT-PCR,所用引物序列见表 1。使用的仪器为qRT-PCR仪(Applied Biosystems 7300,Life Technologies),试剂为SYBR-Green PCR Kit(TaKaRa)。qRT-PCR的反应条件:95℃预变性2 min;95℃ 15 s、60℃ 30 s,进行40个循环。
|
|
表 1 荧光定量PCR引物序列 Tab 1 Primers of fluorescence quantitative real-time PCR |
采用SPSS 17.0软件包进行统计学分析,结果均以 x±s 来表示,数据经t检验和单向方差分析(ANOVA),检验水准(α)为0.05;筛选差异表达lncRNA的阈值是倍数≥2.0(P< 0.05)。
2 结 果 2.1 差异表达RNA的双向聚类分析筛选差异表达的lncRNA及mRNA,采用软件Gene Cluster 3.0 对差异lncRNA和mRNA进行系统聚类分析,上调为红色,下调为绿色。结果如图 1所示,差异表达lncRNA共140条,其中下调88条、上调52条;差异表达mRNA共477条,其中下调219条、上调258条。表 2、3列出了部分差异表达的lncRNA和mRNA,FC(abs)为实验组与对照组差异倍数绝对值。
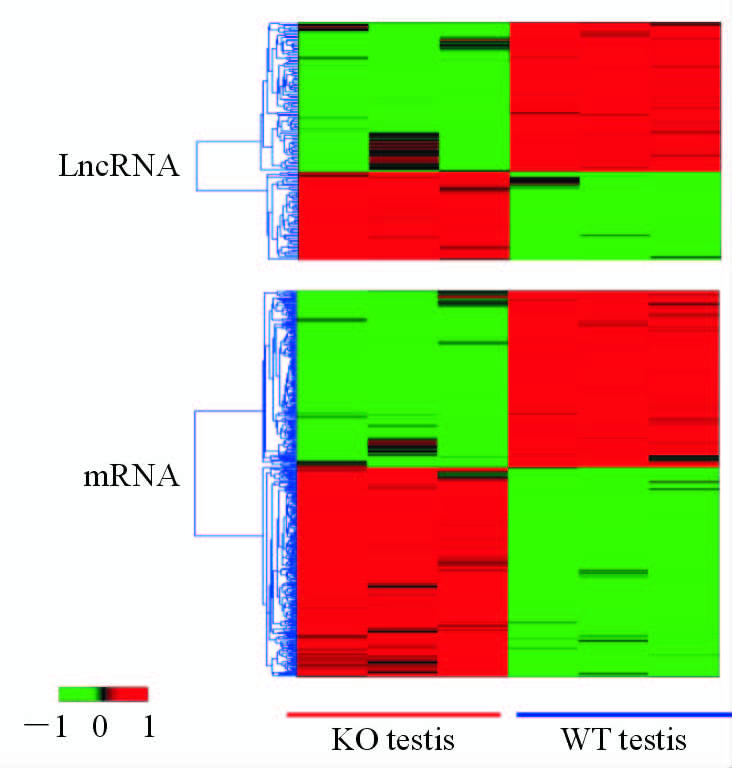
|
图 1 差异lncRNAs和mRNAs聚类图 Fig 1 Cluster analysis of differentially expressed lncRNAs and mRNAs in testis tissues from WT and CRYBB2 gene knockout mice KO: CRYBB2 knockout; WT: Wild-type |
|
|
表 2 βB2基因敲除小鼠睾丸组织中部分差异表达的lncRNA Tab 2 Differentially expressed lncRNAs in testis tissues of CRYBB2 gene knockout mice |
|
|
表 3 βB2基因敲除小鼠睾丸组织中部分差异表达的mRNA Tab 3 Differentially expressed mRNAs in testis tissues of CRYBB2 gene knockout mice |
通过GO数据库分析,筛选边差异表达的lncRNA共12条,其中上调7条,下调5条,将差异表达的lncRNA和mRNA进行功能注释,得到其参与的部分功能,结果表明差异lncRNA和mRNA在生物学途径、细胞元件和分子功能中均有分布(表 4)。特别是位于细胞质中的P2rx7,其在调控细胞周期、增殖及信号转导中起重要作用。
|
|
表 4 差异lncRNA和mRNA在GO分析中的表达分布情况 Tab 4 GO analysis of differentially expressed genes in the testis tissues of CRYBB2 gene knockout mice |
将筛选出的差异表达mRNA经KEGG数据库进行路径分析,结果发现差异lncRNA和mRNA主要经由Ca2+信号、配体-受体相互作用等信号通路发挥作用,如P2rx7;此外Hdac1还在细胞周期和增殖中发挥作用。
2.4 lncRNA与mRNA相互作用的网络图用关联矩阵法建立lncRNA和mRNA共表达网络图。如图 2所示,本次实验共有 17个节点,12条连接,9条lncRNA和8条mRNA。其中Rsl1由3条lncRNA调控,Lpo和Mpo各由2条lncRNA调控,Hdac1、Ephb4等各由1条lncRNA调控。

|
图 2 mRNA-lncRNA共表达网络图 Fig 2 The lncRNA-mRNA regulatory network Lines represent the relationship between the two types of regulation |
采用qRT-PCR分析在WT 和KO小鼠睾丸组织中差异表达的10组lncRNA和mRNA,发现A-30-P01019163和P2rx7在WT和KO组小鼠中表达差异均有统计学意义(P<0.05)。见图 3。
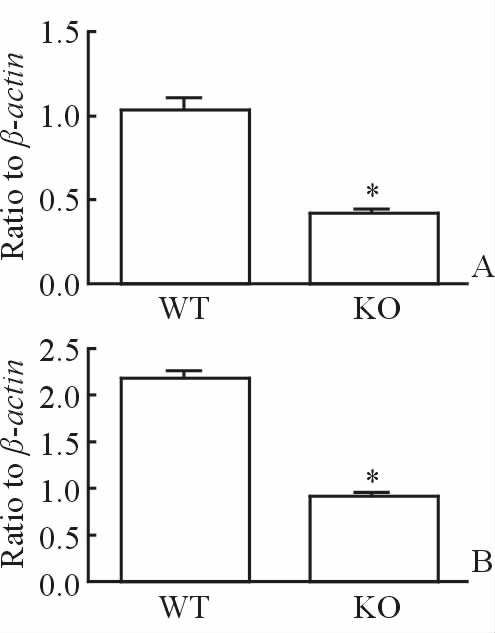
|
图 3 A-30-P01019163(A)与P2rx7(B)在WT和KO小鼠中的表达水平 Fig 3 qRT-PCR analysis of A-30-P01019163 (A) and P2rx7 (B) in the testis tissues of CRYBB2 gene knockout mice WT: Wild-type; KO: CRYBB2 knockout. *P<0.05 vs WT group. n=6, x±s |
CRYBB2作为一种重要的晶体蛋白,理应局限于晶状体内发挥功能,但近年来研究发现该蛋白在晶状体外也具有潜在的重要作用,如βB2基因敲除小鼠在睾丸组织中显示出形态和功能的显著异常[7]。
本研究通过基因芯片分析,采用生物信息学方法,获得差异表达的lncRNA和mRNA,随后进行GO数据库分析,得出这些差异lncRNA和mRNA主要分布于代谢、免疫系统、信号转导等生物学进程、细胞元件和分子功能中;又经KEGG数据库分析,得知差异lncRNA和mRNA发挥作用的主要信号通路;用关联矩阵法建立了小鼠睾丸组织中lncRNA和mRNA共表达的网络图,得到lncRNA和mRNA的交集。众多研究表明,离子通道与雄性哺乳动物生精及受精等生殖过程关系密切。其中Ca2+通道在哺乳动物精子获能和顶体反应等功能中起重要作用[21]。综合以上信息,本研究挑选主要由Ca2+信号、配体-受体相互作用等信号通路起作用的差异表达lncRNA和mRNA进行qRT-PCR验证,发现在WT组和βB2基因KO组小鼠睾丸组织中P2rx7的表达差异有统计学意义。有研究证明,P2rx7在细胞增殖和细胞周期中起重要作用[22, 23],这与我们GO分析的生物学功能结果相匹配,表明P2rx7可能通过此途径影响睾丸组织的发育。根据相互作用网络图,本研究进而验证了与P2rx7相关的lncRNA,结果发现lncRNA A-30-P01019163的表达在两组间的差异也有统计学意义。据此推测,βB2基因敲除后lncRNA A-30-P01019163、P2rx7表达同步下调,可能影响睾丸组织的细胞信号转导、细胞周期,进而影响睾丸组织发育。
近年国内外相关研究通过广泛运用cDNA文库以及第二代测序等新技术,揭示了哺乳动物存在大量lncRNA,提示lncRNA在哺乳动物的生存、发育过程中起着重要作用。但并非所有lncRNA都有功能,而仅有一小部分有生物学功能[12, 24]。另外,与miRNA不同,lncRNA可以调节蛋白质表达的转录后调控,还可以与转录激活因子或者抑制因子结合,从而上调或下调下游基因的表达[25]。本实验初步分析了lncRNA的调控途径或功能,得到如下认知:在WT 和βB2基因敲除小鼠的睾丸组织差异表达的10组lncRNA和mRNA中,A-30-P01019163 和P2rx7同步下调,提示βB2基因敲除后,可能由于lncRNA A-30-P01019163的表达量下降,进而或同时下调了P2rx7的表达量,再影响小鼠睾丸组织的细胞信号转导及细胞周期,最终影响睾丸组织发育。
上述认知还需更进一步实验以确认βB2基因、lncRNA A-30-P01019163、mRNA P2rx7以及小鼠睾丸组织发育之间存在何种确切的依存关系,并由此协调控制小鼠睾丸的发育进程。尽管如此,上述现象及初步研究结果均提示,βB2基因敲除后,部分lncRNA的确可以调控下游基因的表达,进而影响睾丸功能。
志谢 感谢上海敏芯信息科技有限公司协助进行数据分析。
| [1] | Zhang J, Li J, Huang C, Xue L, Peng Y, Fu Q, et al. Targeted knockout of the mouse βB2-crystallin gene (Crybb2) induces age-related cataract[J]. Invest Ophthalmol Vis Sci, 2008, 49: 5476-5483. |
| [2] | Ganguly K, Favor J, Neuhäuser-Klaus A, Sandulache R, Puk O, Beckers J, et al. Novel allele of crybb2 in the mouse and its expression in the brain[J].Invest Ophthalmol Vis Sci, 2008, 49: 1533-1541. |
| [3] | Liedtke T, Schwamborn J C, Schröer U, Thanos S. Elongation of axons during regeneration involves retinal crystallin beta b2 (crybb2) [J]. Mol Cell Proteomics, 2007, 6: 895-907. |
| [4] | Magabo K S, Horwitz J, Piatigorsky J, Kantorow M. Expression of βB(2)-crystallin mRNA and protein in retina, brain, and testis[J]. Invest Ophthalmol Vis Sci, 2000, 41: 3056-3060. |
| [5] | Duprey K M, Robinson K M, Wang Y, Taube J R, Duncan M K. Sub fertility in mice harboring a mutation in βB2-crystallin[J]. Mol Vis, 2007, 13: 366-373. |
| [6] | Lampi K J, Amyx K K, Ahmann P, Steel E A. Deamidation in human lens βB2-crystallin destabilizes the dimer[J].Biochemistry, 2006, 45: 3146-3153. |
| [7] | 相芬芬. βB2-晶体蛋白调控雄性小鼠生殖功能的机制研究[D].上海: 第二军医大学, 2012. |
| [8] | Gao Q, Sun L L, Xiang F F, Gao L, Jia Y, Zhang J R, et al. Crybb2 deficiency impairs fertility in female mice[J]. Biochem Biophys Res Commun, 2014, 453: 37-42. |
| [9] | Whitehead J, Pandey G K, Kanduri C. Rcgulation of the mammalian epigenome by long noncoding RNAs[J]. Biochim Biophys Acta, 2009: 936-947. |
| [10] | Faghihi M A, Modarresi F, Khalil A M, Wood D E, Sahagan B G, Morgan T E, et al. Expression of a noncoding RNA is elevated in Alzheimer's disease and drives rapid feed-forward regulation of beta-secretase[J]. Nat Med, 2008, 14: 723-730. |
| [11] | Goodrich J A, Kugel J F. Non-coding-RNA regulators of RNA polymerase Ⅱ transcription[J]. Nat Rev Mol Cell Biol, 2006, 7: 612-616. |
| [12] | Mercer T R, Dinger M E, Mattick J S. Long non-coding RNAs: insights into functions[J]. Nat Rev Genet, 2009, 10: 155-159. |
| [13] | Reinius B, Shi C, Hengshuo L, Sandhu K S, Radomska K J, Rosen G D, et al. Female-biased expression of long non-coding RNAs in domains that escape X-inactivation in mouse[J]. BMC Genomics, 2010, 11: 614. |
| [14] | Yang Z, Zhou L, Wu L M, Lai M C, Xie H Y, Zhang F, et al. Overexpression of long non-coding RNA HOTAIR predicts tumor recurrence in hepatocellular carcinoma patients following liver transplantation[J]. Ann Surg Oncol, 2011, 18: 1243-1250. |
| [15] | Kogo R, Shimamura T, Mimori K, Kawahara K, Imoto S, Sudo T, et al. Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers[J]. Cancer Res, 2011, 71: 6320-6326. |
| [16] | Niinuma T, Suzuki H, Nojima M, Nosho K, Yamamoto H, Takamaru H, et al. Upregulation of miR-196a and HOTAIR drive malignant character in gastrointestinal stromal tumors[J]. Cancer Res, 2012, 72: 1126-1136. |
| [17] | Huang M D, Chen W M, Qi F Z, Xia R, Sun M, Xu T P, et al. Long non-coding RNA ANRIL is upregulated in hepatocellular carcinoma and regulates cell apoptosis by epigenetic silencing of KLF2[J]. J Hematol Oncol, 2015, 8: 50. |
| [18] | Kiefer J C. Epigenetics in development[J]. Dev Dyn, 2007, 236: 1144-1156. |
| [19] | Lee J T. Gracefully ageing at 50, X-chromosome inactivation becomes a paradigm for RNA and chromatin control[J]. Nat Rev Mol Cell Biol, 2011, 12: 815-826. |
| [20] | 张 军,黄才国,李闻捷, Wei Weng,汪佳祺.βB2晶体蛋白基因敲除小鼠模型的建立[J].第二军医大学学报,2006,27:1246-1248. ZHANG J, HUANG C G, LI W J, Wei Weng, WANG J Q. Establishment of a βB2 crystallin gene knockout mice model[J]. Acad J Sec Mil Med Univ, 2006, 27: 1246-1248. |
| [21] | Luo T, Zou Q X, He Y Q, Wang H F, Li N, Zeng X H.Matrine inhibits mouse sperm function by reducing sperm [Ca2+] i and phospho-ERK1/2[J]. Cell Physiol Biochem, 2015, 35: 374-385. |
| [22] | Wu P Y, Lin Y C, Chang C L, Lu H T, Chin C H, Hsu T T, et al. Functional decreases in P2X7 receptors are associated with retinoic acid-induced neuronal differentiation of Neuro-2a neuroblastoma cells[J].Cell Signal, 2009, 21: 881-891. |
| [23] | Harada H, Chan C M, Loesch A, Unwin R, Burnstock G.Induction of proliferation and apoptotic cell death via P2Y and P2X receptors, respectively, in rat glomerular mesangial cells[J].Kidney Int, 2000,57: 949-958. |
| [24] | Dinger M E, Amaral P P, Mercer T R, Mattick J S. Pervasive transcription of the eukaryotic genome: functional indices and conceptual implications[J]. Brief Funct Genomic Proteomic, 2009, 8:407-423. |
| [25] | Goodrich J A, Kugel J F. Non-coding-RNA regulators of RNA polymerase Ⅱ transcription[J].Nat Rev Mol Cell Biol, 2006, 7: 612-616. |
 2016, Vol. 37
2016, Vol. 37


