引用本文

陈旭娇, 庹素馨, 陶煜, 卞蓉蓉, 邢小红, 潘晓红, 陈娟娟, 毛志国. 终末期肾病腹膜透析患者退出治疗危险因素分析[J]. 第二军医大学学报, 2016, 37(1): 27-33

CHEN Xu-jiao, TUO Su-xin, TAO Yu, BIAN Rong-rong, XING Xiao-hong, PAN Xiao-hong, CHEN Juan-juan, MAO Zhi-guo. Risk factors for peritoneal dialysis drop-out in patients with end-stage kidney disease[J]. Academic Journal of Second Military Medical University, 2016, 37(1): 27-33 (in Chinese with English abstract)

终末期肾病腹膜透析患者退出治疗危险因素分析
陈旭娇

, 庹素馨, 陶煜, 卞蓉蓉, 邢小红, 潘晓红, 陈娟娟, 毛志国


第二军医大学长征医院肾内科, 解放军肾脏病研究所 上海 200003
收稿日期: 2015-08-16 接受日期: 2015-11-06.
基金项目: 国家自然科学基金面上项目(81570621),中华医学会临床医学科研专项资金-施维雅肾脏病青年研究与发展资金(13030340419),"十二五"国家科技支撑计划(2011BAI10B08).
作者简介: 陈旭娇, 硕士生. E-mail: anjiechen@yeah.net
通信作者(Corresponding author): 毛志国, Tel: 021-81885394, E-mail: maozhiguo93@gmail.com
摘要: 目的 分析进入腹膜透析(peritoneal dialysis, PD)终末期肾病(end-stage kidney disease, ESKD)患者基线的相关检测指标和临床资料,探究可能影响PD患者最终退出的危险因素,为患者透析方式的选择提供参考。 方法 回顾性分析2011年7月至2012年7月第二军医大学长征医院PD中心99例ESKD行PD管植入术且临床资料完整的患者信息,根据患者在随后3年内是否退出PD将其分为退出组(包括死亡组和转血液透析组)和维持PD组,对术前相关检测指标和临床资料进行相关性分析,探究可能影响PD退出的危险因素。 结果 在排除肾移植(10例)及失访(6例)后,共有83例纳入分析。维持PD组50例,退出组33例,其中死亡19例,转血液透析14例。多因素逐步Cox回归分析提示,患者术前患有糖尿病(P=0.003,HR:3.61,95% CI:1.57~8.30)、高磷血症(P< 0.001,HR:1.65,95% CI:1.26~2.13)、高血清总胆红素(P=0.006,HR:1.11,95% CI:1.03~1.19)是影响患者退出PD的独立危险因素;除上述指标外,年龄(P=0.035,HR:1.05,95% CI:1.00~1.07)、低血红蛋白(P=0.016,HR:0.96,95% CI:0.94~0.99)是影响PD患者死亡的独立危险因素。 结论 糖尿病、高磷血症、高血清总胆红素是影响PD患者退出的独立危险因素。
关键词:
终末期肾病
腹膜透析
危险因素
Cox回归分析
总胆红素
Risk factors for peritoneal dialysis drop-out in patients with end-stage kidney disease
CHEN Xu-jiao

, TUO Su-xin, TAO Yu, BIAN Rong-rong, XING Xiao-hong, PAN Xiao-hong, CHEN Juan-juan, MAO Zhi-guo


Department of Nephrology, Kidney Institute of PLA, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
Abstract: Objective To analyze the baseline detection indicator and clinical data of peritoneal dialysis (PD) patients with end-stage kidney disease (ESKD) and to identify the risk factors for PD drop-out in ESKD patients, so as to provide reference for selecting dialysis modes. Methods The baseline data of 99 ESKD patients starting to receive PD in Changzheng Hospital, Second Military University from July 2011 to July 2012, were analyzed retrospectively. The patients were divided into drop-out group (including patients who were dead and turned to hemodialysis ) and continuous PD group according to whether they were dropped out during a follow-up of 3 years. Correlation analysis was done for preoperative examination indices and clinical data to identify the risk factors of PD drop-out. Results Ten renal transplant patients and 6 who were lost in follow-up were excluded and finally there were 83 patients included. Fifty patients were in the continous PD group and 33 patients were dropped out during a 3-year follow-up period, with 19 died and 14 transferred to hemodialysis. Multivariate Cox regression analysis showed that presence of diabetes (P=0.003, HR:3.61, 95% CI:1.57-8.30), hyperphosphatemia (P<0.001, HR:1.65, 95% CI:1.26-2.13), and high serum total bilirubin (P=0.006, HR:1.11, 95% CI:1.03-1.19) were the independent risk factors of PD drop-out. In addition, age (P=0.035, HR:1.05, 95% CI:1.00-1.07) and anemia (P=0.016, HR:0.96, 95% CI:0.94-0.99) were the independent risk factors for all-caused mortality. Conclusion Presence of diabetes, hyperphosphatemia, and high serum total bilirubin are possible independent risk factors of PD drop-out.
Key words:
end-stage kidney disease
peritoneal dialysis
risk factors
Cox regression analysis
total bilirubin
随着社会老龄化及糖尿病、高血压等慢性疾病发病率升高,全球慢性肾脏病(chronic kidney disease,CKD)患病人数逐年增加[1, 2]。我国成年人群中CKD的患病率为10.8%[3],据此估计我国现有成年CKD患者1.2 亿。随着病程进展,大量CKD患者进入终末期肾病期(end-stage kidney disease,ESKD)。欧洲肾病透析移植协会(ERA-EDTA)统计数据显示,65~74岁的ESKD人群平均预期寿命为5年,比正常人群低50%[4]。因此,ESKD 的有效治疗已成为一项重要的公共卫生问题。
腹膜透析(peritoneal dialysis,PD)近年在临床得到了广泛应用,已成为ESKD替代治疗的重要组成部分[5, 6]。与血液透析(hemodialysis dialysis,HD)相比,PD具有操作简便、血流动力学影响小、残肾功能保护较好等优点,可以居家透析,患者生活质量相对较高,且在透析初期患者生存率方面也具备优势。但随着透析时间延长,3年内大约有30%~60%的患者因死亡或转HD而退出PD[7, 8],限制了PD的发展。因此,早期发现影响PD患者退出治疗的危险因素,对PD患者的选择以及通过早期干预降低治疗失败退出率都具有重要的临床意义。
本研究对我院99例ESKD行腹透管植入术患者术前1周内的实验室检测指标和临床资料进行了统计学处理,分析其中可能影响患者退出PD的原因和危险因素,并就选择何种患者进行PD治疗以及如何降低PD退出率和死亡率的相应标准及对策展开探讨。
1 材料和方法
1.1 研究对象
回顾性分析第二军医大学长征医院2011年7月至2012年7月行腹透管植入术的99例ESKD患者资料,排除肾移植(10例)、失访(6例)后,共有83例纳入研究;其原发病分别为:慢性肾炎37例,糖尿病肾病17例,高血压肾硬化15例,多囊肾病1例,痛风性肾病1例,间质性肾炎1例,系统性红斑狼疮1例,不明原因10例。整理患者术前1周内相关检查指标、临床数据和PD治疗3年的调查终点资料,其中,到调查终点仍行PD治疗的患者为维持PD组,死亡和转为HD的患者为退出组。
1.2 观测方法
收集符合研究标准的83例患者完整病历资料,腹透管植入术后3年为调查终点,若患者退出PD,则退出日期即为观察终点。记录入组患者的性别、年龄、身高、体质量、体质量指数(body mass index,BMI)、原发病、透析时间以及白细胞(WBC)、血红蛋白(Hb)、血小板(PLT)、血清铁(sFe)、总铁结合力(TIBC)、转铁饱和度(TSAT)、铁蛋白(ferritin)、血钾(K)、血钠(Na)、血氯(Cl)、二氧化碳结合力(CO2CP)、血钙(Ca)、血磷(P)、甲状旁腺激素(iPTH)、尿素氮(BUN)、血肌酐(Scr)、C-反应蛋白(CRP)、总蛋白(Tp)、白蛋白(Alb)、谷草转氨酶(AST)、总胆红素(TBIL)、丙氨酸转氨酶(ALT)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)等实验室检查指标。记录收缩压(SBP)、舒张压(DBP),计算平均动脉压力(MAP)=舒张压+(收缩压-舒张压)/3。
1.3 统计学处理
对调查数据分别作描述性统计,所有数据输入SPSS 21.0软件进行分析,计量资料以 x±s表示,正态分布的资料比较用t检验,非正态分布的计量资料以中位数及范围表示,比较用秩和检验;影响透析预后的因素用单因素Cox回归分析和多因素逐步Cox回归分析,生存情况采用Kaplan-Meier生存曲线分析。检验水准(α)为0.05。
2 结果
2.1 入组患者一般资料
83例入组患者中,平均年龄(52.54±17.02)岁,平均透析时间(27.46±11.95)个月,其中女性40例(48.19%)。至调查终点,维持PD组患者共50例,平均年龄为(49.56±16.03)岁;退出组患者共33例,其中死亡19例,平均年龄(62.32±19.52)岁,平均透析时间(12.79±7.90)个月,转HD 14例,平均年龄为(49.93±13.00)岁,平均透析时间(16.86±9.89)个月,详见表 1。退出组中,15例(45.4%)患者在PD第1年退出,其中死亡9例,转HD 6例。12例(36.4%)患者于PD第2年退出,其中死亡8例,转HD 4例。6例(18.2%)患者于PD第3年退出,死亡2例,转HD 4例。
表 1 (Table 1)

表 1 入组83例PD患者一般资料
Tab 1 Baseline characteristics of 83 PD patients
| x±s |
| Item |
Continuous PD
n=50 |
Drop-out
n=33 |
| PD failure event
n=14 |
All-cause mortality
n=19 |
| Age (year) |
49.56±16.03 |
49.93±13.00 |
62.32±19.52 |
| Time of PD
t/month |
- |
16.86±9.89 |
12.79±7.90 |
| Leukocyte count (×10
9, L
-1) |
6.60±2.09 |
6.99±4.26 |
7.93±5.68 |
| Hemoglobin
ρ
B/(g·L
-1) |
92.02±20.89 |
88.07±22.02 |
78.50±13.59 |
| Blood platelet count (×10
9, L
-1) |
191.86±77.70 |
184.71±58.59 |
192.39±127.92 |
| Serum ferritin
c
B/(μmol·L
-1) |
10.64±8.41 |
9.13±5.99 |
7.92±4.98 |
| Total iron binding capacity
c
B/(μmol·L
-1) |
51.78±9.30 |
46.76±10.79 |
48.40±13.01 |
| transferrin saturation (%) |
19.84±12.64 |
18.80±8.69 |
17.65±11.55 |
| Ferritin
c
B/(μmol·L
-1) |
382.60±289.96 |
237.91±204.50 |
298.35±260.92 |
| Kalium
c
B/(mmol·L
-1) |
4.43±0.65 |
4.68±0.69 |
4.59±0.99 |
| Natrium
c
B/(mmol·L
-1) |
140.12±3.88 |
139.69±3.90 |
140.94±3.49 |
| Chloremia
c
B/(mmol·L
-1) |
102.88±4.62 |
100.77±5.96 |
101.69±5.83 |
| CO
2CP
c
B/(mmol·L
-1) |
22.17±4.47 |
23.77±4.21 |
23.31±4.30 |
| Calcium
c
B/(mmol·L
-1) |
2.24±0.30 |
2.34±0.26 |
2.21±0.32 |
| Phosphate
c
B/(mmol·L
-1) |
1.72±0.43 |
1.84±0.60 |
2.29±2.10 |
| iPTH
ρ
B/(pg·mL
-1) |
242.35±202.76 |
162.22±129.16 |
186.16±112.19 |
| Blood urea nitrogen
c
B/(mmol·L
-1) |
24.12±10.01 |
26.16±11.12 |
17.69±8.50 |
| Creatinine
c
B/(μmol·L
-1) |
737.30±276.98 |
687.00±226.55 |
600.94±172.47 |
| hsCRP
ρ
B/(mg·L
-1) |
5.78±8.94 |
14.28±29.79 |
32.77±58.12 |
| Blood glucose
c
B/(mmol·L
-1) |
4.75±1.29 |
5.87±2.25 |
5.61±1.78 |
| Total protein
ρ
B/(g·L
-1) |
62.40±8.04 |
58.79±9.64 |
62.22±6.88 |
| Albumin
ρ
B/(g·L
-1) |
36.50±5.53 |
32.86±5.35 |
34.56±3.01 |
| AST
z
B/(U·L
-1) |
20.49±10.39 |
21.43±11.78 |
29.76±28.22 |
| ALT
z
B/(U·L
-1) |
17.84±11.04 |
20.86±13.96 |
15.47±7.12 |
| Total serum bilirubin
c
B/(μmol·L
-1) |
8.33±3.02 |
10.57±6.16 |
10.94±6.97 |
| Triglycerides
c
B/(mmol·L
-1) |
1.74±0.84 |
2.11±1.99 |
1.82±1.20 |
| Total cholesterol
c
B/(mmol·L
-1) |
4.11±1.42 |
3.94±0.95 |
4.49±1.16 |
| LDL cholesterol
c
B/(mmol·L
-1) |
2.46±0.94 |
2.24±0.85 |
2.44±0.84 |
| HDL cholesterol
c
B/(mmol·L
-1) |
1.03±0.32 |
0.91±0.40 |
0.99±0.30 |
| SBP
p/mmHg |
139.89±21.64 |
145.14±25.78 |
141.27±14.20 |
| DBP
p/mmHg |
82.96±10.82 |
79.57±10.50 |
80.55±6.76 |
| MAP
p/mmHg |
101.92±11.88 |
101.36±14.80 |
99.67±8.32 |
| Height
l/cm |
163.75±7.70 |
161.23±6.89 |
160.82±9.11 |
| Weight
m/kg |
61.44±13.75 |
58.78±11.02 |
58.49±11.17 |
| BMI (kg·m
-2) |
22.87±4.07 |
22.57±3.84 |
22.22±1.96 |
| PD:Peritoneal dialysis; HD:Hemodialysis; CO
2CP: Carbon dioxide combining power; iPTH: Immunoreactive parathyroid hormone; hsCRP: Hypersensitive C reactive
protein; AST: Aspartate transaminase; ALT: Alanine amiotransferase; LDL: Low-density lipoprotein;HDL: High-density lipoprotein;
SBP: Systolic blood pressure; DBP: Diastolic blood pressure; MAP: Mean artery pressure; BMI: Body mass index. PD failure event
was defined as the requirement for patient transfer to hemodialysis due to peritonitis, PD insufficiency, exit site and/or tunnel
infections, or mechanical problems.1 mmHg=0.133 kPa |
|
表 1 入组83例PD患者一般资料
Tab 1 Baseline characteristics of 83 PD patients
|
2.2 单因素和多因素Cox回归分析
单因素Cox回归分析显示,年龄(P=0.046,HR: 1.02,95% CI:1.00~1.04)、糖尿病(P=0.024,HR:2.43,95% CI:1.12~5.27)、Hb(P=0.036,HR:0.98,95% CI:0.96~0.99)、血P(P=0.004,HR:1.46,95% CI:1.13~1.90)、CRP(P=0.03,HR:1.01,95% CI: 1.00~1.02)、血糖(P=0.002,HR:1.34,95% CI:1.11~1.63)、Alb(P=0.027,HR:0.93,95% CI:0.87~0.99)、AST(P=0.027,HR:1.02,95% CI:1.00~1.04)、TBIL(P<0.001,HR:1.12,95% CI:1.05~1.19)是患者退出PD(死亡+转HD)的危险因素。通过多因素Cox逐步回归分析显示,糖尿病(P=0.003,HR:3.61,95% CI:1.57~8.30)、血P(P<0.001,HR:1.65,95% CI:1.26~2.13)、TBIL(P=0.006,HR:1.11,95% CI:1.03~1.19)是影响患者最终退出PD的独立危险因素。对退出组进行亚组分析显示,患者年龄、糖尿病、Hb、血P、CRP、TBIL、AST、血BUN是影响PD患者死亡的危险因素,年龄、糖尿病、血P、TBIL、Hb是影响PD患者死亡的独立危险因素;糖尿病、血糖、Alb、TBIL是影响PD患者转HD的危险因素,糖尿病、TBIL是影响PD患者转HD的独立危险因素,见表 2、表 3。
表 2 (Table 2)

表 2 单因素Cox回归分析PD患者退出的危险因素
Tab 2 Univariate Cox regression analysis of risk factors for peritoneal dialysis (PD) drop-out
| Factor |
Drop-out
n=33 |
All-cause mortality
n=19 |
PD failure event
n=14 |
| HR |
95% CI |
P
|
HR |
95% CI |
P
|
HR |
95% CI |
P
|
| Gender |
0.78 |
0.55-1.10 |
NS |
0.69 |
0.43-1.10 |
NS |
0.90 |
0.55-1.52 |
NS |
| Age |
1.02 |
1.00-1.04 |
0.046 |
1.04 |
1.01-1.07 |
0.005 |
1.00 |
0.96-1.02 |
NS |
| Diabetes mellitus |
2.43 |
1.12-5.27 |
0.024 |
3.40 |
1.32-8.75 |
0.011 |
5.02 |
1.70-14.79 |
0.003 |
| Leukocyte count |
1.06 |
0.97-1.17 |
NS |
1.09 |
0.97-1.20 |
NS |
1.02 |
0.86-1.21 |
NS |
| Hemoglobin |
0.98 |
0.96-0.99 |
0.036 |
0.97 |
0.94-0.99 |
0.017 |
0.99 |
0.96-1.02 |
NS |
| Blood platelet count |
1.00 |
0.99-1.00 |
NS |
1.00 |
0.99-1.00 |
NS |
1.00 |
0.99-1.00 |
NS |
| Serum ferritin |
0.96 |
0.89-1.03 |
NS |
0.95 |
0.86-1.03 |
NS |
0.98 |
0.88-1.08 |
NS |
| Total iron binding capacity |
0.98 |
0.94-1.01 |
NS |
0.99 |
0.94-1.03 |
NS |
0.97 |
0.90-1.03 |
NS |
| Transferrin saturation |
1.00 |
0.96-1.03 |
NS |
0.98 |
0.93-1.03 |
NS |
0.99 |
0.93-1.05 |
NS |
| Ferritin |
1.00 |
0.99-1.00 |
NS |
1.00 |
0.99-1.00 |
NS |
1.00 |
0.99-1.01 |
NS |
| Kalium |
1.40 |
0.84-2.29 |
NS |
1.28 |
0.65-2.50 |
NS |
1.56 |
0.74-3.27 |
NS |
| Natrium |
1.01 |
0.92-1.12 |
NS |
1.06 |
0.92-1.20 |
NS |
0.97 |
0.84-1.11 |
NS |
| Chloremia |
0.95 |
0.89-1.02 |
NS |
0.97 |
0.87-1.06 |
NS |
0.93 |
0.83-1.03 |
NS |
| CO
2CP |
1.06 |
0.97-1.16 |
NS |
1.05 |
0.92-1.19 |
NS |
1.08 |
0.94-1.22 |
NS |
| Calcium |
0.94 |
0.33-3.36 |
NS |
0.54 |
0.10-2.70 |
NS |
2.30 |
0.43-12.21 |
NS |
| Phosphate |
1.46 |
1.13-1.90 |
0.004 |
1.54 |
1.15-2.04 |
0.003 |
1.00 |
0.83-1.20 |
NS |
| iPTH |
1.00 |
0.99-1.01 |
NS |
1.00 |
0.99-1.00 |
NS |
1.00 |
0.99-1.00 |
NS |
| Blood urea nitrogen |
0.98 |
0.95-1.02 |
NS |
0.94 |
0.88-0.99 |
0.022 |
1.03 |
0.97-1.08 |
NS |
| Creatinine |
1.00 |
0.99-1.00 |
NS |
1.00 |
0.99-1.00 |
NS |
1.00 |
0.99-1.00 |
NS |
| hsCRP |
1.01 |
1.00-1.02 |
0.03 |
1.01 |
1.00-1.01 |
0.019 |
1.00 |
0.98-1.02 |
NS |
| Blood glucose |
1.34 |
1.11-1.63 |
0.002 |
1.29 |
0.99-1.66 |
NS |
1.42 |
1.06-1.89 |
0.017 |
| Total protein |
0.98 |
0.93-1.0 |
NS |
1.00 |
0.94-1.05 |
NS |
0.95 |
0.89-1.01 |
NS |
| Albumin |
0.93 |
0.87-0.99 |
0.027 |
0.96 |
0.87-1.04 |
NS |
0.90 |
0.81-0.99 |
0.032 |
| AST |
1.02 |
1.00-1.04 |
0.027 |
1.03 |
1.00-1.05 |
0.006 |
1.00 |
0.95-1.04 |
NS |
| ALT |
0.07 |
0.97-1.03 |
NS |
0.98 |
0.92-1.03 |
NS |
1.02 |
0.98-1.06 |
NS |
| Total serum bilirubin |
1.12 |
1.05-1.19 |
0.000 |
1.12 |
1.02-1.21 |
0.011 |
1.12 |
1.00-1.23 |
0.037 |
| Triglycerides |
1.03 |
0.78-1.34 |
NS |
0.95 |
0.63-1.42 |
NS |
1.12 |
0.77-1.60 |
NS |
| Total cholesterol |
1.04 |
0.79-1.35 |
NS |
1.17 |
0.84-1.62 |
NS |
0.86 |
0.55-1.33 |
NS |
| LDL cholesterol |
0.90 |
0.59-1.37 |
NS |
1.01 |
0.59-1.70 |
NS |
0.77 |
0.38-1.52 |
NS |
| HDL cholesterol |
0.55 |
0.17-1.77 |
NS |
0.82 |
0.18-3.64 |
NS |
0.32 |
0.05-1.96 |
NS |
| BMI |
0.97 |
0.87-1.08 |
NS |
0.96 |
0.81-1.13 |
NS |
0.84 |
0.85-1.13 |
NS |
| MAP |
0.99 |
0.98-1.02 |
NS |
0.98 |
0.97-1.02 |
NS |
1.02 |
0.99-1.30 |
NS |
| CO
2CP: Carbon dioxide combining power; iPTH: Immunoreactive parathyroid hormone; hsCRP: Hypersensitive C reactive
protein; AST: Aspartate transaminase; ALT: Alanine amiotransferase; LDL: Low-density lipoprotein; HDL: High-density lipoprotein;
BMI: Body mass index; MAP: Mean artery pressure; NS:Not significant |
|
表 2 单因素Cox回归分析PD患者退出的危险因素
Tab 2 Univariate Cox regression analysis of risk factors for peritoneal dialysis (PD) drop-out
|
表 3 (Table 3)

表 3 多因素Cox逐步回归分析PD患者退出的危险因素
Tab 3 Multivariate Cox regression analysis of risk factors for peritoneal dialysis (PD) drop-out
| Factor |
Drop-out
n=33 |
All-cause mortality
n=19 |
PD failure event
n=14 |
| HR |
95% CI |
P
|
HR |
95% CI |
P
|
HR |
95% CI |
P
|
| Age |
|
|
|
1.05 |
1.00-1.07 |
0.035 |
|
|
|
| Diabetes mellitus |
3.61 |
1.57-8.30 |
0.003 |
3.30 |
1.09-9.99 |
0.034 |
5.55 |
1.84-16.75 |
0.002 |
| Hemoglobin |
|
|
|
0.96 |
0.94-0.99 |
0.016 |
|
|
|
| Phosphate |
1.65 |
1.26-2.13 |
0.000 |
1.65 |
1.21-2.26 |
0.002 |
|
|
|
| Total serum bilirubin |
1.11 |
1.03-1.19 |
0.006 |
1.19 |
1.08-1.32 |
0.009 |
1.12 |
1.02-1.22 |
0.023 |
|
表 3 多因素Cox逐步回归分析PD患者退出的危险因素
Tab 3 Multivariate Cox regression analysis of risk factors for peritoneal dialysis (PD) drop-out
|
2.3 Kaplan-Meier 生存曲线分析
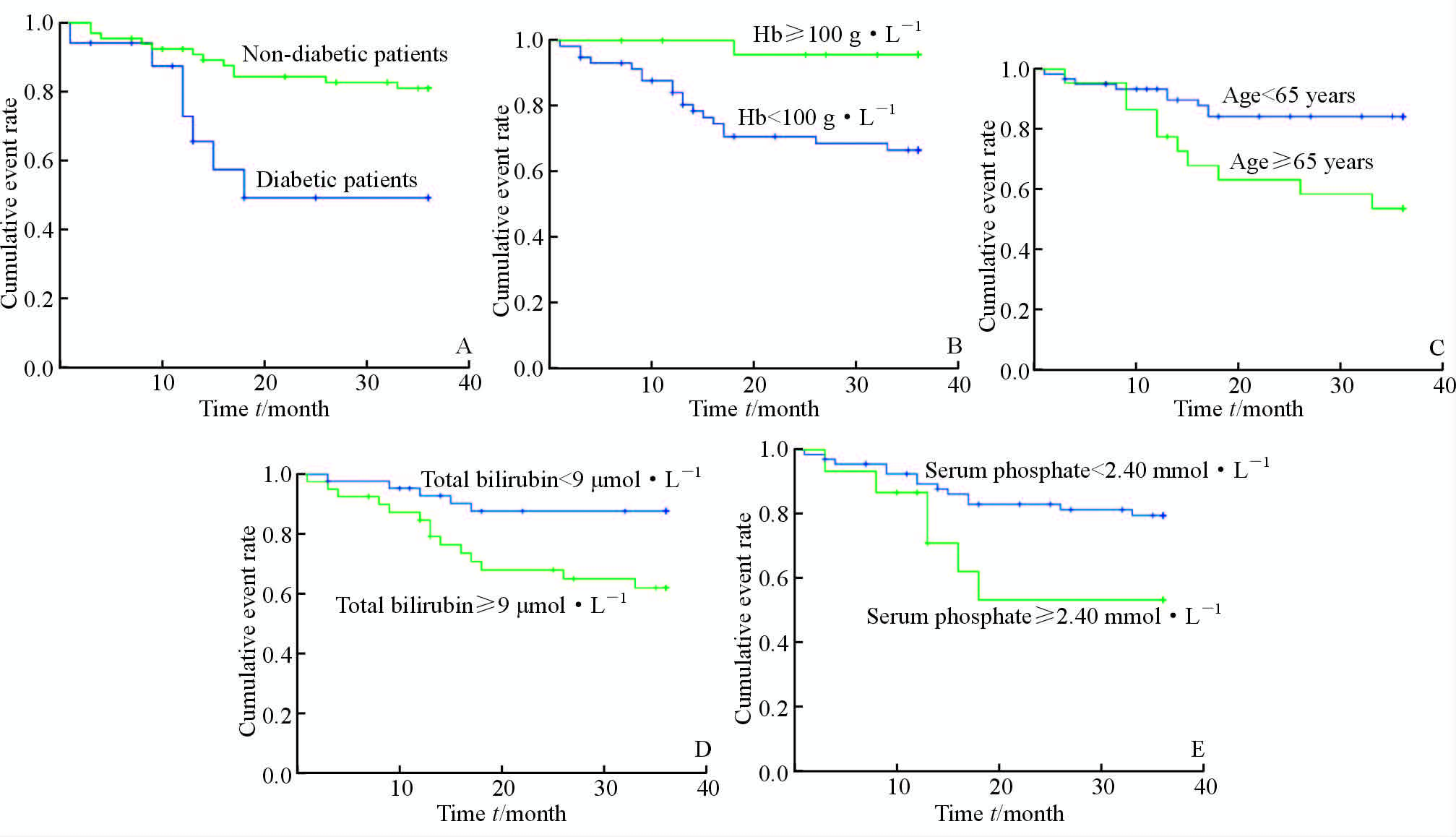
结果显示,PD患者生存率与糖尿病密切相关,无糖尿病的PD患者生存率高于合并糖尿病的患者(P=0.007);根据Hb浓度将患者分为两组,Hb≥100 g/L的PD患者生存率高于Hb<100 g/L的患者(P=0.008);根据年龄将患者分为两组,年龄≥65岁的患者生存率低于年龄<65岁的患者(P=0.006);TBIL浓度≥9 μmol/L患者生存率低于TBIL<9 μmol/L的患者(P=0.011);血P浓度≥2.40 mmol/L患者生存率低于血P<2.40 mmol/L的患者(P=0.043)。见图 1。
3 讨 论
由于PD在ESKD治疗中的诸多优势,近年来接受PD治疗的ESKD患者人数迅速增加,但各种原因导致的PD治疗退出率仍较高,严重影响了ESKD患者的治疗,限制了PD的发展。如何早期辨别PD患者退出治疗的危险因素,从而降低PD患者的退出率,已成为PD领域研究的热点和难点。本研究就可能影响PD患者死亡和转HD的相关危险因素进行分析,对PD患者的选择标准展开初步探索。
本项为期3年的回顾性调查资料显示,在排除肾移植、失访患者后,第二军医大学长征医院腹透中心因死亡和转HD的患者共有33例,其中转HD患者14例,死亡患者19例。多因素Cox逐步回归分析提示,糖尿病、TBIL是PD患者转HD的独立危险因素,除此之外,年龄、血P、Hb是影响PD患者死亡的独立危险因素。老龄患者退出率和死亡风险增高可能与其全身功能衰退、多脏器损害有关[8];而糖尿病患者常合并多种并发症,如心血管病、外周血管病、周围神经病变等,导致体力活动明显下降,腹膜功能衰竭速度较快,严重影响了生活质量和存活率。有研究表明糖尿病PD患者腹透时间及存活率低于非糖尿病患者[9],本研究Kaplan-Meier生存分析曲线亦提示合并糖尿病的PD患者透析生存时间缩短,死亡事件发生率增加,糖尿病患者3年死亡率约为非糖尿病患者的2倍;高磷血症是ESKD患者血管钙化发生和发展的主要因素之一,可显著增加心血管事件和全因死亡率,相关文献也提示高磷血症与PD患者退出率密切相关[8, 10]。TBIL可反映血流动力学变化,与心血管系统关系密切,文献报道,TBIL可显著增加心力衰竭患者的心血管事件和全因死亡率[11, 12]。心血管事件是ESKD患者主要死因,TBIL可能与ESKD患者预后相关[13]。TBIL与PD预后之间的关系目前未见报道,本研究显示TBIL是PD患者死亡和转HD的独立危险因素,然而有国外学者研究显示TBIL是CKD 3~5期以及HD患者预后的保护性因素[14, 15, 16],因此本研究结论需大样本、多中心研究进一步确认;此外,Hb与PD患者预后密切相关,研究报道当Hb浓度<100 g/L时患者死亡率显著增加[17, 18],而本研究中PD患者行腹透管植入术前贫血现象较为普遍,可能是影响患者预后的原因之一。此外,我们还考察了影响PD死亡和转HD的其他可能因素,包括性别、铁代谢指标、BMI、血脂、电解质等,均未发现明显的相关性。
综上所述,糖尿病、血P、TBIL是影响PD患者退出的独立危险因素,年龄、Hb、糖尿病、血P、TBIL是影响PD患者死亡的独立危险因素,糖尿病、TBIL是影响PD患者转HD的独立危险因素,在评估患者是否适合行PD治疗时要充分考虑这些危险因素。而积极纠正贫血和低蛋白血症、改善全身营养状况、降低血P和TBIL,可能会延长PD患者的透析时间并改善预后。但本研究为单中心研究,样本量相对较少,且由于回顾性研究本身存在的局限性,所得结果有待进一步大样本的前瞻性研究加以证实。
参考文献
| [1] |
Ortiz A, Covic A, Fliser D, Fouque D, Goldsmith D, Kanbay M, et al. Epidemiology, contributors to, and clinical trials of mortality risk in chronic kidney failure[J].Lancet, 2014, 383: 1831-1843.
|
| [2] |
Musso G, Tabibian J H, Charlton M. Chronic kidney disease (CKD) and NAFLD: time for awareness and screening[J]. J Hepatol, 2015, 62:983-984.
|
| [3] |
Zhang L, Wang F, Wang L, Wang W, Liu B, Liu J, et al. Prevalence of chronic kidney disease in China: across-sectional survey[J]. The Lancet, 2012, 379: 815-822.
|
| [4] |
de Jager D J, Grootendorst D C, Jager K J, van Dijk P C, Tomas L M, Ansell D, et al. Cardiovascular and noncardiovascular mortality among patients starting dialysis[J]. JAMA,2009, 302: 1782-1789.
|
| [5] |
Sakaci T, Ahbap E, Koc Y, Basturk T, Ucar Z A, S nangil A, et al. Clinical outcomes and mortality in elderly peritoneal dialysis patients[J]. Clinics (Sao Paulo), 2015, 70:363-368.
|
| [6] |
Bieber S D, Burkart J, Golper T A, Teitelbaum I, Mehrotra R. Comparative outcomes between continuous ambulatory and automated peritoneal dialysis: a narrative review[J]. Am J Kidney Dis, 2014, 63:1027-1037.
|
| [7] |
Riegel W, Krüger B. Dialysis and renal transplantation: update 2014 [J]. Dtsch Med Wochenschr, 2014, 139:1228-1230.
|
| [8] |
Cueto-Manzano A M, Quintana-Pina E, Correa-Rotter R. Long-term CAPD survival and analysis of mortality risk factors: 12-year experience of a single Mexican center[J]. Perit Dial Int, 2001, 21:148-153.
|
| [9] |
Tien K J, Lin Z Z, Chio C C, Wang J J, Chu C C, Sun Y M, et al. Epidemiology and mortality of new-onset diabetes after dialysis: Taiwan national cohort study[J]. Diabetes Care, 2013, 36:3027-3032.
|
| [10] |
Shang D, Xie Q, Ge X, Yan H, Tian J, Kuang D, et al. Hyperphosphatemia as an independent risk factor for coronary artery calcification progression in peritoneal dialysis patients[J]. BMC Nephrology, 2015, 16:107.
|
| [11] |
Ambrosy A P, Vaduganathan M, Huffman M D, Khan S, Kwasny M J, Fought A J, et al. Clinical course and predictive value of liver function tests in patients hospitalized for worsening heart failure with reduced ejection fraction: an analysis of the EVEREST trial[J]. Eur J Heart Fail, 2012, 14:302-311.
|
| [12] |
Lin S P, Lin P Y, Jiang H L, Long Y M, Chen X H. Is serum total bilirubin useful to differentiate cardioembolic stroke from other stroke subtypes?[J]. Neurol Res, 2015, 37:727-731.
|
| [13] |
Hamur H, Duman H, Bakirci E M, Kucuksu Z, Demirelli S, Kalkan K, et al. Bilirubin levels and thrombus burden in patients with ST-segment elevation myocardial infarction[J]. Angiology, 2015 Sep 2. pii: 0003319715603899. [Epub ahead of print]
|
| [14] |
Chin H J, Cho H J, Lee T W, Na K Y, Oh K H, Joo K W, et al. The mildly elevated serum bilirubin level is negatively associated with the incidence of end stage renal disease in patients with IgA nephropathy[J]. J Korean Med Sci, 2009, 24 (Suppl 1):S22-S29.
|
| [15] |
Sakoh T, Nakayama M, Tanaka S, Yoshitomi R, Ura Y, Nishimoto H, et al. Association of serum total bilirubin with renal outcome in Japanese patients with stages 3-5 chronic kidney disease[J]. Metabolism, 2015, 64:1096-1102.
|
| [16] |
do Sameiro-Faria M, Kohlova M, Ribeiro S, Rocha-Pereira P, Teixeira L, Nascimento H, et al. Potential cardiovascular risk protection of bilirubin in end-stage renal disease patients under hemodialysis[J]. Biomed Res Int, 2014, 2014:175286.
|
| [17] |
Teixeira J P, Combs S A, Teitelbaum I. Peritoneal dialysis: update on patient survival[J]. Clin Nephrol, 2015, 83:1-10.
|
| [18] |
Liu Y, Zhang H, Zhang K, Liu J, Zhou L, Liao X,et al. Metabolic status and personality affect the prognosis of patients with continuous ambulatory peritoneal dialysis[J]. Int J Clin Exp Med, 2015,8:440-447.
|
 2016, Vol. 37
2016, Vol. 37


