附睾具有精子贮存、成熟和运输的功能,附睾上皮细胞能合成和分泌多种蛋白,这些分泌蛋白在附睾中呈高度的区域性和时间特异性表达,精子通过与这些蛋白相互作用逐步成熟,并获得了运动能力和受精能力[1, 2]。防御素(defensin)是一类具有广谱抗菌活性的阳离子多肽,哺乳动物防御素可分为α、β和θ三类。附睾是β防御素表达最丰富的组织之一,有近50种β防御素被证实在附睾高表达,且绝大部分是近年来新发现的附睾特异基因[3, 4, 5, 6, 7]。许多具有β防御素样结构的附睾特异蛋白的功能尚不清楚。有研究显示,它们可能在宿主天然防御和精子成熟过程中发挥双重作用[8]。Bin1b是国内学者张永莲等[9]发现的特异表达于大鼠附睾头部上皮细胞的β防御素样分子。Bin1b能有效抑制附睾上皮原代培养上清液中大肠埃希氏菌(Escherichia coli,E.coli)的生长[10],并可在大鼠附睾不同区域以不同的方式与精子头部结合,通过上调Ca2+水平诱导未成熟精子的前向运动[11]。我们前期的研究也发现细菌脂多糖(lipopolysaccharides,LPS)可以抑制大鼠附睾头部Bin1b基因的表达,并抑制精子的成熟和运动能力;我们还发现原代培养的附睾上皮细胞在培养期间Bin1b的表达呈时间依赖性减少[12]。提示体内一些因素可上调Bin1b的表达。本研究观察了甾体激素对原代培养的附睾上皮细胞中Bin1b mRNA表达的影响,以寻找体内维持Bin1b生理性表达的因子,这将有助于阐明Bin1b在体内的调节机制。
1 材料 1.1 动物4个月龄雄性Sprague-Dawley大鼠购自中国科学院上海实验动物中心[SYXK(沪)2014-0028]。
1.2 试剂和仪器二氢睾酮(DHT)、Hank’s平衡液、胰酶和蛋白酶购自Sigma公司;TRIzol RNA抽提试剂购自Invitrogen公司;反转录试剂盒购自MBI Fermentas公司;实时定量PCR试剂盒购自TOYOBO公司;0.45 μm孔径尼龙膜和0.22 μm孔径PVDF膜分别为Osmonic公司和PALL公司产品;非必需氨基酸、DMEM和IMDM培养基购自Gibco公司;胎牛血清购自BI公司;小鼠抗大鼠Bin1b单克隆抗体和多克隆抗体由中国科学院上海生物化学与细胞生物研究所张永莲院士实验室提供。其他化学药品购自国药集团化学试剂有限公司和Amresco公司。
2 方法和结果 2.1 大鼠附睾头部上皮细胞分离培养雄性SD大鼠(体质量250~300 g)颈椎脱臼处死,取双侧附睾头部组织,剔除多余脂肪,放入60 mm培养皿中,加入2 mL Hank’s平衡盐溶液,剪碎组织,反复吹打,过200目滤网,收集组织碎块,重复10次,洗去精子,用滴管将上述组织碎块移入10 mL 0.25%胰蛋白酶液中,放入32℃摇床,60转/min消化30 min,消化后组织800×g离心5 min,弃上清,Hank’s平衡盐溶液重复洗2次,将组织移入10 mL 0.1%胶原酶液中,放入32℃摇床,60转/min 消化60 min,消化后组织用200目滤网过滤,滤液800×g离心5 min,弃上清,Hank’s平衡盐溶液重复洗2次,移入培养瓶中,加原代细胞培养液,置于37℃、5%CO2培养箱中孵育12 h,收集上清,离心计数后重种于6孔板。
2.2 RNA抽提原代培养的附睾头部上皮细胞,弃掉培养液,加入1 mL TRIzol,静置5 min充分裂解,反复吹打数次,后吸入1.5 mL EP管。加200 μL DEPC水平衡的氯仿,充分震荡混匀,静置10 min。15 000×g、4℃离心20 min,取上清加等体积异丙醇充分震荡,-20℃沉淀2 h。15 000×g、4℃离心20 min ,弃上清,沉淀用清洗液(无水乙醇∶DEPC水=3∶1)1 mL清洗2遍,16℃晾干沉淀,适量DEPC水溶解,测RNA浓度。
2.3 统计学处理数据以 x±s 表示,采用SAS软件进行统计学分析,各组间数据处理采用方差分析,两组比较采用t检验。检验水准(α)为0.05。
2.4 PCR 2.4.1 反转录反应总体积为10 μL,反应体系中包括RNA 2 μg,1 mmol/L dNTP,12 U RNA酶抑制剂,15 U AMV反转录酶,1×RT反应缓冲液,2.5 μmol/L随机引物。反应条件依次为:25℃ 10 min,42℃ 1 h,70℃ 10 min。反应在PCR仪中进行。反应产物置于-20℃中备用。
2.4.2 引物Bin1b、GAPDH的引物序列分别为:Bin1b (产物337 bp):forward 5′-GGA CAC CCA GTC ATC AGT CAC AT-3′,reverse 5′-TTT GGG GTG CTT CCA GGT CTC T-3′;GAPDH (产物443 bp):forward 5-TTC ATT GAC CTC AAC TAC ATG-3′,reverse 5′-GTG GCA GTG ATG GCA TGG AC-3′。Bin1b及其他β防御素引物为中国科学院上海生物化学与细胞生物研究所张永莲院士馈赠。
2.4.3 半定量PCR反应总体积为10 μL,反应体系中包括:cDNA 100 ng,1×PCR 反应缓冲液,1.8 mmol/L MgCl2,0.2 mmol/L dNTP,0.2 μmol/L上、下游引物,2 U Taq DNA聚合酶。反应条件:Bin1b、GAPDH,94℃ 30 s,58℃ 30 s,72℃ 40 s;Defb21,94℃ 30 s,51℃ 30 s,72℃ 40 s;Defb29,94℃ 30 s,50℃ 30 s,72℃ 40 s。对PCR扩增循环数进行优化,并将扩增条件定为:GAPDH,19 cycles;Bin1b ,原代细胞样品32 cycles。PCR产物于1.2%琼脂糖凝胶中电泳并拍照。
2.4.4 实时定量PCR反应总体积为15 μL,包括cDNA 50 ng,2×PCR master mix 7.5 μL,20 μmol/L的上、下游引物各0.15 μL,剩余体积由水补足。反应条件同半定量PCR。
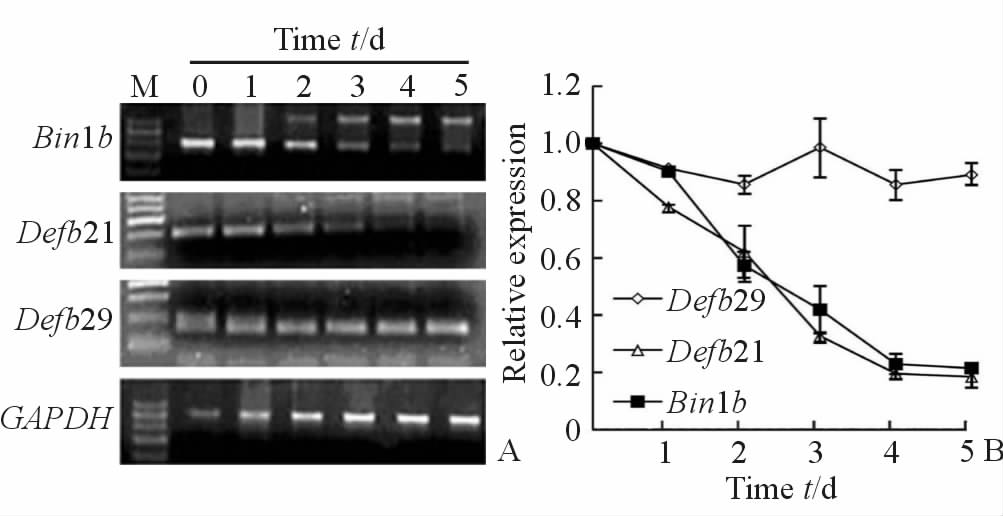
2.5 原代培养的附睾上皮细胞中Bin1b的表达呈时间依赖性减少原代分离培养的大鼠附睾上皮细胞中观察Bin1b和另外2个附睾头部特异的β防御素Defb21和Defb29的表达情况。结果显示Bin1b mRNA表达量随培养时间延长逐步降低,原代培养第2天Bin1b mRNA水平下调约40%,第3 天Bin1b mRNA水平下调约70%,5 d后附睾上皮细胞中几乎检测不到Bin1b mRNA表达(图 1)。Defb21的表达模式与Bin1b类似,呈时间依赖性降低,而Defb29 mRNA在体外原代培养附睾上皮中的表达不随时间增加而减少。
|
图 1 Bin1b、Defb21和Defb29 mRNA在原代培养大鼠附睾头部上皮细胞中的表达 Fig 1 Expressions of Bin1b, Defb21 and Defb29 mRNA in primary cultured rat epithelial cells from epididymis head A:RT-PCR analysis of mRNAs extracted from primary cells cultured for different day; B: Relative expressions of mRNAs. M:DNA marker. n=3, x±s |
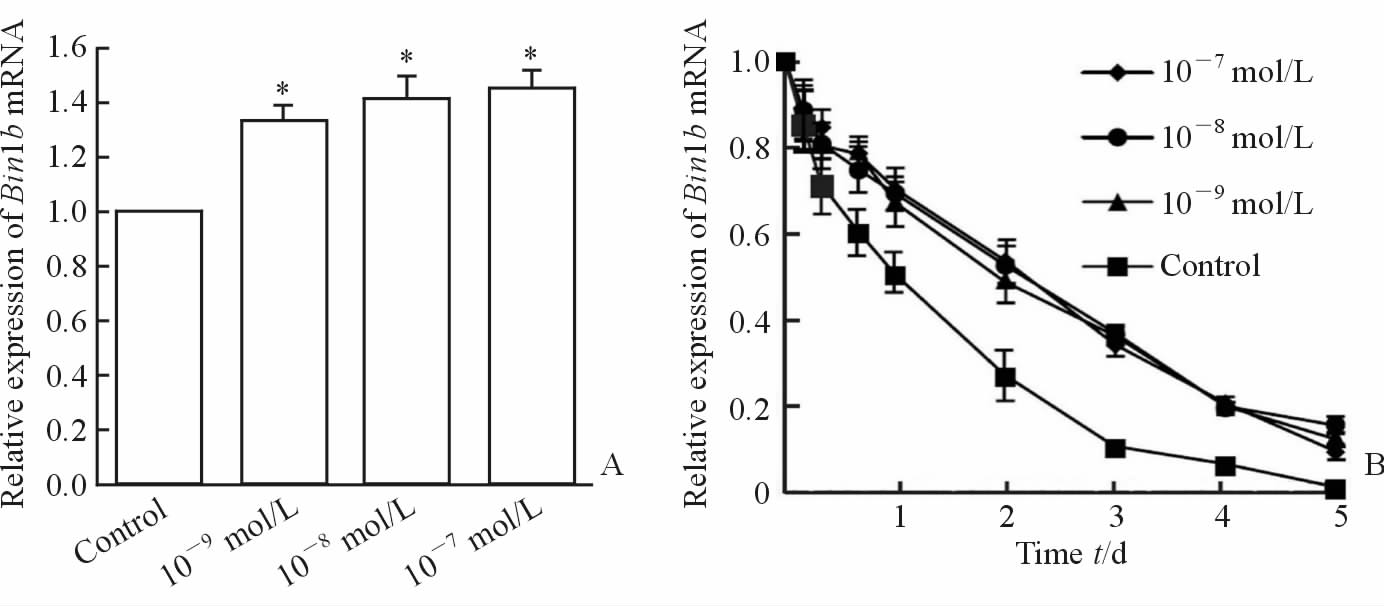
不同浓度(10-9、10-8、10-7mol/L)的DHT处理原代培养的附睾头部上皮 细胞24 h后检测Bin1b的表达情况。结果显示,DHT能进行性上调Bin1b mRNA的表达量。其中10-9 mol/L DHT使Bin1b mRNA表达较对照细胞增加约37%(P < 0.05),10-8 mol/L及10-7 mol/L的DHT处理后Bin1b mRNA表达进一步增加(图 2A)。进一步延长DHT处理细胞的时间至5 d,检测不同时间点(0、4、8、16 h,1、2、3、4、5 d)Bin1b mRNA的表达情况。结果显示,与对照细胞相比,不同浓度(10-9、10-8、10-7mol/L)的DHT处理不同时间点后Bin1b的表达下降速度减慢,但不能逆转原代附睾上皮细胞中Bin1b时间依赖性的表达下调(图 2B)。
|
图 2 不同浓度DHT对原代培养的附睾头部上皮细胞中Bin1b mRNA表达的影响 Fig 2 Effect of DHT on Bin1b mRNA expression in primary cultured epididymal epithelial cells A: Quantitative RT-PCR analysis of mRNA extracted from primary cells treated with control (equivalent ethanol),10-9,10-8 ,or 10-7mol/L DHT for 24 h; B: Quantitative RT-PCR analysis of mRNA extracted from primary cells treated with equivalent ethanol,10-9, 10-8, or 10-7 mol/L DHT for 0 h, 4 h, 8 h, 16 h, 1 d, 2 d, 3 d, 4 d, 5 d. DHT: Dihydrotestosterone.*P < 0.05 vs control group.n=3, x±s |
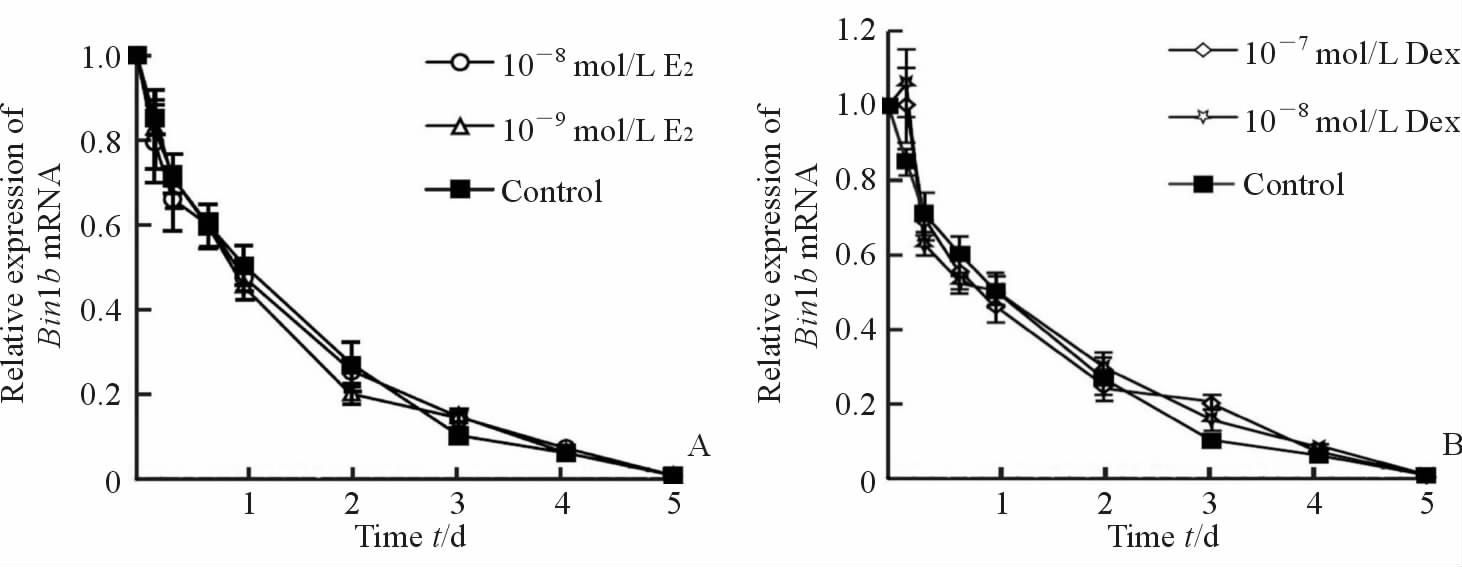
进一步观察不同浓度雌二醇(10-9mol/L、10-8mol/L,E2)和地塞米松(10-8mol/L、10-7mol/L,Dex)处理原代培养的附睾上皮细胞不同时间点(0、4、8、16 h,1、2、3、4、5 d)后Bin1b mRNA的表达。结果显示,不同浓度E2或Dex处理后的Bin1b mRNA的变化趋势与对照组相同,都随着培养时间的延长而进行性下降,且处理组在各个时间点与对照相比差异都无统计学意义(图 3A、3B)。
|
图 3 E2及Dex对原代培养的附睾头部上皮细胞中Bin1b mRNA表达的影响 Fig 3 Effect of E2 or Dex on Bin1b mRNA expression in primary cultured epididymal epithelial cells A: Quantitative RT-PCR analysis of mRNA extracted from primary cells treated with control (equivalent ethanol), 10-9 mol/L and 10-8 mol/L E2 for 0 h, 4 h, 8 h, 16 h, 1 d, 2 d, 3 d, 4 d and 5 d; B: Quantitative RT-PCR analysis of mRNA extracted from primary cells treated with equivalent ethanol, 10-8 mol/L and 10-7 mol/L Dex for 0 h, 4 h, 8 h, 16 h,1 d, 2 d, 3 d, 4 d, 5 d.E2: Estradiol; Dex: Dexamethasone.n=3, x±s |
在体外培养的附睾上皮细胞株中,很多附睾特异蛋白会发生表达缺失。本研究在进行大鼠附睾头部上皮细胞原代培养时也发现Bin1b mRNA的表达随着培养时间的增加不断减少,原代培养2 d时表达减少近50%,5 d后附睾上皮细胞中几乎检测不到Bin1b mRNA的表达。除Bin1b外,附睾头部特异性表达的β防御素家族成员Defb21的表达在原代培养的附睾上皮细胞中也随时间增加而减少;而另一个β防御素家族成员Defb29的表达在同样条件下没有表现出明显改变,始终维持比较恒定的水平,提示Bin1b和Defb21的表达可能属于诱导性表达,而Defb29的表达属于组成性表达。目前还不清楚体内哪些因素调节Bin1b的表达,寻找调节Bin1b生理性表达的分子将有助于更深入地了解附睾特异β防御素的表达调控机制。
附睾液中的雄激素主要是睾酮和DHT,它们在附睾中含量很高,其来源除了睾丸液和血循环外,一些研究认为附睾上皮也能合成和分泌雄激素,实验证明附睾上皮中有5α还原酶等与雄激素代谢有关的酶的表达[13, 14]。睾酮和DHT在附睾的发育和精子成熟方面发挥重要作用。已知雄性大鼠性成熟时,附睾中Bin1b的表达水平达峰值,并在整个性成熟期维持较高水平。此外有研究显示,给雄性大鼠实施双侧去势手术后,β防御素Defb21、24、30和36等基因的mRNA水平大幅下降,而补充外源性雄激素后,上述基因的表达很快恢复到术前水平[5]。近年来在不同种属中的研究均发现部分附睾特异性β防御素的表达受雄激素的调节[15, 16, 17]。这些结果提示在体内Bin1b的表达可能也受雄激素的调节。本研究观察了不同浓度DHT对原代培养的附睾头部上皮细胞中Bin1b表达的影响,结果发现,DHT能上调原代培养附睾上皮细胞中Bin1b的表达,其中10-9 mol/L DHT使Bin1b mRNA表达较对照细胞增加约37%,且10-8mol/L及10-7mol/L的DHT处理后Bin1b mRNA表达进一步增加。但是于原代附睾上皮细胞培养液中仅使用DHT处理并不能完全逆转Bin1b的时间依赖性表达减少,提示除了雄激素外,还存在其他能够上调Bin1b表达的因子。
文献报道,大、小鼠及人的成熟睾丸Leydig细胞和(或)精原细胞可分泌雌激素,使其在睾丸液中维持较高浓度,而睾丸和附睾中都有雌激素受体(estrogen receptor,ER)表达;雌激素在附睾精子成熟过程中发挥重要作用,ERα被敲除或被拮抗剂阻断后,附睾尾部精子数量减少、形态畸形[18, 19]。本研究采用不同浓度的E2处理原代培养的附睾上皮细胞,结果发现雌激素对Bin1b mRNA表达没有影响。此外,考虑到Bin1b是防御素家族成员,有抗菌作用并参与体内的天然免疫,而糖皮质激素是体内重要的免疫调节因子,因此我们还观察了Dex对原代培养附睾上皮细胞中Bin1b mRNA表达的影响,但结果显示Dex对Bin1b mRNA表达也没有明显影响。寻找维持体内Bin1b生理性表达的调节因子仍是今后要继续的工作。
综上所述,本实验发现雄激素能上调附睾上皮细胞中Bin1b表达,但是雌激素和糖皮质激素没有上述作用。以上发现有助于更深入地了解β防御素样附睾特异蛋白Bin1b的调节机制及其在精子成熟过程中的病理生理作用,并可能为附睾源性男性不育的防治提供药靶位点。
| [1] | Dacheux J L, Gatti J L, Dacheux F. Contribution of epididymal secretory proteins for spermatozoa maturation[J]. Microsc Res Tech, 2003, 61: 7-17. |
| [2] | Johnston D S, Turner T T, Finger J N, Owtscharuk T L, Kopf G S, Jelinsky S A. Identification of epididymis-specific transcripts in the mouse and rat by transcriptional profiling[J]. Asian J Androl, 2007, 9: 522-527. |
| [3] | Com E, Bourgeon F, Evrard B, Ganz T, Colleu D, Jegou B, et al. Expression of antimicrobial defensins in the male reproductive tract of rats, mice, and humans[J]. Biol Reprod, 2003, 68: 95-104. |
| [4] | Zaballos A, Villares R, Albar J P, Martinez A C, Marquez G. Identification on mouse chromosome 8 of new beta-defensin genes with regionally specific expression in the male reproductive organ[J]. J Biol Chem, 2004, 279: 12421-12426. |
| [5] | Yenugu S, Chintalgattu V, Wingard C J, Radhakrishnan Y, French F S, Hall S H. Identification, cloning and functional characterization of novel beta-defensins in the rat (Rattus norvegicus) [J]. Reprod Biol Endocrinol, 2006, 4: 7. |
| [6] | Jelinsky S A, Turner T T, Bang H J, Finger J N, Solarz M K, Wilson E, et al. The rat epididymal transcriptome: comparison of segmental gene expression in the rat and mouse epididymides[J]. Biol Reprod, 2007, 76: 561-570. |
| [7] | Johnson G P, Lloyd A T, O'Farrelly C, Meade K G, Fair S. Comparative genomic identification and expression profiling of a novel β-defensin gene cluster in the equine reproductive tract[J]. Reprod Fertil Dev, 2015 Apr 30. [Epub ahead of print]. |
| [8] | Dorin J R, Barratt C L. Importance of β-defensins in sperm function[J]. Mol Hum Reprod, 2014, 20:821-826. |
| [9] | Li P, Chan H C, He B, So S C, Chung Y W, Shang Q,et al. An antimicrobial peptide gene found in the male reproductive system of rats[J]. Science, 2001, 291:1783-1785. |
| [10] | Sun X J, Wang D N, Zhang W J, Wu X F. Expression of an antimicrobial peptide identified in the male reproductive system of rats[J]. Mol Biotechnol, 2004, 28:185-189. |
| [11] | Zhou C X, Zhang Y L, Xiao L, Zheng M, Leung K M, Chan M Y, et al. An epididymis-specific beta-defensin is important for the initiation of sperm maturation[J]. Nat Cell Biol, 2004, 6: 458-464. |
| [12] | Cao D M, Li Y D, Yang R, Wang Y, Zhou Y C, Diao H, et al. Lipopolysaccharide-induced epididymitis disrupts epididymal beta-defensin expression and inhibits sperm motility in rats[J]. Biol Reprod,2010, 83: 1064-1070. |
| [13] | Cooke G M, Robaire B. The effects of diethyl-4-methyl-3-oxo-4-aza-5 alpha-androstane-17 beta-carboxamide (4-MA) and (4R)-5,10-SECO-19-norpregna-4,5-diene-3,10,20-trione (SECO) on androgen biosynthesis in the rat testis and epididymis[J]. J Steroid Biochem,1986,24:877-886. |
| [14] | Henderson N A, Cooke G M, Robaire B. Effects of PNU157706, a dual 5alpha-reductase inhibitor, on gene expression in the rat epididymis[J]. J Endocrinol,2004,181:245-261. |
| [15] | Hu S G, Zou M, Yao G X, Ma W B, Zhu Q L, Li X Q, et al. Androgenic regulation of beta-defensins in the mouse epididymis[J]. Reprod Biol Endocrinol, 2014,12:76. |
| [16] | Ribeiro C M, Queiróz D B, Patrão M T, Denadai-Souza A, Romano R M, Silva E J, et al. Dynamic changes in the spatio-temporal expression of the β-defensin SPAG11C in the developing rat epididymis and its regulation by androgens[J]. Mol Cell Endocrinol, 2015, 404:141-150. |
| [17] | Pujianto D A, Loanda E, Sari P, Midoen Y H, Soeharso P. Sperm-associated antigen 11A is expressed exclusively in the principal cells of the mouse caput epididymis in an androgen-dependent manner[J]. Reprod Biol Endocrinol, 2013, 11:59. |
| [18] | Rommerts F F, Brinkman A O.Modulation of steroidogenic activities in testis Leydig cells[J]. Mol Cell Endocrinol,1981, 21:15-28. |
| [19] | Nitta H, Bunick D, Hess R A, Janulis L, Newton S C, Millette CF,et al. Germ cells of the mouse testisexpress P450 aromatase[J]. Endocrinology,1993, 132:1396-1401. |
 2016, Vol. 37
2016, Vol. 37


