2. 承德医学院研究生院, 承德 067000
2. Graduate School, Chengde Medical College, Chengde 067000, Hebei, China
RPMI1640(Gibco公司)、新生牛血清(杭州四季青生物工程材料有限公司)、荧光染料Hoechst33342(Sigma)、Ruxolitinib(瑞士诺华)、Cell Counting Kit-8(CCK-8,日本同仁化学研究所)、引物(北京赛百胜基因技术有限公司)、抗体(Santa Cruz 公司)、Caspase-Glo 3/7 检测试剂盒(Promeg,USA),Gen 5酶标仪(Bio-Tek公司),BD FACSCalibur流式细胞仪(BD 公司)。
1.2 细胞系及细胞培养人红白细胞白血病HEL细胞购自中国科学院上海生命科学研究院细胞资源中心。HEL细胞于孵育箱中培养,孵育箱条件为37℃、5%CO2。细胞培养液为加入10%胎牛血清的RPMI1640培养液。根据细胞生长状况,2~3 d换液1次,取对数生长期细胞进行实验。
1.3 实验分组将对数期细胞分为实验组和对照组,实验组根据加入Ruxolitinib的浓度不同分为1、5、10、50、100、500 nmol/L组。对照组为不加入Ruxolitinib药物。
1.4 CCK-8检测细胞活力收集对数生长期细胞,加入细胞悬液100 μL到96孔板,边缘孔用无菌水或磷酸缓冲盐溶液(phosphate buffer saline,PBS)填充,设置空白组及对照组,空白组加100 μL无细胞培养基及不同浓度Ruxolitinib,对照组加100 μL细胞不加Ruxolitinib,实验组及空白组分别加不同浓度Ruxolitinib,每组设5个平行孔,分别于0、24、48、72 h后加入CCK-8溶液10 μL,待2~ 4 h后酶标仪测定450 nm处光密度D450,按照公式:细胞活力(%)= 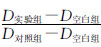 ,绘制细胞生长曲线。
,绘制细胞生长曲线。
分别取48 h后对照组及100 nmol/L Ruxolitinib处理组的HEL细胞,取100 μL细胞悬液,加入终浓度为10 μg/mL的Hoechst33342,避光染色15~20 min,取40 μL细胞悬液滴于载玻片,荧光显微镜下观察凋亡细胞形态。
1.6 流式细胞仪检测HEL细胞的线粒体膜电位变化收集不同浓度Ruxolitinib作用12、24 h的HEL细胞。PBS清洗2次,加入5 μg/mL罗丹明123,在37℃、5%CO2条件下作用30 min,流式细胞仪检测各处理组细胞荧光强度。
1.7 细胞Caspase-3/7蛋白活性检测选取不同浓度Ruxolitinib作用12、24 h后的HEL细胞各约5 000个,分别加入96孔板,每组3个复孔,同时将Caspase-Glo 3/7底物与缓冲液相混合,取100 μL加入孔板,混合孵育4 h,检测波长405 nm处的D值,计算细胞活化程度。
1.8 流式细胞仪检测细胞凋亡取对数生长期HEL细胞,在6孔板中接种3 mL细胞悬液,约含105个细胞,按照实验分组分别加入不同浓度Ruxolitinib,分别孵育0、24、48、72 h。收取细胞,0.5 mL PBS洗2次,120×g离心,弃去上清液;75%冰乙醇固定过夜,离心,弃上清;0.5 mL PBS洗1次,加入RNAase 1 mL,37℃恒温水浴30 min,120×g离心,弃上清;加入DNA抽提液1 mL,室温静置30 min,1 800×g离心5 min,弃上清。加入500 μL 0.1 mg/mL碘化丙啶(propidium iodide,PI)染液,置于4℃避光染色30 min,流式细胞仪检测。
1.9 RT-PCR检测JAK2 mRNA表达收集不同浓度Ruxolitinib作用48 h后的HEL细胞,TRIzol法提取各组细胞总RNA,电泳鉴定RNA纯度及含量。根据Vazyme HiScript 合成试剂盒反转录合成cDNA,反转录反应体系20 μL,包括细胞RNA 2 μg,50 U/μL RNasin 0.5 μL,50 μg/mL随机物1 μL,10 mol/L dNTP 2 μL,5×反转录反应缓冲液4 μL,M-MLV反转录酶200 U,余用焦碳酸二乙酯(diethypyrocarbonate,DEPC)处理水补足至20 μL。37℃反应60 min,95℃反应5 min 后终止反应。产物进行PCR扩增或分装稀释,放置于-20℃,保存时间不超过6个月。PCR反应体系20 μL,JAK2上游引物为5′-CAG CAA GTA TGA TGA GCA AGC TTT-3′,下游引物为5′-TGA ACC AGA ATA TTC TCG TCT CCA C-3′。内参基因β-actin上游引物为5′-CTG GCA CCA CAC CTT CTA CAA T-3 ′,下游引物为5′-AAT GTC ACG CAC GAT TTC CCG C-3′。JAK2扩增片段产物长度101 bp,β-actin扩增片段长度382 bp。取cDNA 2 μL 作为模板,建立20 μL反应体系。反应条件:94℃变性5 min,94℃变性45 s,60℃退火1 min,68℃延伸45 s,40个循环。扩增后的产物进行琼脂糖凝胶电泳,全自动凝胶成像仪下分析。
1.10 蛋白质印迹法检测p-JAK2、p-ERK、Bcl-2、Bim蛋白水平收集各组细胞,提取蛋白;根据蛋白定量结果分装蛋白,将分装好的蛋白置于沸水中煮沸变性5 min,配电泳分离胶、浓缩胶,蛋白上样,电泳使蛋白分离,转移至PVDF膜上,配5%脱脂奶粉,37℃烤箱中封闭2 h,封一抗,4℃过夜;Tris盐酸缓冲液洗膜,封二抗,37℃烤箱中2 h,化学发光液混合,应用Alpha Innotech 系统对PVDF膜进行扫描及图像分析。
1.11 统计学处理采用SPSS 19.00统计软件进行分析处理,所有数据均以 x±s 表示,两样本均数比较采用t检验,多组均数比较采用方差分析,组间两两比较选用q检验。检验水准(α)为0.05。
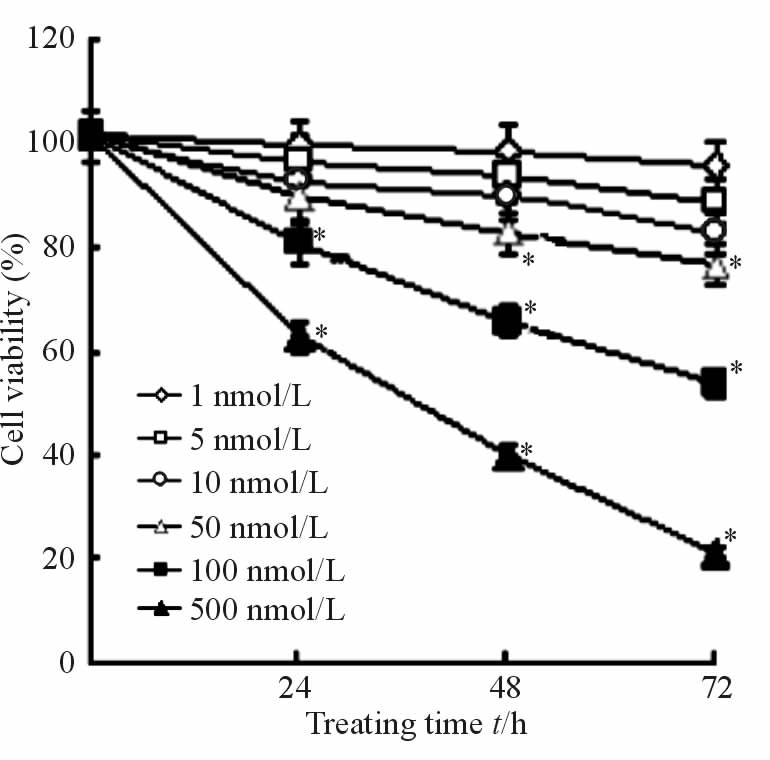
2 结 果 2.1 Ruxolitinib对HEL细胞活力的影响CCK-8结果显示:不同浓度的Ruxolitinib(1、5、10、50、100、500 nmol/L)作用HEL细胞后,随着时间延长细胞活力逐渐下降,Ruxolitinib作用48 h后,HEL细胞活力分别为(97.0±4.4)%、(92.0±3.9)%、(88.0±3.7)%、(81.0±3.1)%、(64.0±2.9)%、(38.0±2.2)%;随着Ruxolitinib药物浓度增大,HEL细胞活力下降,并呈时间依赖性,通过计算48 h Ruxolitinib IC50为283.47 nmol/L(图 1)。
|
图 1 CCK-8检测不同浓度Ruxolitinib作用不同时间的HEL细胞活力 Fig 1 HEL cell viability was detected by CCK-8 assay after treated with Ruxolitinib at different concentrations for different periods *P<0.05 vs 0 h. n=3, x±s |
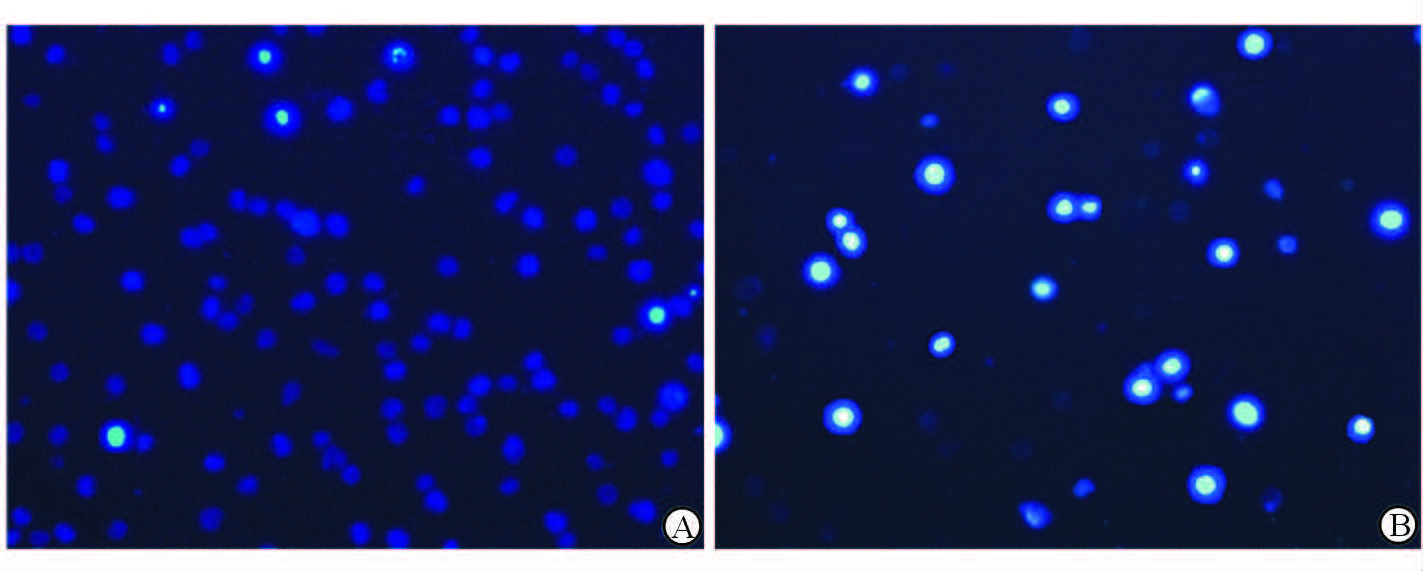
100 nmol/L Ruxolitinib作用HEL细胞48 h后,Hoechst33342染色对照组Hoechst着色为淡蓝色,细胞核内DNA分布均匀,核呈圆形或卵圆形,无固缩、变形(图 2A)。实验组Hoechst着色核由于浓集而呈亮蓝色,细胞出现凋亡,核固缩、变形(图 2B)。100 nmol/L Ruxolitinib组亮蓝色细胞[(49.21±1.80)%]较对照组[(10.02±1.40)%]增多(P<0.05)。
|
图 2 Hoechst33342荧光染色检测Ruxolitinib作用HEL细胞48 h后凋亡形态图 Fig 2 Apoptosis was detected by Hoechst33342 staining in HEL cells after treated with Ruxolitinib for 48 h A: Control group; B: 100 nmol/L Ruxolitinib treatment group |
Ruxolitinib作用HEL细胞不同时间(12及24 h)后,罗丹明123荧光强度在对照组HEL细胞内均最强,随着Ruxolitinib浓度的增加,罗丹明123荧光强度逐渐减弱,呈剂量依赖性降低(表 1)。
|
|
表 1 不同浓度Ruxolitinib作用12及24 h后HEL细胞内线粒体膜电位的变化 Tab 1 Mitochondrial membrane potential in HEL cells treated with different concentrations of Ruxolitinib for 12 or 24 h |
不同浓度Ruxolitinib干预HEL细胞12 、24 h后凋亡蛋白Caspase-3/7活性呈现剂量依赖性升高(P<0.01)。见表 2。
|
|
表 2 不同浓度Ruxolitinib作用HEL细胞12和24 h后凋亡蛋白Caspase-3和Caspase-7活性变化 Tab 2 Caspase-3 and -7 protein activity change of HEL cells after treated with different concentrations of Ruxolitinib for 12 or 24 h |
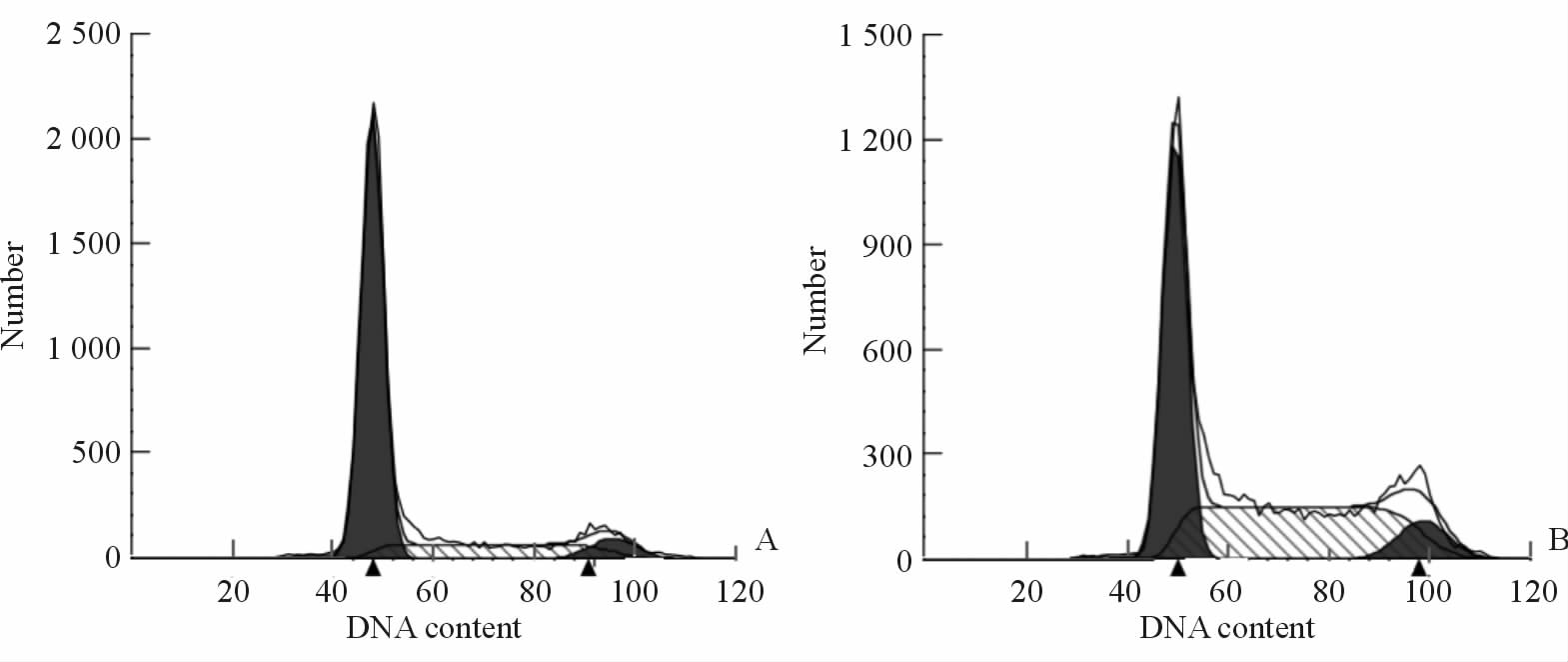
孵育0、24、48、72 h不同浓度下Ruxolitinib对HEL细胞周期的影响结果显示,随着 Ruxolitinib药物浓度的增加及作用时间的延长,G0/G1期细胞比率逐渐上升,G2/M期比率减少。100 nmol/L Ruxolitinib作用细胞48 h后,G0/G1期细胞比率[(73.1±3.6)%]明显高于对照组[(45.2±3.0)%]。见图 3、表 3。
|
图 3 流式细胞术检测Ruxolitinib对HEL细胞周期的影响 Fig 3 Cell cycle was detected by flow cytometry after HEL cells were treated with Ruxolitinib A: Control group; B: 100 nmol/L Ruxolitinib treatment group |
|
|
表 3 不同浓度Ruxolitinib对HEL细胞周期的影响结果 Tab 3 Changes of HEL cell cycle after treated with different concentrations of Ruxolitinib |
不同浓度Ruxolitinib作用HEL细胞48 h后,实验组JAK2 mRNA表达比对照组减低,并随着药物浓度的增加呈逐渐减低趋势(图 4),对照组和5、10、50、100、500 nmol/L Ruxolitinib组JAK2 mRNA相对表达量分别为(0.98±0.09)、(0.83±0.07)、(0.65±0.06)、(0.52±0.04)、(0.32±0.03)、(0.12±0.01)。
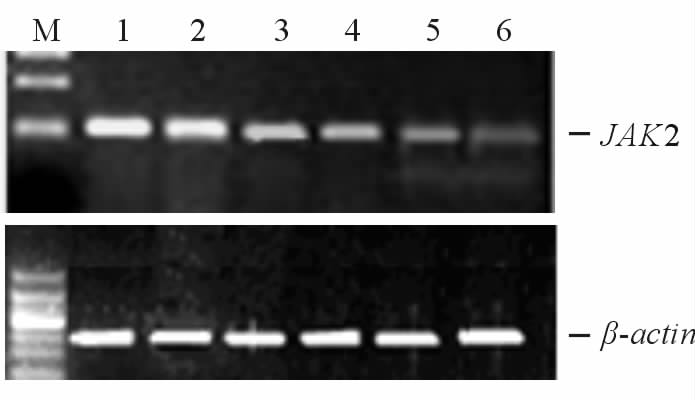
|
图 4 RT-PCR检测不同组细胞JAK2 mRNA表达结果 Fig 4 mRNA level of JAK2 was measured by RT-PCR in each group M: Marker;1: Control group; 2: 5 nmol/L Ruxolitinib; 3: 10 nmol/L Ruxolitinib; 4: 50 nmol/L Ruxolitinib; 5: 100 nmol/L Ruxolitinib; 6: 500 nmol/L Ruxolitinib |
与对照组(0 h)相比,100 nmol/L Ruxolitinib作用HEL细胞0、24、48 h后,HEL细胞p-JAK2、p-ERK、Bcl-2蛋白表达逐渐下降,Bim蛋白表达增加(P<0.01,图 5)。
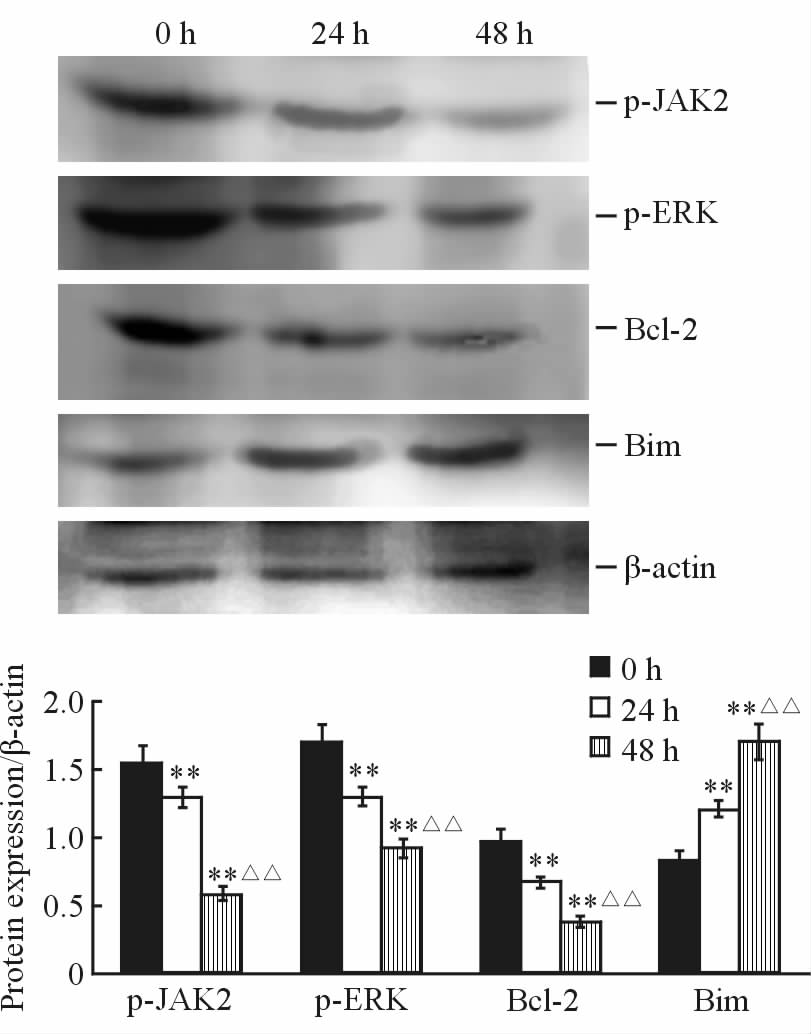
|
图 5 Ruxolitinib 作用HEL细胞后p-JAK2、p-ERK、Bcl-2及Bim蛋白表达变化 Fig 5 Changes of p-JAK2, p-ERK, Bcl-2, and Bim protein expressions in HEL cells after treated with 100 nmol/L Ruxolitinib **P<0.01 vs 0 h group; △△P<0.01 vs 24 h group. n=3, x±s |
JAK-STAT转导通路在细胞生长、分化、免疫功能和造血中发挥重要生理病理作用。JAK2-STAT5信号通路在多种组织及细胞系中异常表达和活化,并与肿瘤的增殖、分化、凋亡、血管新生及肿瘤侵袭有密切关系[1]。骨髓增殖性肿瘤患者大多存在JAK2 V617F突变,此突变作为一种组成性激活酪酸激酶,在缺乏细胞因子的情况下自发性激活JAK2-STAT5信号通路[4, 5]。HEL细胞是JAK2 V617F突变阳性人红白血病细胞,JAK2 V617F突变可使JAK2-STAT5信号通路活化,进而使细胞异常表达。Oku等[6]通过干扰RNA(siRNA)阻断JAK2-STAT5,发现JAK2 V617F突变的骨髓增殖性肿瘤细胞增殖明显受到抑制,认为JAK2 V617F具有促进细胞增殖及抑制凋亡作用。
Ruxolitinib是选择性JAK1/2激酶抑制剂,现已应用于临床,口服单剂量为每日5~200 mg,能够被迅速吸收,在1~2 h 内达到最大血药浓度[7]。其通过抑制JAK/STAT的磷酸化发挥作用。在JAK2 V617F突变阳性的骨髓增殖性肿瘤动物模型中,Ruxolitinib可明显逆转脾肿大,减少循环中炎性细胞因子的水平,优先消除肿瘤细胞,显著延长生存期而未抑制骨髓及免疫功能[8, 9]。一项在欧洲九国进行的开放、随机化COMFORT-Ⅱ期研究结果显示,Ruxolitinib在治疗48周后,28.5%患者脾脏体积至少缩小至原体积的35%[10]。Quintás-Cardama等[11]研究显示,不同浓度Ruxolitinib 能剂量依赖性抑制JAK2 V617F阳性Ba/F3细胞活力,其IC50为127 nmol/L。本研究结果显示Ruxolitinib作用于人JAK2 V617F阳性红白血病HEL细胞后,细胞活力随着时间及浓度的加大而下降,48 h IC50 为283.47 nmol/L。荧光染色显示Ruxolitinib作用HEL细胞后,细胞形态出现明显凋亡改变。G0/G1期细胞呈剂量依赖性增加,G2/M期细胞减少,考虑Ruxolitinib诱导HEL细胞G0/G1期周期阻滞。
在细胞凋亡过程中,线粒体膜渗透性转换通道开放,线粒体膜电位减低,释放细胞色素C,导致凋亡蛋白Caspase-3的激活,从而诱导细胞凋亡[12]。线粒体膜电位在细胞凋亡早期就开始下降,并早于DNA片段化。本实验结果表明,1~500 nmol/L的Ruxolitinib作用HEL细胞12、24 h,线粒体膜电位水平进行性降低,呈剂量依赖性减低。Caspase-3/7蛋白活性逐渐增加,从而诱导细胞凋亡。
BCL-2家族是细胞凋亡通路中重要的调节蛋白,根据功能可以分为抗凋亡BCL-2亚家族和促凋亡BAX 亚家族以及促凋亡BH3亚家族(也称BH3-only蛋白)。Bim作为BH3亚家族成员之一,在细胞凋亡的启动和调节上具有重要的作用,并已被证实与JAK2信号通路有关[13],可通过结合Bcl-2蛋白促进凋亡Bax和Bak样蛋白释放,诱导细胞凋亡。通过siRNA抑制Bim基因后,细胞凋亡明显减少。Bim受多种刺激调节,包括PI3K-AKT-FOXO-3A和ERK 1/2的MAP激酶途径,这两条通路均可被JAK2-STAT5活化[14, 15]。本研究结果显示,1~500 nmol/L Ruxolitinib 作用于HEL细胞48 h后,JAK2 mRNA及p-JAK2蛋白表达水平呈剂量依赖性减低,p-ERK蛋白表达亦降低,Bcl-2活性减低,同时Bim表达上调,表明Ruxolitinib通过抑制JAK2通路阻断ERK 1/2,抑制Bim磷酸化,Bim蛋白降解减少,Bim活化增强,进而抑制细胞增殖,诱导肿瘤细胞凋亡[14, 16, 17]。
综上所述,Ruxolitinib可通过抑制JAK2及ERK 1/2的MAPK激酶途径抑制人红白血病HEL细胞增殖及促进肿瘤细胞凋亡,这为Ruxolitinib治疗骨髓增殖性肿瘤及白血病提供了实验依据。
| [1] | 成志勇, 黄月华, 梁文同, 王宝艳, 王亚丽, 孙雪珊, 等. 骨髓增殖性肿瘤中JAK2 V617F 突变与Ⅰ型细胞因子受体相关性研究[J].中国全科杂志,2012, 15: 1019-1022. |
| [2] | Constantinescu S N, Girardot M, Pecquet C. Mining for JAK-STAT mutations in cancer[J]. Trends Biochem Sci, 2008, 33: 122-131. |
| [3] | Chase A, Bryant C, Score J, Haferlach C, Grossmann V, Schwaab J, et al. Ruxolitinib as potential targeted therapy for patients with JAK2 rearrangements[J]. Haematologica, 2013, 98: 404-408. |
| [4] | 郭慧梅, 潘 崚, 贺建辉, 化罗明, 曹志新, 薛 蕾. 骨髓增殖性肿瘤患者血栓栓塞的相关因素[J]. 肿瘤防治研究, 2013, 40: 958-960. |
| [5] | 成志勇, 李士辉, 杨 琳, 黄月华, 潘 崚. 干扰素α对JAK2 V617阳性的骨髓增殖性疾病的影响[J]. 实用肿瘤杂志, 2008, 23: 318-321. |
| [6] | Oku S, Takenaka K, Kuriyama T, Shide K, Kumano T, Kikushige Y, et al. JAK2 V617F uses distinct signalling pathways to induce cell proliferation and neutrophil activation[J]. Br J Haematol, 2010, 150: 334-344. |
| [7] | Shi J G, Chen X, McGee R F, Landman R R, Emm T, Lo Y, et al. The Pharmacokinetics,pharmacodynamics,and safety of orally dosed INCB018424 phosphate in healthy volunteers[J].J Clin Pharmacol, 2011, 51: 1644-1654. |
| [8] | Cervantes F, Vannucchi A M, Kiladjian J J, Al-Ali H K, Sirulnik A, Stalbovskaya V, et al. Three-year efficacy, safety, and survival findings from COMFORT-Ⅱ, a phase 3 study comparing ruxolitinib with best available therapy for myelofibrosis[J]. Blood, 2013, 122: 4047-4053. |
| [9] | Oritani K, Okamoto S, Tauchi T, Saito S, Ohishi K, Handa H, et al. A multinational,open-label, phase 2 study ruxolitinib in Asian patients with myelofibrosis: Japanese subsetanalysisi[J]. Int J Hematol, 2015, 101: 295-304. |
| [10] | Harrison C, Kiladjian J J, Al-Ali H K,Gisslinger H, Waltzman R, Stalbovskaya V, et al.JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis[J].N Engl J Med, 2012, 366: 787-798. |
| [11] | Quintás-Cardama A, Vaddi K, Liu P, Manshouri T, Li J, Scherle P A, et al. Preclinical characterization of the selective JAK1/2 inhibit or INCB018424: therapeutic implications for the treatment of myeloproliferative neoplasms[J]. Blood, 2010, 115: 3109-3117. |
| [12] | Wang Y, Yang J, Chen L, Wang J, Wang Y, Luo J, et al. Artesunate induces apoptosis through caspase-dependent and independent mitochondrial pathways in human myelodysplastic syndrome SKM-1 cells[J]. Chem Biol Interact, 2014, 219: 28-36. |
| [13] | Abutin R M, Chen J, Lung T K, Lloyd J A, Sawyer S T, Harada H. Erythropoietin induced phosphorylation/degradation of BIM contributes to survival of erythroid cells[J]. Exp Hematol, 2009, 37: 151-158. |
| [14] | Will B, Siddiqi T, Jordà M A, Shimamura T, Luptakova K, Staber P B, et al. Apoptosis induced by JAK2 inhibition is mediated by Bim and enhanced by the BH3 mimetic ABT-737 in JAK2 mutant human erythroid cells[J]. Blood, 2010, 115: 2901-2909. |
| [15] | Rubert J, Qian Z, Andraos R, Guthy D A, Radimerski T. Bim and Mcl-1 exert key roles in regulating JAK2V617F cell survival[J]. BMC Cancer, 2011, 11: 24. |
| [16] | Szymańska J, Smolewski P, Majchrzak A, Cebula-Obrzut B, Chojnowski K, Treliński J. Pro-apoptotic activity of ruxolitinib alone and in combination with hydroxyurea, busulphan,and PI3K/mTOR inhibitors in JAK2-positive human cell lines[J]. Adv Clin Exp Med, 2015, 24: 195-202. |
| [17] | Barrio S, Gallardo M, Arenas A, Ayala R, Rapado I, Rueda D, et al. Inhibition of related JAK/STAT pathways with molecular targeted drugs shows strong synergy with ruxolitinib inchronic myeloproliferative neoplasm[J]. Br J Haematol, 2013, 161: 667-676. |
 2016, Vol. 37
2016, Vol. 37


