脑卒中是威胁人类生命和健康的三大疾病之一,也是全球人口死亡和致残的首要原因。针刺作为中国传统的治疗脑卒中的手段,已被证实有确切的临床疗效[1],但其机制还需要更多的深入研究。脑卒中后运动功能的恢复与神经系统发育有关,其中轴突导向因子对神经网络的形成起到了重要的作用[2]。目前已明确的轴突导向因子包括Netrin 家族、Slit家族、Semaphorin 家族和Ephrin 家族[3, 4, 5, 6, 7]。近年来关于Slit家族功能的研究已成为国内外非常热门的研究领域之一,Slit2主要由中枢神经中线胶质细胞产生,是保证发育生长锥正确导向和神经元迁移的重要因素,Slit2-Robo1 GTP酶激活蛋白(SrGAP)是利用酵母双杂交鉴定出来的Slit2-Robo信号通路中的重要分子,影响细胞骨架蛋白、肌动蛋白在细胞内的不对称分布,最终导致神经细胞迁移和神经元轴突伸展方向的变化[8, 9]。本实验通过制造大鼠局灶性脑梗死模型,观察脑梗死后Slit2和SrGAP1的表达以及电针对其表达的影响,探讨电针对神经的可塑性。
1 材料和方法 1.1 实验动物及分组成年健康雄性SD大鼠60只[动物许可证号:SYXK(渝)2012-0001],SPF级,体质量约250~350 g,由重庆医科大学动物中心提供,随机分为模型组(n=30)和电针组(n=30),两组大鼠根据针灸治疗时间又分为0 d(n=10)、7 d(n=10)、14 d(n=10)三个亚组。手术过程中大鼠死亡率为26%,补充大鼠16只。实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的关于善待实验动物的指导性意见。
1.2 试剂和仪器Slit2抗体(0.1 mL)和SrGAP1抗体(0.2 mL)购自北京博奥森生物技术有限公司;免疫荧光二抗Dylight购自Abbkine公司;蛋白质印迹二抗购自康为世纪有限公司;其余实验试剂均由碧云天生物技术研究所提供。
1.3 大鼠局灶性脑梗死模型制备及神经功能评分术前12 h大鼠禁食不禁水,参照Longa等[10]以线栓法制备大鼠大脑中动脉缺血再灌注模型。1.5 h后进行再灌注处理,待大鼠术后清醒后参照神经功能(modified neurological severity score,mNSS)评分标准进行评分,分别从运动、感觉、反射和平衡4个方面评估,总计0~18分,分值与神经功能缺损程度呈正比,正常大鼠0分。各组在0、7、14 d分别进行一次神经行为学评分。
1.4 电针方法将大鼠置于自制容器固定,在功能障碍侧选取1寸毫针刺激,电针组大鼠针刺“足三里”“曲池”,模型组大鼠在自制容器中固定30 min。使用“华佗牌”10号1寸毫针,穴位定位依据文献[11],“足三里”直刺3 mm、“曲池”直刺5 mm,均连接华佗牌sdz-Ⅱ型电子针疗仪进行电针治疗,刺激参数为疏密波,频率2 Hz,电流1 mA,留针30 min。
1.5 尼氏染色观察组织形态各组随机抽取5只大鼠,用3.5%水合氯醛(1 mL/100 g体质量)进行麻醉,仰卧固定,沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,充分暴露心脏及主动脉,将灌注针插入心室并送至主动脉内,剪开右心耳,先灌注200 mL生理盐水,然后开始灌注300 mL 4%多聚甲醛溶液固定液,灌注后取脑,取出脑后在4%多聚甲醛溶液固定24 h。然后放入4℃冰箱冰冻10 min后,切掉多余组织,在右侧梗死灶区进行组织切片,每个标本切片10张,每片厚约10 mm,保存在4℃冰箱。每组取5张切片留置蒸馏水中2 min,将玻片放入湿盒,湿盒置于55℃的水浴箱中,每张玻片滴5~10 μL尼氏染色液,以覆盖组织为准,染色7 min后在蒸馏水中洗涤2次(每次数秒钟即可),进行封片,在显微镜下观察。
1.6 免疫荧光检测Slit2和SrGAP1蛋白表达将已切好的玻片放到PBS液中,微波炉高温加热2 min进行抗原修复,取出后降至室温,用PBS液洗3次×5 min,放入湿盒,滴山羊血清孵育30 min,然后倒掉多余的山羊血清,滴Slit2和SrGAP1一抗,稀释比例均为1∶50,4℃ 孵 育 过 夜(17~21 h),次日,将湿盒放至37℃烤箱复温1.5 h,再用PBS液漂洗3次×5 min,然后避光操作,滴二抗,稀释比例1∶100,放至37℃烤箱孵育1 h,PBS液漂洗3次×5 min,滴入DAPI,PBS液漂洗3次×5 min,滴加少许甘油原液,盖上盖玻片在荧光显微镜下观察。
1.7 蛋白质印迹法定量检测Slit2和SrGAP1表达提取组织蛋白,蛋白浓度为36.58 μg/μL。灌制聚丙烯凝胶,6%分离胶,4%浓缩胶,上样量150 μg;然后开始电泳,电压为80 V、120 V;取出凝胶,和相同大小的聚偏二氟乙烯(PVDF)膜置于3层滤纸中间进行转膜,电流大小为250 mA约150 min(相对分子质量×1.5 )。取出PVDF膜,放入5%的脱脂奶粉中封闭;加I抗体(1∶100稀释,用0.01 mol/L PBT配制),4℃冰箱过夜;0.01 mol/L PBST洗15 min×3次;加二抗(1∶6 000稀释,用0.01 mol/L PBST配制)放置于37℃恒温箱中1 h;0.01 mol/L PBST洗15 min×3次;将PVDF置于化学发光试剂中增强反应3 min;在暗室中使X光片曝光,常规方法显影、定影,并扫入凝胶成像系统进行图像分析(Bio-Rad Gel Doc 2000),计算光密度值(D值),重复3次。以GAPDH为内参,使用Quantity One4.6(Bio-Rad)图像分析软件进行结果分析。
1.8 统计学处理采用SPSS 19.0 统计软件进行数据处理,所有数据经过方差齐性检验和正态性检验,实验数据用x±s 表示,资料进行配对方差分析t检验。若总体均数不等或不全相等时,进行LSD-t检验,检验水准(α)为0.05。
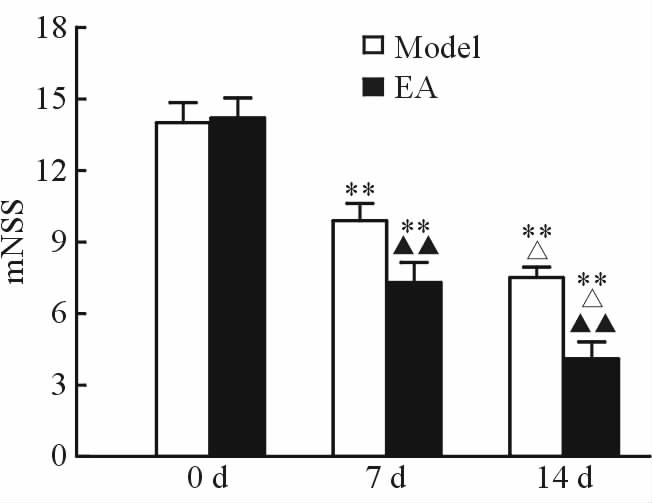
2 结 果 2.1 神经功能评分术后各组mNSS评分结果见图 1,0 d时电针组与模型组相比差异无统计学意义(P>0.05),7、14 d时电针组低于模型组(P<0.01)。0 d两组评分高于7 d组(P<0.01),7 d两组评分高于14 d组(P<0.05)。
|
图 1 各组大鼠神经行为学评分比较 Fig 1 Comparison mNSS score of rats in each group EA: Electro-acupuncture; mNSS: Modified neurological severity score. **P<0.01 vs 0 d of same group;△P<0.05 vs 7 d of same group; ▲▲P<0.01 vs model group at same time. n=10, x±s |
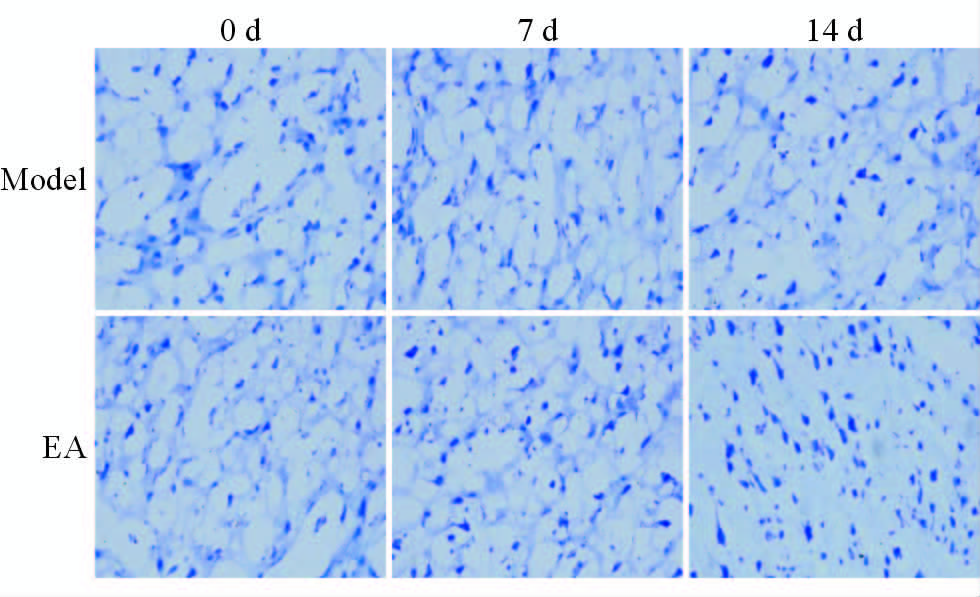
0 d时电针组与模型组相比无太大变化,均有尼氏体数量少,排列紊乱,伴有大脑水肿。7 d时,与模型组相比,电针组尼氏体明显增多,但排列紊乱,水肿减轻。14 d时,与模型组相比,电针组尼氏体增多,排列整齐。0、7、14 d模型组组内相比,尼氏体随时间延长而增多,但排列紊乱。14 d电针组与7 d电针组相比,尼氏体数量无太大变化,但排列整齐(图 2)。
|
图 2 不同缺血时间点尼氏体的比较 Fig 2 Comparison of nissl bodies at different ischemic time points between the two groups EA: Electro-acupuncture. Original magnification: ×400 |
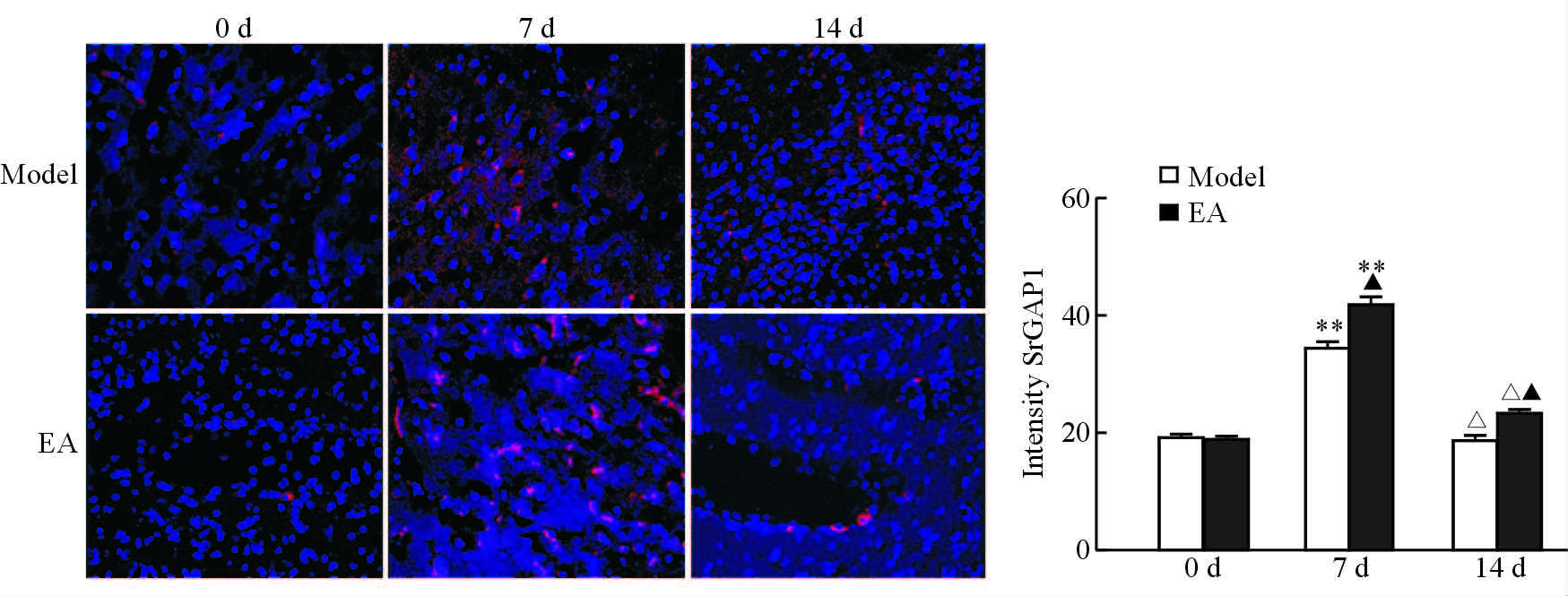
在400倍荧光共聚焦显微镜下可见,0 d时电针组与模型组相比,大鼠Slit2、SrGAP1荧光强度差异无统计学意义(P>0.05),7、14 d时电针组荧光强度高于模型组(P<0.05);0、14 d时模型组荧光强度低于7 d模型组(P<0.01,P<0.05),0、14 d电针组荧光强度亦低于7 d电针组(P<0.05)。如图 3、4。

|
图 3 不同缺血时间点各组大鼠皮质Slit2荧光强度比较 Fig 3 Comparison of rat cortex Slit2 fluorescence intensities at different ischemic time points between different groups EA: Electro-acupuncture. Original magnification: ×400. **P<0.01 vs 0 d of same group; △P<0.05 vs 7 d of same group; ▲P<0.05 vs model group at same time. n=5, x±s |
|
图 4 不同缺血时间点各组大鼠皮质SrGAP1荧光强度比较 Fig 4 Comparison of rat cortex SrGAP1 fluorescence intensities at different ischemic time points between different groups EA: Electro-acupuncture. Original magnification: ×400. **P<0.01 vs 0 d of same group; △P<0.05 vs 7 d of same group; ▲P<0.05 vs model group at same time. n=5, x±s |
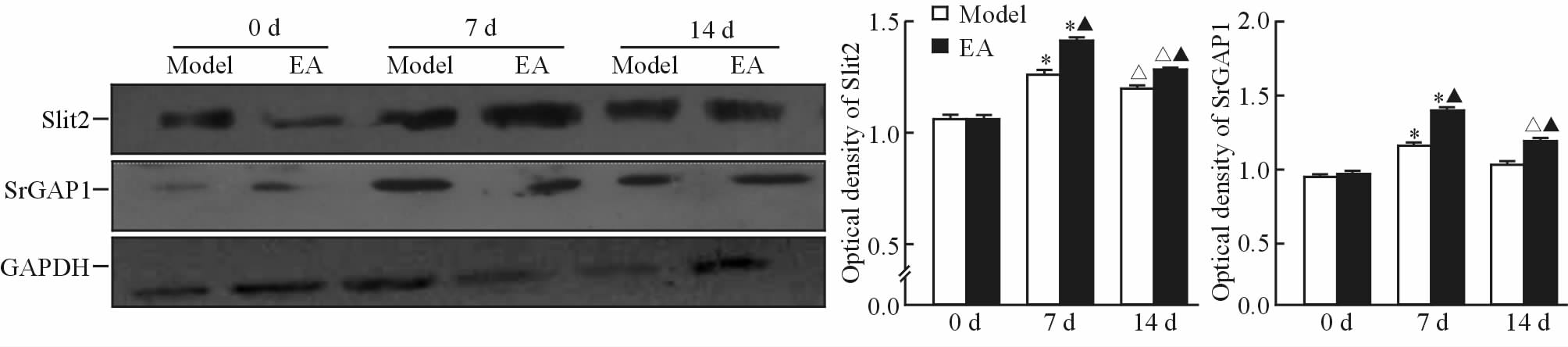
0 d时电针组与模型组相比,大鼠Slit2、SrGAP1灰度值比值差异无统计学意义(P>0.05),7、14 d时电针组灰度值比值高于模型组(P<0.05);0、14 d模型组灰度值比值低于7 d模型组(均P<0.05),0、14 d电针组灰度值比值亦低于7 d电针组(均P<0.05),见图 5。
|
图 5 不同缺血时间点各组大鼠皮质Slit2和SrGAP1蛋白表达比较 Fig 5 Comparison of rat cortex Slit2 and SrGAP1 protein expression at different ischemic time points between different groups EA: Electro-acupuncture. *P<0.05 vs 0 d of same group; △P<0.05 vs 7 d of same group; ▲P<0.05 vs model group at same time. n=5, x±s |
在中枢神经中,轴突导向分子对神经网络的形成具有重要的作用,其中最主要的轴突导向分子为Slit2/Robo1[12],Slit2主要在少突胶质细胞中表达,在中枢神经系统损伤后可以促进轴突再生,抑制星形胶质细胞增生,减少病变及细胞凋亡,增强血管生成和细胞髓鞘形成[13, 14],Slit2在发育的结构中沿着突起的路径高度有序地表达,控制生长锥沿特定路线向前生长,促使轴突末梢能精确地与相应的靶形成突触联系[15, 16, 17, 18, 19]。SrGAPs是Slit2-Robo1下游信号通路中的一组重要的RhoGAP分子,在哺乳动物中SrGAPs主要有SrGAP1、SrGAP2、SrGAP3三个成员。SrGAP1高度表达于中枢神经系统,在神经系统发育过程中维持高水平表达,特别在树突发育早期起关键作用[9, 20],它可以调控细胞的粘附、运动和极化,调节树突生长,介导基因转录调节,诱导凋亡等[21, 22, 23]。 在局灶性脑梗死后,SrGAP1与Robo1受体的胞内域结合,特异下调Cdc42活性影响神经元迁移[8],促使肌动蛋白解聚,肌动蛋白在细胞内的不对称分布最终引起神经细胞的迁移和神经元轴突伸展方向的变化,促进轴突再生[24, 25]。
本实验研究结果显示在造模成功0 d后,电针组与模型组大鼠的神经功能缺损无显著区别;随着造模成功时间的延长,模型组大鼠的神经功能评分减少,表明大鼠自身免疫功能会促进损伤恢复;但经电针刺激治疗后电针组与模型组相比可见其神经功能评分减少,表明电针具有促进脑卒中神经恢复的作用。免疫荧光、蛋白质印迹结果显示,0 d时电针组和模型组Slit2、SrGAP1分子均低表达,7、14 d时,Slit2、SrGAP1分子表达均升高,且电针组高于模型组,说明电针刺激可以促进Slit2、SrGAP1高表达且可以延长其高表达的时间,促进SrGAP1与Robo1的结合,改善神经功能缺损症状,抑制神经细胞的凋亡,促进脑卒中后期恢复,这可能是电针促进神经功能恢复的生物学机制之一。
电针在局灶性脑梗死后可以通过影响炎症反应、血管收缩和氧自由基生成等多种途径发挥作用,有效减轻脑缺血再灌注后大鼠缺血侧脑皮质损伤,改善受损脑组织结构紊乱及水肿程度,促进血管新生,对受损区域微血管起到保护作用[26, 27, 28]。电针的作用与选穴密切相关,查阅《中西医结合杂志》《中医杂志》《针刺研究》《中国针灸》和《北京中医药大学学报》5本中医类核心期刊2009~2015年关于针灸治疗中风的所有临床和实验文献,排在前10的穴位引用结果是:百会穴引用67次、足三里57次、曲池37次,三阴交27次、合谷24次、内关18次、环跳12次、太冲11次、肩髃9次、外关8次。本实验选用“曲池”和“足三里”穴位,不仅因为其在临床和基础研究中被广泛使用,而且《内经》中指出“治萎独取阳明”,并且查阅多篇文献发现:“足三里”“曲池”能减少脑梗塞面积并对梗死边缘区神经细胞呈一定的保护作用[29]。电针“足三里”“曲池”穴可改善神经功能缺损症状,抑制神经细胞的凋亡,起到保护脑的作用[30]。
虽然电针可以促进Slit2、SrGAP1高表达和减轻大鼠行为学症状,但是目前电针促进脑卒中恢复的机制尚不清楚,并且中枢神经系统损伤是由多个因子多条通路参与的复杂过程,因此单纯的Slit-Robo-SrGAP1通路激活并不能达到减轻缺血损伤和促进神经再生的满意效果。Slits-Robo及其下游分子的相互作用机制需要进一步深入研究,如研究Slits和Robos在中枢神经系统中的分布、浓度梯度和运动途径,或Slits-Robo的协同受体Abelson、Ca2+、miR-218、Single-minded、Irx4和Midline与LRR-1至LRR-4结构域结合后的作用。这些研究将带领我们进一步探讨脑梗死后slit2-Robo与其下游分子的相互关系,揭示其神经可塑性的生物学机制。
| [1] | 朱广旗,黄思仪.醒脑阴阳透刺法对急性脑梗死患者血清中Ca2+的影响[J].中国中医急症,2011,20:9-11. |
| [2] | Dickson B J,Senti K A.Axon guidance:growth cones make an unexpected turn[J].Curr Biol,2002,12:218-220. |
| [3] | Tessier-Lavigne M,Goodman C S.The molecular biology of axon guidance[J].Science,1996,274:1123-1133. |
| [4] | Wu W,Wong K,Chen J H, Jiang Z H,Dupuis S,Wu J Y.et al.Directional guidance of neuronal migration in the olfactory system by the protein slit[J].Nature,1999,400:331-336. |
| [5] | Pircher A, Wellbrock J, Fiedler W, Heidegger I, Gunsilius E, Hilbe W.New antiangiogenic strategies beyond inhibition of vascular endothelial growth factor with special focus on axon guidance molecules[J].Oncology,2014,86:46-52. |
| [6] | Refai O, Rohs P, Mains P E, Gaudet J. Extension of the Caenorhabditis elegans Pharyngeal M1 neuron axon is regulated by multiple mechanisms[J].G3 (Bethesda),2013,3:2015-2029. |
| [7] | Yaron A, Zheng B.Navigating their way to the clinic:emerging roles for axon guidance molecules in neuroles in neurological disorders and injury[J].Dev Neurobiol,2007,67:1216-1231. |
| [8] | Ip B K, Bayatti N, Howard N J, Lindsay S, Clowry G J.The corticofugal neuron-associated genes ROBO1,SRGAP1,and CTIP2 exhibit an anterior to posterior gradient of expression in early fetal human neocortex development[J].Cereb Cortex,2011,21:1395-1407. |
| [9] | Wong K, Ren X R, Huang Y Z, Xie Y, Liu G, Saito H, et al.Signal transduction in neuronal migration:roles of GTPase activating proteins and the small GTPase Cdc42 in the Slit-Robo pathway[J].Cell,2001,107:209-221. |
| [10] | Longa E Z, Weinstein P R, Carlson S, Cummins R.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20: 84-91. |
| [11] | 方宗畴.实验大鼠针灸俞穴图谱及针刺手法[J].南京铁道医学院学报,1993,12:19-21. |
| [12] | Marillat V, Cases O, Nguyen-Ba-Charvet K T, Tessier-Lavigne M, Sotelo C, Chédotal A.Spatiotemporal expression patterns of slit and robo genes in the rat brain[ J].J Comp Neurol,2002,442:110-155. |
| [13] | Kaneko S, Iwanami A, Nakamura M, Kishino A, Kikuchi K, Shibata S, et al.A selective Sema1A inhibitor enhances regenerative responses and functional recovery of the injured spinal cord[J].Nat Med, 2006,12:1380-1389. |
| [14] | Zheng B,Lee J K,Xie F.Genetic mouse models for studying inhibitors of spinal axon regeneration[J].Trends Neurosci,2006,29:640-646. |
| [15] | Piper M,Georgas K,Yamada T,Little M.Slit proteins bind Robo receptors and have an evolutionarily conserved role in repulsive axon guidance[J].Cell,1999,96:795-806. |
| [16] | Rothberg J M,Jacobs J R,Goodman C S,Artavanis-Tsakonas S.Slit:an extracellular protein necessary for development of midline glia and commissural axon pathways contains both EGF and LRR domains[J].Genes,1990,4:2169-2187. |
| [17] | Werbowetski-Ogilvie T E, Seyed Sadr M, Jabado N, Angers-Loustau A, Agar N Y, Wu J, et al.Inhibition of medulloblastoma cell invasion by Slit[J].Oncogene,2006,25:5103-5112. |
| [18] | McCormack M L, Goddard M,Guénard V, Aebischer P.Comparison of dorsal and ventral spinal root regeneration through semipermeable guidance channels[J].J Comp Neurol,1991,313:449-456. |
| [19] | Simpson J H, Kidd T, Bland K S, Goodman C S.Short-range and long-range guidance by slit and its Robo receptors.Robo and Robo2 play distinct roles in midline guidance[J].Neuron,2000,28:753-766. |
| [20] | Li X,Chen Y,Liu Y,Gao J,Gao F,Bartlam M,et al.Structural basis of Robo proline-rich motif recognition by the srGAP1 Src homology 3 domain in the Slit-Robo signaling pathway[J].Biol Chem, 2006,281:28430-28437. |
| [21] | Coutinho-Budd J, Ghukasyan V, Zylka M J, Polleux F.The F-BAR domains from srGAP1,srGAP2 and srGAP3 regulate membrane deformation differently[J].J Cell Sci,2012,125(Pt 14):3390-3401. |
| [22] | Ye B Q, Geng Z H, Ma L, Geng J G.Slit2 regulates attractive eosinophil and repulsive neutrophil chemotaxis through differential srGAP1expression during lung inflammation[J].J Immunol,2010,185:6294-6305. |
| [23] | Yao Q,Jin W L,Wang Y,Ju G.Regulated shuttling of Slit-Robo-GTPase activating proteins between nucleus and cytoplasm during brain development[J].Cell Mol Neurobiol,2008,28:205-221. |
| [24] | Yamazaki D,Itoh T,Miki H,Takenawa T.srGAP1 regulates lamellipodial dynamics and cell migratory behavior by modulating Rac1 activity[J].Mol Biol Cell,2013,24:3393-3405. |
| [25] | He H,Bronisz A,Liyanarachchi S,Nagy R,Li W,Huang Y,et al.SRGAP1 is a candidate gene for papillary thyroid carcinoma susceptibility[J].J Clin Endocrinol Metab,2013,98:E973-E980. |
| [26] | 张晓明.电针促进局灶性脑缺血大鼠脑内血管新生并减轻神经元损伤的研究[D].武汉:湖北中医药大学,2012. |
| [27] | 张珊珊,罗 勇,武 磊.PI3K/AKT通路在电针促进局灶脑缺血再灌注大鼠脑内血管再生中的作用[J]. 第三军医大学学报,2010,23: 2488-2491. |
| [28] | 王俊英.电针镇痛的累积效应与海马神经元可塑性及胞内MAPK/ERK信号通路活动关系分析[D].北京:中国中医科学院, 2013. |
| [29] | 蔡玉颖, 刘志顺, 王 顺, 王奇峰, 谈太鹏.电针曲池、足三里穴对脑缺血再灌注损伤大鼠神经功能缺损的影响[J].上海中医药大学学报,2009,6:64-66. |
| [30] | 游咏梅.薛偕华.电针足三里穴,曲池穴对脑缺血再灌注大鼠Bad及其磷酸化的影响[J].亚太传统医药,2014,10: 21-23. |
 2016, Vol. 37
2016, Vol. 37


