放射治疗(简称放疗)是治疗肺癌的主要手段之一,与手术、化疗同等重要。常规放疗和三维适形放疗的照射剂量受正常组织剂量的限制,疗效通常不能令人满意。射波刀是一种立体定向放射外科技术,通过呼吸门控和同步呼吸跟踪技术,可对随呼吸运动的肿瘤进行实时跟踪,治疗精度达到亚毫米级,为原发性肺癌患者提供了无创或微创的治疗[1, 2, 3]。本研究回顾性分析了第二军医大学长海医院放射治疗科66例周围型非小细胞肺癌患者经射波刀治疗的近期疗效和不良反应,评价射波刀治疗周围型肺癌的安全性和有效性。
1 资料和方法 1.1 临床资料回顾分析2012年1月至2013年12月第二军医大学长海医院放射治疗科收治的周围型非小细胞肺癌患者66例,其中男性43例,女性23例,年龄35~81岁(中位年龄48岁);病理类型:鳞癌31例,腺癌35例。肿瘤直径1~5 cm 37例,直径大于5 cm 29例。ⅠA期8例,ⅠB期12例,ⅡA期22例,ⅡB期15例,ⅢA期9例。
1.2 治疗方法 1.2.1 确定追踪方式35例采用肺追踪,25例采用金标追踪,6例采用椎体追踪。采用金标追踪的患者于定位前1周在肿瘤周围植入1~3枚金标。
1.2.2 CT扫描用真空垫将患者按治疗体位进行体位固定,CT扫描层厚1.5 mm,扫描范围平扫包括全肺和病灶上下10~15 cm范围,增强扫描包括病灶在内至少10 cm范围,然后进行图像融合。
1.2.3 靶区勾画肺部肿瘤在CT肺窗上确定肉眼肿瘤靶区(gross tumor volume,GTV),PET-CT为参考,采用金标追踪和肺追踪的患者GTV外放5 mm形成计划靶区(planning target volume,PTV),采用椎体追踪的患者在平静呼吸状态下观察患者呼吸强度,在CT上勾画出内靶区(internal target volume ITV),ITV外放5 mm形成PTV。
1.2.4 治疗方案65%~75%等剂量线覆盖PTV,总剂量为42~60 Gy,分割次数4~6次,生物等效剂量(biological equivalent dose,BED)为71.4~150.0 Gy。正常组织剂量按照APM TG101号报告限量[4]。
1.3 随访及评价标准治疗后4~12周CT扫描评价近期疗效,以后每3个月随访1次,随访时间为11~29个月,中位时间为18个月,按照RECIST 1.1标准评价疗效,采用急性放射性肺损伤RTOG分级标准评价放射损伤。
1.4 统计学处理采用SPSS 19.0统计软件,近期疗效评价采用χ2检验。检验水准(α)为0.05。
2 结 果 2.1 近期疗效全组66例患者,其中完全缓解(complete response,CR)31例、部分缓解(partial response,PR)28例、疾病稳定(stable disease,SD)5例、疾病进展(progressive disease,PD)2例,总有效率89.4%(59/66)。
2.2 不良反应 /span>2.2.1 金标穿刺11例患者出现局限性气胸,未经处理自行吸收;1例患者出现严重气胸,进行胸腔闭式引流1周后复张并顺利完成治疗;2例咯血,经治疗后控制,其余均以穿刺点局部轻度疼痛为主诉。
2.2.2 射波刀治疗半数患者主诉乏力、纳差;3例患者肿瘤侵犯胸壁,治疗期间出现胸部疼痛;23例患者CT显示局限性放射性炎症,无临床症状,不需药物治疗;4例出现Ⅱ级放射性肺炎,经治疗后缓解,其中3例有既往多次放疗史,1例为多个病灶同时照射,见图 1。
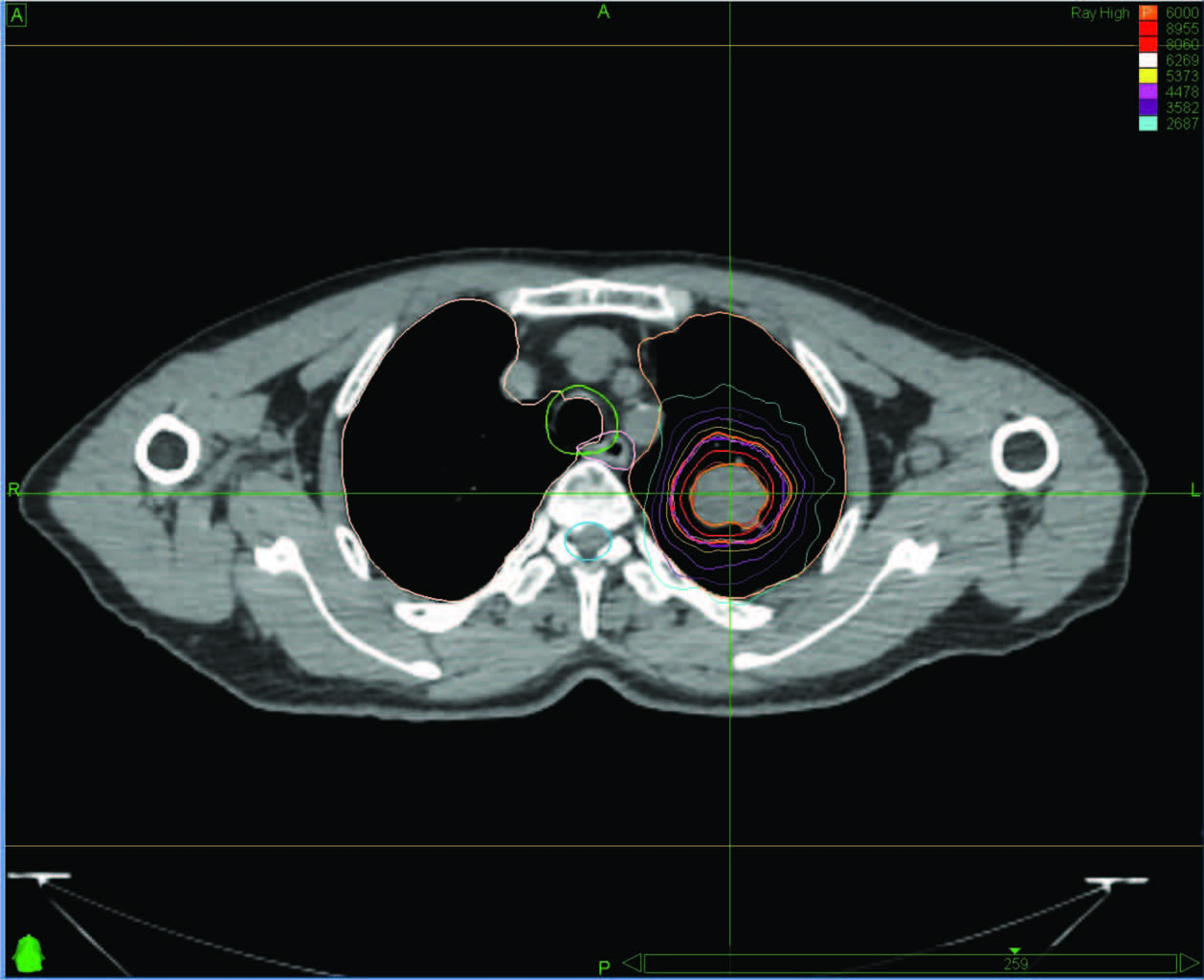
|
图 1 左肺周围型肺癌患者的剂量曲线图 |
分析了肿瘤大小、病理类型BED、年龄、性别对疗效的影响,显示肿瘤大小和BED是影响疗效的重要因素,肿瘤直径<5 cm的患者和BED≥100 Gy的患者有效率明显升高(P=0.019,P=0.007),而病理类型、年龄和性别不是影响疗效的重要因素,见表 1。
|
|
表 1 影响疗效的因素分析 |
随访过程中死亡10例,其中2例死于肿瘤进展;4例肿瘤局部控制,死于远处转移;4例死于伴随疾病,没有患者出现治疗相关死亡。
3 讨 论放疗是除手术之外治疗原发性肺癌最常见、最有效的局部治疗手段。常规分割模式的放疗单次剂量小、生物剂量低、治疗时间长,所以局部肿瘤未控和复发是治疗失败的主要原因。射波刀是立体定向放射治疗技术,兼具放射外科和放射治疗两种功能,采用实时图像引导系统以及呼吸追踪系统,以其大剂量、高精度和周围受照射的正常组织或重要器官范围小等优点,在治疗肺部肿瘤方面取得了显著的效果[5]。与三维适形放疗相比,射波刀采用无创的固定方式、全自动的治疗床、自动摆位、静态和动态照射中重复定位和瞬时修正照射方向等手段,平均照射剂量提高75%,平均最小照射剂量提高51%,大幅提高了BED,而正常组织受照射范围小,提高了适行性和治疗精度,平均误差仅为(0.7±0.3)mm,治疗精度可达到(0.3±0.1)mm[6]。Whyte等[7]在2003年首先将射波刀用于原发性肺部肿瘤以及转移性肺部肿瘤的治疗,肿瘤直径为1~3 cm,证实了射波刀治疗肺部肿瘤的可行性、安全性以及有效性。
射波刀治疗肺癌的关键技术是呼吸同步跟踪技术,包括肺追踪和金标追踪。本组病例有35例采用肺追踪,25例采用金标追踪。金标植入的并发症主要为穿刺引起的气胸,本组有11例患者出现局限性气胸,未作处理,自行吸收,1例患者出现严重气胸,经胸腔闭式引流后复张。临床中发现植入多个金标的并发症的发生率为25%~30%[8, 9],而植入1个金标可减少并发症同时不减低局控率,其原因可能是靶区边缘的高剂量抵消了金标定位跟踪的误差和肿瘤旋转的不确定性[10]。对有慢性肺部疾病如慢性支气管炎、肺气肿、肺大泡和哮喘的患者而言,金标植入风险较大,我们采用的是椎体追踪,此外肺内有多个病灶的患者也采用椎体追踪。
在分析影响射波刀治疗原发性非小细胞肺癌疗效的因素中,我们比较了肿瘤大小、BED、病理类型、性别和年龄对疗效的影响,统计学分析显示肿瘤大小和BED是影响近期疗效的主要因素,肿瘤直径<5 cm的患者和BED≥100 Gy的患者治疗效果明显提高,目前基于肿瘤大小、位置、病理类型的最佳治疗剂量与分次仍不十分清楚,也没有证实最大的放射剂量[11]。
放射性肺炎是肺癌放疗剂量限制性毒性反应,与放射剂量、体积相关。减小照射体积可以明显降低放射性肺炎发生率。本研究结果显示急性放射性肺炎的发生率较低,重度放射性肺炎均发生在既往有多次放疗和多个病灶同时照射的患者中。射波刀治疗中PTV明显减小,受到较高照射剂量照射的正常肺组织如V20、V30降低,因此可能减少放射性肺炎的发生率。Agarmal等[12]报道了37例不能手术的早期非小细胞肺癌患者行射波刀治疗,未发生急性放射性肺炎,治疗前后肺功能无明显差异。
本研究报告了射波刀治疗周围型肺癌的初步结果,说明射波刀治疗周围型肺癌近期疗效明显,急性反应轻微,患者耐受良好。我们还将研究射波刀联合同步化疗对局控效果以及患者生存率和晚反应损伤的影响,以期进一步提高对周围型肺癌的治疗效果。
| [1] | Crop F, Lacornerie T, Szymczak H, Felin A, Bailleux C, Mirabel X, et al. Treatment and technical intervention time analysis of a robotic stereotactic radiotherapy system[J]. Technol Cancer Res Treat, 2014, 13: 29-35. |
| [2] | Nagata Y, Wulf J, Lax I, Timmerman R, Zimmermann F, Stojkovski I, et al. Stereotactic radiotherapy of primary lung cancer and other targets: results of consultant meeting of the International Atomic Energy Agency[J]. Int J Radiat Oncol Biol Phys, 2011, 79: 660-669. |
| [3] | Bahig H, Campeau M P, Vu T, Doucet R, Béliveau Nadeau D, Fortin B, et al. VPredictive parameters of CyberKnife fiducial-less (XSight Lung) applicability for treatment of early non-small cell lung cancer: a single-center experience[J]. Int J Radiat Oncol Biol Phys, 2013, 87: 583-589. |
| [4] | Grimm J, LaCouture T, Croce R, Yeo I, Zhu Y, Xue J. Dose tolerance limits and dose volume histogram evaluation for stereotactic body radiotherapy[J]. J Appl Clin Med Phys, 2011, 12: 3368. |
| [5] | Nuyttens J J, Pol M V D. The cyberknife radiosurgery system for lungcancer[J]. Expert Rev Med Devices,2012, 9: 465-475. |
| [6] | Lartigau E, Mirabel X, Prevost B, Lacornerie T, Dubus F, Sarrazin T. Extracranial stereotactic radiotherapy: preliminary results with the Cyberknife[J]. Oncologie, 2009, 32: 209-215. |
| [7] | Whyte R I, Crownover R, Murphy M J, Martin D P, Rice T W, DeCamp M M Jr, et al. Stereotactic radiosurgery for tumors:preliminary report of phaseⅠtrial [J]. Ann Thorac Surg, 2003, 75: 1097-1101. |
| [8] | Collins B T, Erickson K, Reichner C A, Collins S P, Gagnon G J, Dieterich S, et al. Radical stereotactic radiosurgery with real-time rumor motion tracking in the treatment of small peripheral lung tumors[J]. Radiat Oncol, 2007, 22:39-45. |
| [9] | Pennathur A, Luketich J D, Burton S, Abbas G, Heron D E, Fernando H C, et al. Stereotactic radiosurgery for the treatment of lung neoplasm: initial experience[J]. Ann Thorac Surg, 2007, 83:1820-1825. |
| [10] | Brown W T, Wu X, Fayad F, Fowler J F, Amendola B E, García S, et al. Cyberknife radiosurgery for stage Ⅰlung cancer: results at 36 months[J]. Clin Lung Cancer, 2007,8:488-492. |
| [11] | Swangsilpa T, Yongvithisatid P, Pairat K, Dechsupa P, Dhanachai M, Dangprasert S, et al. Preliminary experience of cyberknife treatment of lung metastasis: the question about real clinical benefit[J]. J Med Assoc Thai, 2013, 96: 603-613. |
| [12] | Agarwal R, Saluja P, Pham A, Ledbetter K, Bains S, Varghese S, et al. The effect of Cyberknife therapy on pulmonary function tests used for treating non-small cell lung cancer, a retrospective observational cohort pilot study[J]. Cancer Manag Res, 2012,4:347-350. |
 2016, Vol. 37
2016, Vol. 37


