叶酸作为人体所必需的B族维生素,参与人体众多重要物质的合成和代谢。叶酸的缺乏可以导致基因组DNA链的断裂、染色体的不稳定及尿嘧啶的错配等,进而破坏了DNA的合成和修复,影响核酸、组蛋白甲基化修饰的改变[1]。流行病学调查研究表明,叶酸的的缺乏可以导致人体肿瘤的发生,如乳腺癌、卵巢癌、结直肠癌、胰腺癌等[2]。然而,叶酸的缺乏如何通过影响表观遗传的改变,进而又引起了肿瘤的发生,是值得我们探讨的问题,本文从以下几方面予以综述。
1 叶酸的吸收和代谢叶酸因在绿叶蔬菜中含量丰富而得名,是一种水溶性维生素。人体自身只能合成小量叶酸,主要从食物中摄取,在小肠吸收。叶酸被吸收后在二氢叶酸还原酶的作用下转变为有活性的四氢叶酸,进一步转变为5-甲基四氢叶酸。5-甲基四氢叶酸是一碳单位的载体,对于嘌呤、嘧啶核苷酸的合成和氨基酸的代谢是不可或缺的。体内叶酸代谢主要包括两大途径:其一,参与 DNA生物合成所需要的脱氧胸腺嘧啶核苷单磷酸(dTMP)和嘌呤前体的合成;其二,参与细胞内甲基化反应所需要的甲基供体S-腺苷甲硫氨酸(SAM)的形成(图 1)[3, 4]。SAM是体内许多生物化学反应最主要的甲基供体,包括DNA中嘧啶的甲基化。当体内叶酸缺乏时,叶酸循环的主要形式5-甲基四氢叶酸水平同样降低,导致SAM的合成减少,进一步使DNA合成中嘧啶的甲基化减少[5]。这种低甲基化可能导致癌基因的上调表达,从而引起肿瘤的发生[6]。
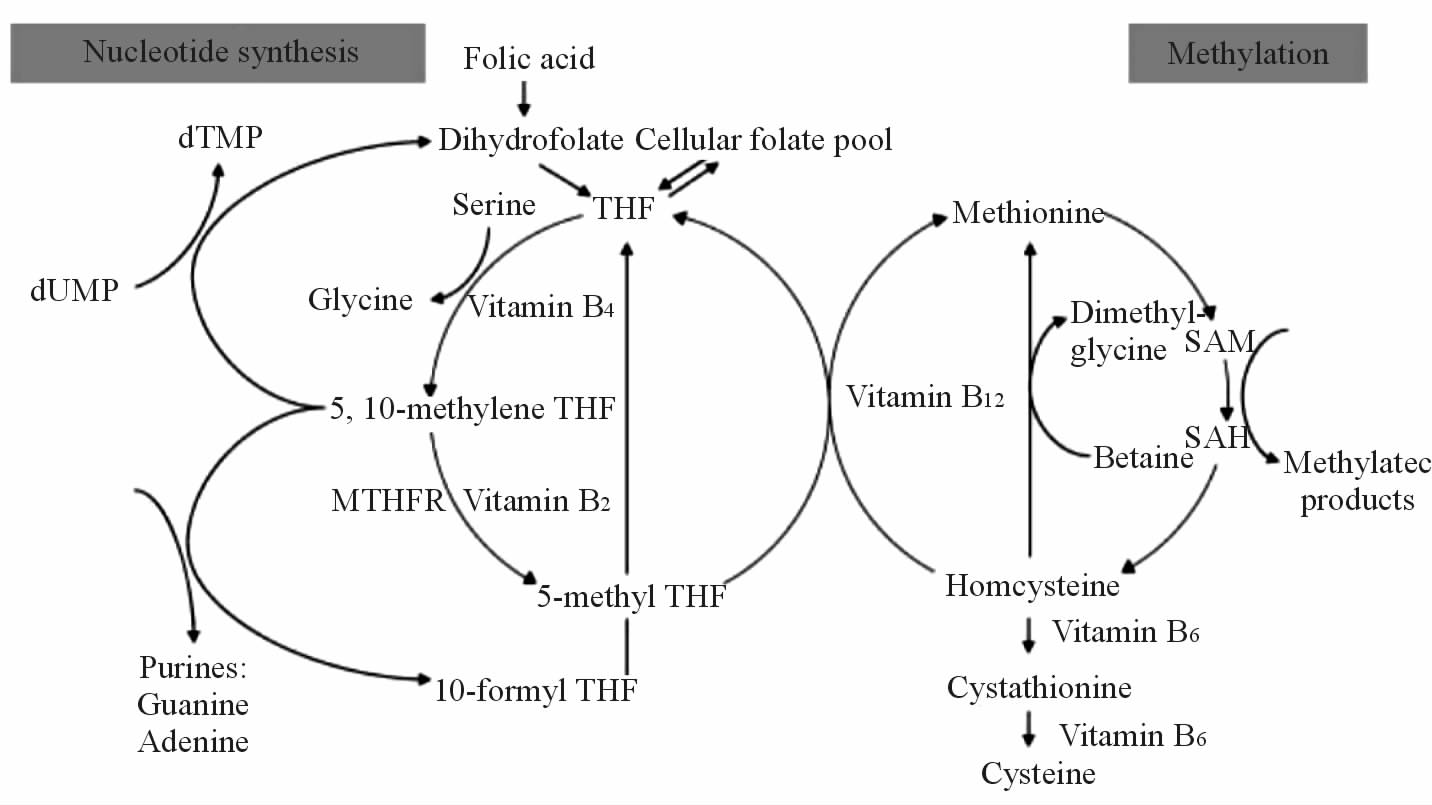
|
图 1 叶酸代谢途径[3, 4] Fig 1 Folic acid metabolism[3, 4] Folic acid provides methyl groups for nucleotide synthesis via 5,10-methylenetetrahydrofolate, or 5-methyltetrahydrofolate and S-adenosylmethionine(SAM) to methylation reactions. These two folic acid metabolism pathways are separated by an irreversible reaction mediated via the methylenetetrahydrofolate reductase (MTHFR) enzyme. SAH:S-adenosylhoocysteine;THF:Tetrahydrofolate; dUMP: Deoxyuridine monophosphate; dTMP: Deoxythymidine monophosphate |
据统计,人群中叶酸的缺乏是维生素缺乏中最普遍的,在英国大约20%的老年人叶酸摄入不足[7]。流行病学调查资料显示叶酸摄入不足与肿瘤发生风险增高密切相关[8]。叶酸与肿瘤的研究中最多的是关于叶酸与结直肠癌的研究。例如,与习惯于高叶酸摄入的人群相比,低叶酸摄入者结肠癌发生的风险性升高30%~40%[9]。一份将近20年的调查资料显示,叶酸摄入量<240 μg/d的人患结肠癌的危险度高于叶酸摄入量>560 μg/d者(95% CI=0.78~0.98;P=0.009)[10]。另有研究表明,对若干结直肠癌患者与正常人群的结直肠黏膜细胞叶酸水平进行对比分析,发现从结直肠黏膜正常组织到包含息肉的结直肠黏膜组织再到结直肠息肉本身组织,叶酸的水平降低[11]。这可能是因体内低叶酸水平导致DNA中尿嘧啶的错误插入和基因组DNA的低甲基化,进而导致基因组的不稳定性和肿瘤的发生[11]。此外还有研究发现,服用叶酸时间的长短与肿瘤的发生也有关系,短时间内服用叶酸可以预防结肠癌的发生,但是长时间服用可使人群患结直肠癌的风险性增加[12],造成这种原因的机制还需进一步探讨。
人群干预实验也证实叶酸可以预防肿瘤的发生。Zhu等[13]用叶酸对胃癌前病变进行干预治疗,跟踪随访若干年后发现患者胃黏膜炎症、萎缩和肠化生保持逆转和稳定,因此推断叶酸可能是通过增加基因组DNA的整体甲基化水平并减少胃黏膜炎症反应以达到阻止幽门螺杆菌相关性胃癌的发生。根据对欧洲数个国家367 993名处于35~70岁的女性随访11年的调查研究显示,叶酸的补充可以降低绝经前妇女雌激素受体和孕激素受体阴性(ER-、PR-)肿瘤者患乳腺癌的风险(尤其是对于经常饮酒的女性),乳腺癌的发病风险与习惯于低叶酸饮食者相比降低14%[14]。流行病学资料的证据是与雌激素代谢相关的因子与雌激素受体阳性(ER+)有很大的相关性,然而ER-者与非荷尔蒙因素如饮食有很大的相关性[15]。 此外组蛋白的甲基化可以引起异常的基因表达、DNA的损伤、细胞周期的阻滞、基因组的不稳定性,均可以导致肿瘤的发生,而子宫颈不典型增生患者补充叶酸后发现子宫颈上皮细胞组蛋白H3K9的甲基化程度降低[16],充分说明叶酸的补充可以预防子宫癌的发生。
3 叶酸缺乏引起肿瘤的可能机制 3.1 影响表观遗传调控 3.1.1 DNA甲基化的改变叶酸通过参与DNA的合成、修复、甲基化来保持基因组DNA的稳定性。在叶酸代谢的过程中,同型半胱氨酸接受5-甲基四氢叶酸的甲基基团生成甲硫氨酸,甲硫氨酸在腺苷转移酶的作用下转变为SAM,SAM是细胞内各种甲基化反应的供体。因此,叶酸的缺乏将会造成甲基供体的不足进而影响核酸的甲基化,导致核苷酸特定位点的高甲基化和基因组DNA的低甲基化[17]及甲基转移酶活性的增强,进而使一些CpG岛甲基化,使位于这些区域的基因如肿瘤抑制基因失活,导致肿瘤的发生[17]。
研究显示,把75只刚断奶的雄性小鼠随机分成3组,分别为叶酸缺乏组(普通饲料不添加叶酸)、对照组(每千克普通饲料中添加叶酸2 mg)、叶酸补充组(每千克普通饲料中添加叶酸8 mg),饲养3周检测发现,叶酸缺乏组小鼠结肠黏膜基因组DNA甲基化的程度比对照组和叶酸补充组至少低30%;在前3周,结肠黏膜中DNA甲基化的反指示剂S-腺苷同型半胱氨酸(SAH)在3组中并无明显差异,然而从第4周开始,尤其是第5周检测显示叶酸缺乏组中SAH比对照组和叶酸补充组高3.0~3.3倍(P<0.007)。叶酸缺乏组中SAM/SAH比值在研究进程中呈现下降趋势,在第5周比对照组和叶酸补充组低64%~71%(P<0.005),在对照组和叶酸补充组中差异无统计学意义[18]。这种基因组DNA低甲基化是肿瘤组织中普遍存在的一种现象[19]。可能的原因为叶酸的缺乏导致DNA甲基转移酶1(DNMT1)的异常表达,进而导致基因组DNA甲基化的改变,基因组DNA的低甲基化可以导致肿瘤的发生[20]。因此基因组DNA甲基化水平的降低可以作为肿瘤发生前的早期事件[21]。
3.1.2 RNA甲基化的改变类似于DNA,在SAM参与的反应中,许多RNA在特定位点被甲基化。在一些情况下,RNA 5′端的帽结构被甲基化;在其他情况下RNA内部核苷酸被甲基化。尽管现在RNA甲基化的功能才刚刚发现,很明显RNA的甲基化在保持它的稳定性和核膜内外物质的运输过程中起着非常重要的作用。饮食中甲基供体的缺乏可导致tRNA的脱甲基化。研究表明叶酸的缺乏足以使一些RNA,如核小RNA(snRNA)去甲基化,而snRNA是参与信使RNA(mRNA)成熟过程的必须成分[22]。mRNA表达水平的变化与肿瘤间也有一定的相关性。染色体15q25、5p15和6p21三个位点是肺癌的敏感位点,而对法国肺癌人群的研究资料表明,外界因素主要是通过改变肺组织染色体 15q25上CHRNA5基因的mRNA的表达水平进而影响了肺癌的发生、发展[23]。
3.1.3 MicroRNA(miRNA) 的改变MiRNA是一类内生的、长度约18~25个核苷酸的小RNA,也是一类重要的非编码RNA,在基因的表达后修饰过程中起着重要作用[24]。MiRNA调控正常细胞的增殖、分化、凋亡,然而在肿瘤形成的过程中是失调的[25],因此miRNA的表达和功能的紊乱可能导致肿瘤的初始形成[26]。
近年来研究发现叶酸参与调控miRNA的表达,而且这可能和肿瘤的发生相关。例如给C57BL/6J小鼠饲养缺乏叶酸、甲硫氨酸的食物12周后检测,发现与对照组相比miR-101a 和miR-101b的表达下调,miR-101a作用靶点之一是环氧合酶-2(Cox-2),而Cox-2在叶酸缺乏饲料喂养的小鼠中是明显上调的,此分子的上调在人类肿瘤的发展中是很常见的,并且被作为早期肝癌预防的靶分子[27]。另有研究表明,与饲养普通饲料小鼠的肝脏芯片miRNA的表达差异对比,发现饲养普通饲料组小鼠肝脏miR-122的表达水平下降[28]。MiR-122的下调同时伴随着CCNG1蛋白的上调,CCNG1表达水平的改变和miR-122的靶分子,如脂酸合成酶、固醇调节元件结合蛋白-1C、抗凋亡家族成员Bcl-2,在肝癌发生的早期被检测到并且导致了肝癌的发生[29]。体外实验同样发现了类似结果:叶酸缺乏培养基培养的胰腺癌细胞引起miR-16表达水平的升高,此后把细胞放入完全培养基中培养一段时间发现miR-16的表达恢复正常水平,miR-16作用于维甲酸和甲状腺激素受体的沉默因子,并且促进了核因子κВ(NF-κВ)调节的白介素(IL)-8的转录激活,IL-8的转录激活在肿瘤的发生和许多肿瘤(包括胰腺癌)的转移中发挥重要作用,因此叶酸的缺乏对miR-16作用的发挥很重要[30]。此外,叶酸缺乏培养基培养的人白血病细胞与对照组相比miR-22的表达水平明显增高,miR-22与叶酸调节有关的一碳单位的代谢有很大关系,且在多种肿瘤中高表达。它作用于一碳代谢相关的基因,如MTHFR、TCN2、MAT2A等,这对叶酸的转运、叶酸辅因子的分配和甲基化起着重要作用[31]。这些结果表明叶酸的缺乏引起miRNA的表达的改变是早期肿瘤发生的一个显著事件,并且不同个体对肿瘤的易感性取决于miRNA的表达水平的改变。
3.1.4 组蛋白甲基化的改变组蛋白甲基化修饰主要是由一类含有SET结构域的蛋白来执行的,组蛋白甲基化修饰参与异染色质形成、基因印记、X染色体失活和转录调控等多种主要生理功能,组蛋白的修饰作用是表观遗传学研究的一个重要领域。组蛋白甲基化的异常与肿瘤发生等多种人类疾病相关,可以特异性地激活或者抑制基因的转录活性。
研究表明,用聚丙烯酰胺凝胶电泳检测叶酸轻度缺乏培养基中前列腺癌细胞系G100中组蛋白的甲基化水平,发现具有转录抑制效应的组蛋白H3K9的整体甲基化水平升高,同样具有转录激活效应的组蛋白H3K36me2甲基化水平也增高,提示叶酸的缺乏在表观遗传方面对前列腺癌的发展发挥着很大的作用[32]。与此类似,宫颈癌样本(1990~1992)及强制性服用叶酸后的宫颈癌样本均显示宫颈癌上皮内瘤变二级、三级及原位癌的整体组蛋白H3K9的甲基化程度远高于一级的病变及正常的组织,对于无子宫颈上皮内瘤变的正常女性强制性服用叶酸后组蛋白H3K9的甲基化程度则低于服用叶酸前的水平[16]。其机制可能为机体在病变时,经常性摄入叶酸含量高的食物则机体SAM/SAH水平高,进而导致组蛋白甲基转移酶的高表达,使组蛋白甲基化水平升高促使机体向病变状态进展。然而正常机体高叶酸的摄入则对机体发挥着保护作用,因此,我们猜测在前列腺癌发生的不同阶段SAM/SAH对组蛋白甲基酶的影响是各异的。经常进食叶酸含量较低的食物则使SAM/SAH比值降低,低比值的SAM/SAH抑制组蛋白甲基转移酶活性,使组蛋白甲基化水平降低。
3.2 叶酸与端粒酶的改变研究显示,浓度为30 nmol/L叶酸培养基培养的人B淋巴细胞(WIL2-NS)比浓度3 000 nmol/L叶酸培养基中细胞端粒酶的长度增加26%(P<0.000 1),且早期端粒酶长度的增加与叶酸的缺乏引起的基因组DNA的低甲基化相关,并与DNA甲基转移酶抑制剂具有相同的效应[33]。实时定量PCR结果分析显示,胞质叶酸的浓度与端粒DNA中尿嘧啶的错配呈负相关,揭示了尿嘧啶可能为叶酸缺乏引起端粒酶长度及功能改变的原因之一。端粒酶长度的增加和缩短均与染色体的不稳定相关,染色体的不稳定可引起多种肿瘤的发生[34]。因此,叶酸适量的补充可减少肿瘤的发生。
3.3 叶酸与亚甲基四氢叶酸还原酶亚甲基四氢叶酸还原酶是叶酸代谢的关键酶,在5,10-亚甲基四氢叶酸转变为5-甲基四氢叶酸的过程中发挥着重要作用。在叶酸缺乏时,5-甲基四氢叶酸的减少可导致高SAH血症。此外,MTHFR C677T和MTHFR A1298C 是MTHFR的变异体,此基因的变异可降低MTHFR的活性,增加SAH的水平,改变叶酸代谢的过程和一些蛋白的表达[35],并且可导致DNA的低甲基化,进而导致基因组的不稳定性和肿瘤抑制基因的激活[36]。在不同的种族,MTHFR C677T 和MTHFR A1298C 的突变频率不同,这两种变异的蛋白经常出现在白种人、亚洲人和西班牙人群中,变异率为25%~45%[37]。机制可能为叶酸的缺乏引起DNA中尿嘧啶的错误插入,进而导致DNA修复的失败及基因组的不稳定和原癌基因的激活,而MTHFR直接参与叶酸代谢,因此MTHFR C677T的多态性可能直接导致肿瘤的发生[38]。流行病学资料显示,亚甲基四氢叶酸还原酶基因677TT与机体的低叶酸状态和胃癌的发生率增加之间有很密切的关系,基因型MTHFR 677TT与CT型相比可减少胃癌的发生,可能的原因为CT基因型与野生型的个体相比降低了叶酸的浓度和血浆高水平SAH,进而导致胃癌的发生[39]。病例对照研究表明,叶酸摄入量与直肠癌的发生率也有很大关系,而基因型为677TT的女性,此种癌症的发病率则降低,暗示MTHFR 677TT基因型对女性起保护性作用[40]。另有研究结果亦表明,高叶酸摄入者患大肠癌的风险性远低于低叶酸摄入者,尤其是摄入酒精时,其可能的原因是酒精是一碳单位代谢的拮抗剂,酒精的过多摄入导致了叶酸吸收、代谢障碍,从而引起肿瘤的发生[41]。此外,低水平的黄素腺嘌呤二核苷酸可降低MTHFR的活性;其他可能的原因为叶酸的强制性补充可能改变了酒精效应的阈值[42]。在我国北方叶酸缺乏地区对食管癌患者进行的调查研究发现,MTHFR C677T 基因多态性与食管癌发病率增高呈等位基因剂量效应关系,且人群中基因型为677CC、CT和TT者患食管癌的OR值分别为1.00、3.14和6.18(P<0.000 1),表明该基因多态性可能是食管癌的遗传易感因素[43]。
3.4 叶酸与血管再生血管生成是指从原有的毛细血管或毛细血管后静脉发展而形成新的血管,是一个涉及多种分子的复杂过程,对机体正常生理功能的进行是必须的,但是异常的血管增生可以导致肿瘤的发生。因此,抑制新生血管的生成成为预防肿瘤的一种新的方案。研究表明,叶酸可通过叶酸受体激活cSrc/ERK-2/NF-κB/p53信号通路,抑制上皮细胞的增殖进而抑制血管的生成[44]。此外,叶酸可以抑制早期肝癌发生过程中新生血管的生成,降低CD34蛋白水平,降低肝癌的发生[45]。因此,适量补充叶酸对肿瘤的发生有一定的预防作用。
3.5 叶酸与细胞凋亡细胞凋亡是指机体为维持内环境稳定,由基因控制的细胞自主性的有序的死亡。它是主动的过程,涉及一系列基因的激活、表达以及调控,它不是病理条件下自体损伤的一种现象,而是为更好地适应生存环境去主动争取的一种死亡过程。凋亡过程的紊乱可能与许多疾病的发生有直接或间接的关系,如肿瘤、自身免疫性疾病等。
叶酸的缺乏使不同的细胞呈现出不同的凋亡率。HepG2细胞株 (人肝脏细胞瘤)在叶酸缺乏组(实验组)和完全培养基(对照组)中分别培养,培养1周内检测发现,实验组细胞内叶酸浓度降至对照组的32%,接着出现细胞生长抑制、细胞死亡率增加和凋亡现象;同时,细胞周期被阻逆于S/G2 /M 期,细胞平均蛋白含量增加,此时把细胞放入对照组(叶酸的浓度为2 μmol/L)培养23 d,这种现象可被逆转[46]。与此类似的是叶酸对小鼠心肌细胞凋亡现象的研究,即分别对小鼠饲养含不同浓度叶酸的饲料,11周之后发现叶酸对小鼠心肌细胞的凋亡呈剂量效应,可能是叶酸使抗凋亡蛋白Bcl-2增加,使凋亡蛋白Bax、Fas降低,而起到对心肌细胞的保护性作用[47]。将处于胃癌前病变的患者随机分为两组,即长时期服用添加叶酸的食物组与食物中缺乏叶酸组,检测发现服用添加叶酸的食物组患者胃黏膜叶酸的平均浓度远高于无叶酸者,同时上皮细胞的凋亡和肿瘤抑制因子p53的表达也增加,致癌基因Bcl-2的表达下降[48],以上均可以说明叶酸的保护性作用,它的缺乏可能会导致肿瘤的发生。
4 结 语众多资料表明,低叶酸饮食与肿瘤的发病率增加呈正相关。叶酸缺乏导致基因组DNA的低甲基化、组蛋白甲基化的改变和致癌基因的激活,致使一系列的DNA修复损伤、DNA链的断裂和染色体的破坏,最终导致肿瘤的发生。因此,叶酸的补充非常必要。目前叶酸已经被添加在各种食品中以预防一些疾病的发生。研究发现叶酸的补充并不能抑制结直肠癌的进展,但可预防正常的结直肠黏膜发展为肿瘤[49]。此外,叶酸代谢过程极为复杂,除了MTHFR外还有很多酶的参与,此基因不同的突变类型可能会导致不同的疾病,因此我们需要了解这些酶的基因突变对叶酸代谢的影响,寻找相应的对策减少疾病的发生。Larsson等[50]研究发现,叶酸补充对肿瘤的利弊主要取决于叶酸补充的时间和剂量。因此关于是否对整个人群进行叶酸干预、叶酸的补充剂量、补充时间及个体差异等还有待于进一步研究,最终确定出合理的叶酸补充方案达到肿瘤预防的目的。
| [1] | Novakovic P, Stempak J M, Sohn K J, Kim Y I.Effects of folate deficiency on gene expression in the apoptosis and cancer pathways in colon cancer cells[J].Carcinogenesis, 2006,27:916-924. |
| [2] | Duthie S J. Folate and cancer: how DNA damage, repair and methylation impact on colon carcinogenesis[J].Inherit Metab Dis,2011,34:101-109. |
| [3] | Choi S W, Mason J B.Folate and carcinogenesis: an integrated scheme[J].J Nutr,2000,130:129-132. |
| [4] | van Guelpen B. Folate in colorectal cancer, prostate cancer and cardiovascular disease[J].Scand J Clin Lab Invest,2007,67:459-473. |
| [5] | King W D, Ho V, Dodds L, Perkins S L, Casson R I, Massey T E. Relationships among biomarkers of one-carbon metabolism[J].Mol Biol Rep, 2012,39:7805-7812. |
| [6] | Duthie S J. Folic acid deficiency and cancer: mechanisms of DNA instability[J].Br Med Bull, 1999,55:578-592. |
| [7] | Keld R, Thian M, Hau C, Sajid J, Kumar N, Ang Y.Polymorphisms of MTHFR and susceptibility to oesophageal adenocarcinoma in a Caucasian United Kingdom population[J].World J Gastroenterol,2014,20:12212-12216. |
| [8] | Pogribny I P, James S J, Beland F A.Molecular alterations in hepatocarcinogenesis induced by dietary methyl deficiency[J].Mol Nutr Food Res, 2012,56:116-125. |
| [9] | Cappellani A, Zanghì A, Di Vita M, Cavallaro A, Piccolo G, Veroux P, et al. Strong correlation between diet and development of colorectal cancer[J].Front Biosci (Landmark Ed),2013,18:190-198. |
| [10] | Keum N, Giovannucci E L.Folic acid fortification and colorectal cancer risk[J].Am J Prev Med, 2014,46(3 Suppl 1):S65-S72. |
| [11] | McGlynn A P, Wasson G R, O'Reilly S L, McNulty H, Downes C S, Chang C K, et al.Low colonocyte folate is associated with uracil misincorporation and global DNA hypomethylation in human colorectum[J].J Nutr,2013,143:27-33. |
| [12] | Fife J, Raniga S, Hider P N, Frizelle F A.Folic acid supplementation and colorectal cancer risk: a meta-analysis[J].Colorectal Dis,2011,13:132-137. |
| [13] | Zhu S, Mason J, Shi Y, Hu Y, Li R, Wang M, et al.The effect of folic acid on the development of stomach and other gastrointestinal cancers[J].Chin Med J (Engl), 2003,116:15-19. |
| [14] | de Batlle J, Ferrari P, Chajes V, Park J Y, Slimani N, McKenzie F, et al.Dietary folate intake and breast cancer risk: European prospective investigation into cancer and nutrition[J].J Natl Cancer Inst, 2014,107:367. |
| [15] | Yang X R, Chang-Claude J, Goode E L, Couch F J, Nevanlinna H, Milne R L, et al.Associations of breast cancer risk factors with tumor subtypes: a pooled analysis from the Breast Cancer Association Consortium studies[J].J Natl Cancer Inst,2011,103:250-263. |
| [16] | Piyathilake C J, Macaluso M, Celedonio J E, Badiga S, Bell W C, Grizzle W E.Mandatory fortification with folic acid in the United States appears to have adverse effects on histone methylation in women with pre-cancer but not in women free of pre-cancer[J].Int J Womens Health,2010,1:131-137. |
| [17] | James S J, Pogribny I P, Pogribna M, Miller B J, Jernigan S, Melnyk S.Mechanisms of DNA damage, DNA hypomethylation, and tumor progression in the folate/methyl-deficient rat model of hepatocarcinogenesis[J].J Nutr,2003,133:3740S-3747S. |
| [18] | Sohn K J, Stempak J M, Reid S, Shirwadkar S, Mason J B, Kim Y I. The effect of dietary folate on genomic and p53-specific DNA methylation in rat colon[J].Carcinogenesis,2003,24:81-90. |
| [19] | Jadhav R R, Ye Z, Huang R L, Liu J, Hsu P Y, Huang Y W, et al.Genome-wide DNA methylation analysis reveals estrogen-mediated epigenetic repression of metallothionein-1 gene cluster in breast cancer[J].Clin Epigenetics,2015,7:13. |
| [20] | Wang J T, Ding L, Jiang S W, Hao J, Zhao W M, Zhou Q, et al.Folate deficiency and aberrant expression of DNA methyltransferase 1 were associated with cervical cancerization[J].Curr Pharm Des,2014,20:1639-1646. |
| [21] | Friso S, Udali S, Guarini P, Pellegrini C, Pattini P, Moruzzi S, et al.Global DNA hypomethylation in peripheral blood mononuclear cells as a biomarker of cancer risk[J].Cancer Epidemiol Biomarkers Prev,2013,22:348-355. |
| [22] | Guéant J L, Daval J L, Vert P, Nicolas J P.[Folates and fetal programming: role of epigenetics and epigenomics] [J].Bull Acad Natl Med, 2012,196:1829-1842. |
| [23] | Nguyen J D, Lamontagne M, Couture C, Conti M, Paré P D, Sin D D, et al.Susceptibility loci for lung cancer are associated with mRNA levels of nearby genes in the lung[J].Carcinogenesis, 2014,35:2653-2659. |
| [24] | Villegas-Ruiz V, Juárez-Méndez S, Pérez-González O A, Arreola H, Paniagua-García L, Parra-Melquiadez M, et al.Heterogeneity of microRNAs expression in cervical cancer cells: over-expression of miR-196a[J].Int J Clin Exp Pathol,2014,7:1389-1401. |
| [25] | van Jaarsveld M T, Wouters M D, Boersma A W, Smid M, van Ijcken W F, Mathijssen R H, et al. DNA damage responsive microRNAs misexpressed in human cancer modulate therapy sensitivity[J].Mol Oncol, 2014,8:458-468. |
| [26] | Ibrahim S A, Hassan H, GÖtte M.MicroRNA regulation of proteoglycan function in cancer[J].FEBS J, 2014,281:5009-5022. |
| [27] | Tanaka T, Haneda S, Imakawa K, Sakai S, Nagaoka K.A microRNA, miR-101a, controls mammary gland development by regulating cyclooxygenase-2 expression[J].Differentiation,2009,77:181-187. |
| [28] | Kutay H, Bai S, Datta J, Motiwala T, Pogribny I, Frankal W, et al. Downregulation of miR-122 in the rodent and human hepatocellualr carcinomas [J]. J cell Biochem, 2006,99:671-678. |
| [29] | Starlard-Davenport A, Tryndyak V, Kosyk O, Ross S R, Rusyn I, Beland F A, et al. Dietary methyl deficiency, microRNA expression and susceptibility to liver carcinogenesis[J]. World Rev Nutr Diet,2010,101:123-130. |
| [30] | Tian Y, Xue Y, Ruan G, Cheng K, Tian J, Qiu Q, et al.Interaction of serum microRNAs and serum folate with the susceptibility to pancreatic cancer[J].Pancreas, 2015,44:23-30. |
| [31] | Stone N, Pangilinan F, Molloy A M, Shane B, Scott J M, Ueland P M, et al.Bioinformatic and genetic association analysis of microRNA target sites in one-carbon metabolism genes[J].PLoS One, 2011,6:e21851. |
| [32] | Bistulfi G, Vandette E, Matsui S, Smiraglia D J.Mild folate deficiency induces genetic and epigenetic instability and phenotype changes in prostate cancer cells[J].BMC Biol, 2010,8:6. |
| [33] | Bull C F, Mayrhofer G, O'Callaghan N J, Au AY, Pickett H A, Low G K,et al. Folate deficiency induces dysfunctional long and short telomeres; both states are associated with hypomethylation and DNA damage in human WIL2-NS cells[J]. Cancer Prev Res,2014,7:128-138. |
| [34] | Cisyk A L, Penner-Goeke S, Lichtensztejn Z, Nugent Z, Wightman R H, Singh H, et al.Characterizing the prevalence of chromosome instability in interval colorectal cancer[J].Neoplasia, 2015,17:306-316. |
| [35] | Murto T, Kallak T K, Hoas A, Altmäe S, Salumets A, Nilsson T K, et al.Folic acid supplementation and methylenetetrahydrofolate reductase (MTHFR) gene variations in relation to in vitro fertilization pregnancy outcome[J].Acta Obstet Gynecol Scand,2015,94:65-71. |
| [36] | Lin J, Zeng R M, Li R N, Cao W H.Aberrant DNA methylation of the P16, MGMT, and hMLH1 genes in combination with the methylenetetrahydrofolate reductase C677T genetic polymorphism and folate intake in gastric cancer[J].Genet Mol Res,2014,13:2060-2068. |
| [37] | Liew S C, Gupta E D.Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism: epidemiology, metabolism and the associated diseases[J].Eur J Med Genet,2015,58:1-10. |
| [38] | Jiang-Hua Q, De-Chuang J, Zhen-Duo L, Shu-de C, Zhenzhen L.Association of methylenetetrahydrofolate reductase and methionine synthase polymorphisms with breast cancer risk and interaction with folate, vitamin B6, and vitamin B12 intakes[J].Tumour Biol,2014,35:11895-11901. |
| [39] | Lee T Y, Chiang E P, Shih Y T, Lane H Y, Lin J T, Wu C Y.Lower serum folate is associated with development and invasiveness of gastric cancer[J].World J Gastroenterol, 2014,20:11313-11320. |
| [40] | Murtaugh M A, Curtin K, Sweeney C, Wolff R K, Holubkov R, Caan B J, et al.Dietary intake of folate and co-factors in folate metabolism, MTHFR polymorphisms, and reduced rectal cancer[J].Cancer Causes Control,2007,18:153-163. |
| [41] | Zschäbitz S, Cheng T Y, Neuhouser M L, Zheng Y, Ray R M, Miller J W, et al.B vitamin intakes and incidence of colorectal cancer: results from the Women's Health Initiative Observational Study cohort[J].Am J Clin Nutr, 2013,97:332-343. |
| [42] | Nishihara R, Wang M, Qian Z R, Baba Y, Yamauchi M, Mima K, et al. Alcohol, one-carbon nutrient intake, and risk of colorectal cancer according to tumor methylation level of IGF2 differentially methylated region[J].Am J Clin Nutr, 2014,100:1479-1488. |
| [43] | Song C,Xing D, Tan W,Wei Q,Lin D.Methylenetetrahydrofolate reductase polymorphisms increase risk of esophageal squamous cell carcinoma in a Chinese population[J].Cancer Res, 2001, 61:3272-3275. |
| [44] | Hou T C, Lin J J, Wen H C, Chen L C, Hsu S P, Lee W S.Folic acid inhibits endothelial cell migration through inhibiting the RhoA activity mediated by activating the folic acid receptor/cSrc/p190RhoGAP-signaling pathway[J].Biochem Pharmacol, 2013,85:376-384. |
| [45] | Guariento A H, Furtado K S, de Conti A, Campos A, Purgatto E, Carrilho J, et al.Transcriptomic responses provide a new mechanistic basis for the chemopreventive effects of folic acid and tributyrin in rat liver carcinogenesis[J].Int J Cancer, 2014,135:7-18. |
| [46] | Huang R F, Ho Y H, Lin H L, Wei J S, Liu T Z.Folate deficiency induces a cell cycle-specific apoptosis in HepG2 cells[J].J Nutr, 1999,129:25-31. |
| [47] | Wu T G, Li W H, Lin Z Q, Wang L X.Effects of folic acid on cardiac myocyte apoptosis in rats with streptozotocin-induced diabetes mellitus[J].Cardiovasc Drugs Ther,2008,22:299-304. |
| [48] | Cao D Z, Sun W H, Ou X L, Yu Q, Yu T, Zhang Y Z, et al.Effects of folic acid on epithelial apoptosis and expression of Bcl-2 and p53 in premalignant gastric lesions[J].World J Gastroenterol,2005,11:1571-1576. |
| [49] | Sie K K, Medline A, van Weel J, Sohn K J, Choi S W, Croxford R, et al.Effect of maternal and postweaning folic acid supplementation on colorectal cancer risk in the offspring[J].Gut,2011,60:1687-1694. |
| [50] | Larsson S C, Giovannucci E, Wolk A.Folate intake, MTHFR polymorphisms, and risk of esophageal, gastric, and pancreatic cancer: a meta-analysis[J].Gastroenterology,2006,131:1271-1283. |
 2016, Vol. 37
2016, Vol. 37


