主动脉夹层是一种起病急骤的危重大血管疾病,指血流经主动脉内膜破口侵入管壁中层并沿其延伸剥离形成假腔,年发病率约为0.03‰~0.04‰[1]。目前,与主动脉夹层疾病过程相关的具体分子机制尚未完全阐明。在临床诊疗方面,虽然近年来对于主动脉夹层的诊断及手术治疗水平已有显著提高,然而其围术期死亡率仍高达8%~34%[2, 3]。进一步明确主动脉夹层的疾病机制对于未来改良其临床治疗策略具有潜在的启发意义,因此十分必要。
血管平滑肌细胞是主动脉中层最主要的细胞成分,在生理状态下其正常的生物学功能对维持主动脉管壁结构的完整性和力学强度的完好性十分重要[4]。既往已有研究证实在主动脉夹层的疾病过程中,管壁中层的血管平滑肌细胞发生了明显的丢失[5]。这种丢失被认为和病理状况下平滑肌细胞增殖及凋亡功能的异常密切相关[6],但其具体分子机制尚不明确。本研究以Stanford A型急性主动脉夹层患者的临床组织标本及原代人主动脉平滑肌细胞为研究对象,通过RT-PCR、蛋白质印迹法、Cell Counting Kit-8(CCK-8)、流式细胞仪等技术探讨了Myc associated factor X(MAX)这一细胞增殖、凋亡及分化相关基因在主动脉夹层中的表达情况及其相关生物学功能。
1 材料和方法 1.1 一般资料收集自2014年6月至2014年9月在我院胸心外科接受手术治疗的急性Standford A型主动脉夹层患者术中切除的病变升主动脉组织标本作为病变组,排除马凡综合征、大动脉炎、二叶瓣畸形患者。共收集到15例患者的升主动脉标本,其中男性11例,女性4例,平均年龄(47.9±16.9)岁。对照组标本取自在我院及第二军医大学长征医院进行尸检,且既往无大血管疾病史、手术史及家族史病例的升主动脉管壁组织。共收集到9例,其中男性5例,女性4例,平均年龄(41.2±9.6)岁。所有主动脉组织标本在处理时均去除外膜和内膜,仅保留富含血管平滑肌的中层组织。所有人体标本的收集、使用均在获得患者书面知情同意的前提下按照我院医学伦理委员会对于人体标本应用的相关规定进行。
1.2 细胞的培养及传代本研究的细胞学实验采用原代人源主动脉平滑肌细胞(human aortic smooth muscle cells,HASMCs)作为研究对象,产品购自Cascade Biologics公司,同时采用该公司的Medium 231细胞培养基按照使用说明进行HASMC的培养和传代。用于实验的细胞学样品为第4~7代。
1.3 荧光定量RT-PCR检测主动脉夹层组织中MAX mRNA的表达水平采用TaKaRa公司的PrimeScriptRT Reagent Kit抽提组织及细胞的总RNA反转录为cDNA。荧光定量PCR采用的试剂为TaKaRa公司的SYBR Premix EX Taq,反应仪器为Roche公司的LightCycler® 480 Real-Time PCR System。MAX的引物序列为:Forward 5′-GAG AGC GAC GAA GAG CAA CC-3′,Reverse 5′-TGC CTT CTC TCC TTG GAG TG-3′;18S rRNA的引物序列为:Forward 5′-CGG ACA CGG ACA GGA TTG AC-3′;Reverse 5′-GCA TGC CAG AGT CTC GTT CG-3′。其中18S rRNA作为实验内参。
1.4 蛋白质印迹法检测主动脉夹层组织中MAX蛋白表达水平采用碧云天公司的核蛋白抽提试剂盒分别制备组织及细胞学标本的核蛋白样品。每个样本等量上样,于10%聚丙烯酰胺凝胶中依次进行电泳、转膜、一抗及二抗孵育、显影拍照等实验流程。蛋白质印迹中所使用的抗体为Lamin B2 (ab151735,Abcam),MAX (ab101271,Abcam),其中Lamin B2作为实验内参。
1.5 腺病毒转染与分组实验中采用了同时表达绿色荧光蛋白(green fluorescent protein,GFP)和MAX的重组腺病毒Ad-MAX,及仅表达绿色荧光蛋白的重组腺病毒Ad-GFP。二者均购自上海生博生物医药科技有限公司,其中Ad-GFP作为对照。腺病毒转染按常规实验流程进行操作。
1.6 细胞增殖实验细胞增殖能力的检测采用碧云天公司的CCK-8试剂盒。细胞以4 000个/孔的密度接种于96孔板中,16 h后用分别以重组腺病毒Ad-MAX和Ad-GFP转染细胞作为实验及对照组。在转染后的0、24、48、72 h这4个时间点,每孔各加入10 μL的CCK-8溶液,37℃孵育1 h后,测量450 nm处的光密度值。实验重复3次。
1.7 细胞凋亡实验细胞转染腺病毒48 h后,按照凋亡检测试剂盒说明,以PBS冲洗细胞,加入PI和Annexin Ⅴ-FITC荧光抗体,染色15 min后采用流式细胞术测定凋亡率。实验重复3次。
1.8 统计学处理所有数据均采用SAS 9.13软件进行分析,计量资料采用 x±s 表示,检验水准(α)为0.05。
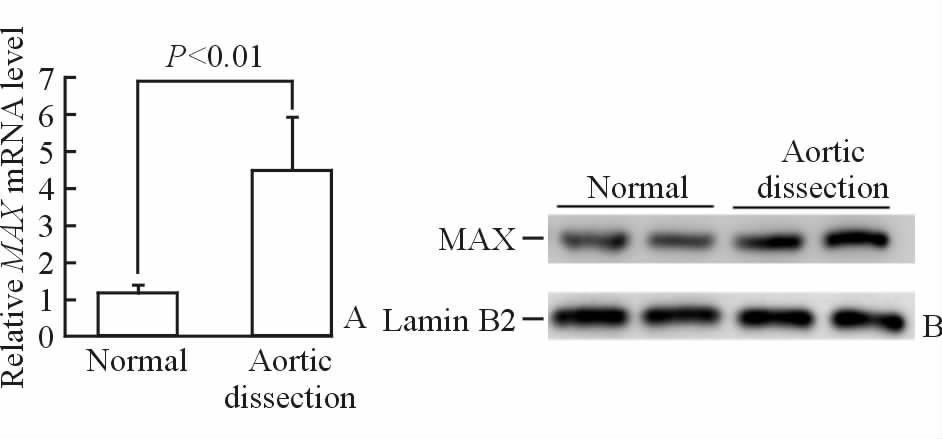
2 结 果 2.1 主动脉夹层组织MAX的表达水平荧光定量RT-PCR结果显示,夹层患者主动脉中层MAX mRNA的表达水平较正常对照组升高了约3倍(P<0.01,图 1A)。蛋白质印迹结果显示,主动脉夹层管壁中层MAX蛋白表达水平较正常组织明显增加(图 1B)。
|
图 1 主动脉夹层及正常主动脉中膜MAX的表达水平
Fig. 1 MAX expression in the aortic media tissues of dissection patients and normal controls A: MAX mRNA expression levels in two groups (Normal group: n=9; Aortic dissection group: n=15,x±s ); B:MAX protein expression levels in two groups. MAX: Myc associated factor X |
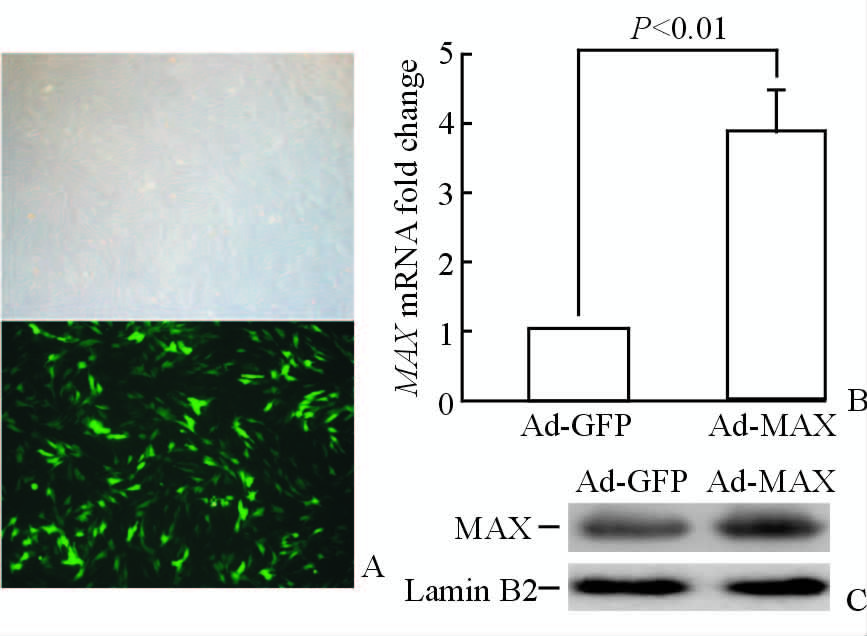
采用Ad-MAX转染状态良好的HASMCs使其过表达MAX作为实验组(Ad-MAX HASMCs),转染后采用荧光显微镜观察,确定转染效率达到了75%(图 2A),对照组细胞转染Ad-GFP(Ad-GFP HASMCs)。转染完成36 h后,抽提HASMCs的总RNA及核蛋白检测MAX的表达量。荧光定量RT-PCR结果显示,Ad-MAX HASMCs中MAX mRNA水平较对照组升高了约2.9倍(P<0.01,图 2B)。蛋白质印迹显示,Ad-MAX HASMCs中MAX蛋白的水平也较对照组上调(图 2C)。实验结果证实成功构建了过表达MAX的HASMCs。
|
图 2 过表达MAX的Ad-MAX HASMCs构建
Fig. 2 Overexpression of MAX in Ad-MAX HASMCs A: The transfection efficiency of adenovirus vectors in HASMCs reached 75%. Original magnification: ×100. B and C: The overexpression of MAX in Ad-MAX HASMCs was verified through qRT-PCR (n=3,x±s ) and Western blotting analysis,respectively. GFP: Green fluorescent protein; MAX: Myc associated factor X; HASMCs: Human aortic smooth muscle cells |
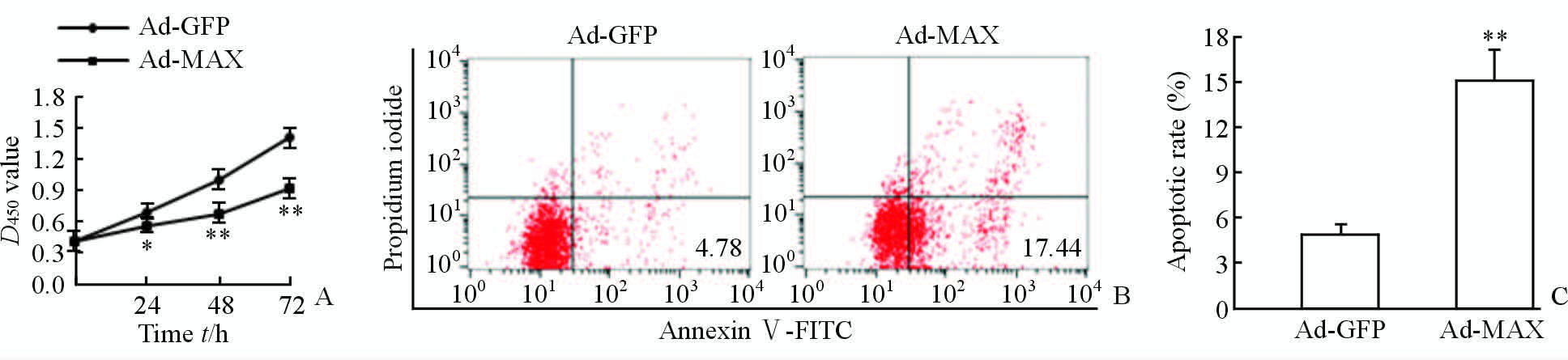
细胞增殖实验结果显示,Ad-MAX HASMCs组在转染后24、48、72 h这3个时间点的增殖情况均低于Ad-GFP HASMCs组(图 3A),差异均有统计学意义(P<0.05或P<0.01)。细胞凋亡实验结果显示,Ad-MAX HASMCs组的凋亡率高于对照组(图 3B),差异具有统计学意义(P<0.01)。以上结果表明,在HASMCs过表达MAX可抑制其增殖能力,同时促进其凋亡。
|
图 3过表达MAX抑制HASMCs的增殖并促进其凋亡
Fig. 3 Overexpression of MAX significantly inhibited the proliferation of HASMCs and promoted their apoptosis A:Results of Cell Counting Kit-8; B and C: Results of flow cytometry. GFP: Green fluorescent protein; MAX: Myc associated factor X; HASMCs: Human aortic smooth muscle cells. *P<0.05,**P<0.01 vs Ad-GFP; n=3,x±s |
本研究发现Stanford A型主动脉夹层患者升主动脉管壁中层MAX的表达量在mRNA和蛋白水平均高于正常升主动脉。我们成功构建了可稳定过表达MAX的Ad-MAX HASMCs,并且发现在HASMCs中过表达MAX可抑制细胞增殖,同时促进细胞凋亡。
位于主动脉中层的血管平滑肌细胞是其管壁最主要的细胞类有形成分,其功能正常是确保主动脉具备完好力学强度的首要因素。而在某些病理状况下其生物学行为的失调则被认为与主动脉夹层的疾病机制密切相关。已有研究表明,可由多种因素介导的主动脉中层平滑肌细胞的丢失,造成所谓的“中层退行性变”及管壁机械强度降低是主动脉夹层发生的重要病理学基础[6, 7]。而平滑肌细胞增殖及凋亡功能的异常正是导致这一退行性变的重要细胞学机制[6]。为了探究参与调控上述细胞增殖及凋亡生物学过程的具体分子机制,我们通过本研究证实MAX参与调控了这两个生物学过程。
MAX是碱性螺旋-环-螺旋亮氨酸拉链(bHLHZ)转录因子家族的一员,它通过与自身或Myc等bHLHZ家族的其他成员形成同源或异源二聚体调控细胞增殖、凋亡与分化。有研究证实,MAX主要通过在转录水平的调控实现上述生物学效应[8],其相关功能在肿瘤领域被广泛研究。MAX在某些恶性肿瘤中表达水平明显低于正常组织及良性病变,且与分化程度密切相关,高分化者阳性表达率明显高于低分化和未分化者[9],提示其具有抑癌基因的作用。然而,目前尚无关于MAX在心血管领域功能或相关疾病机制中作用的研究。本研究首次发现MAX在主动脉夹层患者管壁表达增高,且HASMCs过表达MAX后可抑制细胞增殖,促进凋亡,提示MAX在主动脉夹层的疾病机制中可能具有重要作用。然而,MAX通过何种分子机制实现其对HASMCs增殖、凋亡的调控,以及相关的下游基因和信号通路的确认则需要后续研究加以阐明。
| [1] | Golledge J, Eagle K A. Acute aortic dissection[J].Lancet,2008,372:55-56. |
| [2] | Rylski B, Beyersdorf F, Blanke P, Boos A, Hoffmann I, Dashkevich A, et al.Supracoronary ascending aortic replacement in patients with acute aortic dissection type A: what happens to the aortic root in the long run? [J].J Thorac Cardiovasc Surg,2013,146:285-290. |
| [3] | Rylski B, Suedkamp M, Beyersdorf F, Nitsch B, Hoffmann I, Blettner M, et al. Outcome after surgery for acute aortic dissection type A in patients over 70 years: data analysis from the German Registry for Acute Aortic Dissection Type A (GERAADA)[J].Eur J Cardiothorac Surg,2011,40:435-440. |
| [4] | Lacolley P, Regnault V, Nicoletti A, Li Z, Michel J B. The vascular smooth muscle cell in arterial pathology: a cell that can take on multiple roles[J].Cardiovasc Res,2012,95:194-204. |
| [5] | Milewicz D M, Guo D C, Tran-Fadulu V, Lafont A L, Papke C L, Inamoto S, et al. Genetic basis of thoracic aortic aneurysms and dissections: focus on smooth muscle cell contractile dysfunction[J]. Annu Rev Genomics Hum Genet,2008,9:283-302. |
| [6] | He R, Guo D C, Estrera A L, Safi H J, Huynh T T, Yin Z,et al. Characterization of the inflammatory and apoptotic cells in the aortas of patients with ascending thoracic aortic aneurysms and dissections[J].J Thorac Cardiovasc Surg,2006,131:671-678. |
| [7] | Lesauskaite V, Tanganelli P, Sassi C, Neri E, Diciolla F, Ivanoviene L, et al. Smooth muscle cells of the media in the dilatative pathology of ascending thoracic aorta: morphology, immune reactivity for osteopontin, matrix metalloproteinases, and their inhibitors[J]. Hum Pathol,2001,32:1003-1011. |
| [8] | Hurlin P J, Huang J. The MAX-interacting transcription factor network [J].Semin Cancer Biol, 2006,16:265-274. |
| [9] | Smith A G, Popov N, Imreh M, Axelson H, Henriksson M. Expression and DNA-binding activity of MYCN/Max and Mnt/Max during induced differentiation of human neuroblastoma cells[J].J Cell Biochem, 2004,92:1282-1295." |
 2015, Vol. 36
2015, Vol. 36


