2. 第二军医大学长征医院内分泌科, 上海 200003
2. Department of Endocrinology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
随着社会不断进步与发展,人口老龄化现象日益明显。2007~2008年的2型糖尿病(T2DM)患病率的调查结果显示,我国老年人(≥60岁)的患病率已高达20.4%[1]。老年人是糖尿病防治的重点人群,老年糖尿病的治疗目的是减少大血管和微血管并发症,以提高生活质量和预期寿命。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是老年T2DM患者最常见的慢性并发症之一,其病程较长,累及范围较广,临床表现多样,常导致糖尿病足的发生,是造成老年糖尿病患者致残、致死的主要原因之一。DPN发病机制复杂,自身免疫在其中可能起重要作用[2]。随着年龄增长,机体免疫功能发生调整,而老年DPN患者免疫系统的改变情况尚不清楚。本研究拟采用流式细胞技术检测CD4+CD25+Foxp3+调节性T细胞(Treg)在老年DPN患者外周血中的比例,探讨其与老年患者DPN的关系及可能的临床意义。
1 资料和方法 1.1 一般资料选择2013年1月至2014年1月在长征医院就诊的初诊老年T2DM患者40例,根据2010年中国T2DM防治指南诊断标准,将患者分为DPN组20例,男性10例、女性10例,平均年龄(71.0±4.6)岁(62~77岁),病程(7±3)年;T2DM无并发症组(T2DM组)20例,男性10例、女性10例,平均年龄(69.0±4.9)岁(61~76岁),病程(3.0±2.5)年;对照组20例为长征医院的健康体检者(CON组),男性10例、女性10例,平均年龄(71.0±4.3)岁(61~77岁)。所有对象均排除糖尿病肾病、心脑血管病变、周围血管病等,排除糖尿病急性并发症,排除自身免疫性病变及其他内分泌代谢疾病,排除感染、过敏反应,无严重肝、肾功能损害。本研究通过了长征医院医学伦理学委员会审核批准,并获得患者知情同意。
1.2 方法 1.2.1 一般情况仔细询问病史、详细体格检查,包括血压、身高、体质量,计算体质指数(BMI)等,并做记录。
1.2.2 DPN量表评分采用密歇根糖尿病神经病变评分量表(Michigan diabetic neuropathy score,MDNS)和密歇根神经病变筛查量表(Michigan neuropathy screening instrument,MNSI)[3]对患者的症状和体征进行评价。
1.2.3 实验室检查单克隆抗体抗CD4 FITC、CD25 APC和各阴性对照IgG均为美国Becton Dickinson(BD)公司产品;抗Foxp3 PE单抗和染色缓冲液为美国eBioscience公司产品。应用美国BD公司的Accuri C6流式细胞仪进行检测,分析软件为Cell Quest。
各组受试者近2个月内未服用过不明成分中药、乙醇及免疫调节药物,空腹6 h后于清晨8:00时,应用EDTA K2抗凝负压真空采血管采集肘正中静脉血2 mL,混匀,室温保存。标本在1 h内处理。具体步骤如下:取2 mL全血,1∶1 PBS稀释;取复温后的人淋巴细胞分离液3 mL,置于离心管;将4 mL稀释后的血液缓铺于淋巴细胞分离液上;1 500 r/min(离心半径为15 cm)离心30 min,取中段白色淋巴细胞层;加PBS 2 mL后,1 500 r/min(离心半径为15 cm)离心10 min,去上清,加300 μL DMEM培养液,加入CD4 FITC、CD25 APC标记抗体;加4℃预冷的PBS 2 mL洗2遍,1 500 r/min(离心半径为15 cm)离心5 min,弃上清;旋涡震荡重悬细胞后加入1 mL新鲜制备的固定/破膜剂(1∶3稀释),再次旋涡混匀,4℃避光孵育60 min;加入破膜剂缓冲液(1∶10稀释)2 mL孵育20 min,离心、弃上清;洗涤细胞;加入2 μL正常鼠血清,避光4℃孵育15 min;加入5 μL Foxp3 PE标记的抗体,混匀,4℃避光孵育45 min;用2 mL破膜剂缓冲液洗2遍,分别离心弃上清,加入0.5 mL PBS,混匀。取分离好的外周血单核细胞(peripheral mononuclear blood cell,PMBC)上流式细胞仪进行检测。
1.3 统计学处理采用SPSS 13.0统计软件,正态分布的计量资料以 x ±s 表示,进行方差齐性检验,多组间比较采用单因素方差分析,多组间两两比较采用SNK检验,检验水准(α)=0.05。Treg细胞比例与MNSI、MDNS评分的相关性采用Pearson相关分析。
2 结 果 2.1 基线资料的比较结果(表 1)显示:各组间年龄、性别比例、BMI、腰臀比(WHR)、低密度脂蛋白胆固醇(LDL c)、促甲状腺激素(TSH)等水平差异均无统计学意义;DPN组与T2DM组糖化血红蛋白(HbA1c)水平高于CON组(P<0.05),但DPN组与T2DM组间HbA1c水平差异无统计学意义。
| 表 1 各料的对比 |
流式细胞仪检测结果(图 1)显示:DPN组和T2DM组患者外周血CD4+CD25+Foxp3+ Treg细胞比例较CON组下降(P<0.05),且DPN组较T2DM组患者亦下降(P<0.05)。
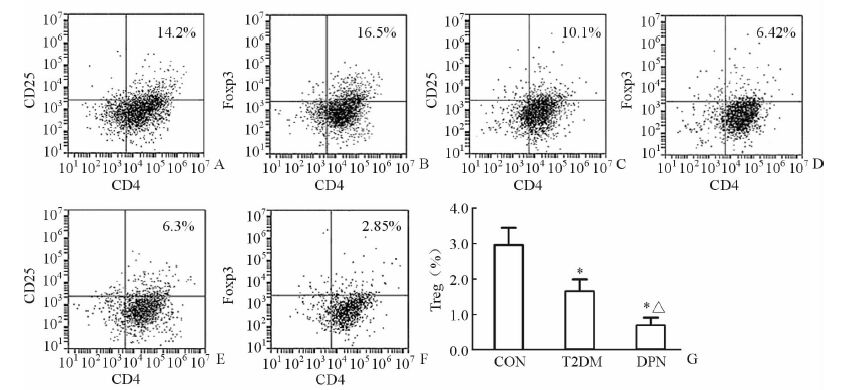 |
图 1 各组外周血中Treg细胞比例的比较 A、B: 健康对照组(CON); C、D: 2型糖尿病无并发症(T2DM); E、F: 糖尿病周围神经病变(DPN); G: 统计分析结果,*P<0.05与CON组比较; △P<0.05与T2DM组比较; n=20,x ±s |
结果显示:DPN组外周血CD4+CD25+Foxp3+ Treg细胞比例与MNSI评分(5.9±1.69)呈负相关,但差异无统计学意义(r=-0.208,P=0.19),而与MDNS评分(22.6±6.72)呈负相关,并且差异有统计学意义(r=-0.399,P=0.041)。
3 讨 论CD4+CD25+ Treg细胞是调控机体免疫反应的重要T细胞功能亚群,可通过主动调节的方式抑制自身反应性T细胞的活化与增殖,对维持自身免疫耐受和避免免疫过度损伤机体有重要意义。CD4+CD25+Foxp3+ Treg细胞数量上的增高或降低都可能导致机体平衡被打破,免疫功能紊乱,从而导致疾病发生。近年来研究表明,CD4+CD25+ Treg细胞在风湿性关节炎、系统性红斑狼疮、重症肌无力、病毒性肝炎疾病中发挥重要致病作用[4, 5, 6]。
在机体衰老的过程中,免疫系统进行性减退是其重要生理变化之一。随着年龄增长,Treg细胞的数量和功能会发生变化,而这种变化可能参与了老年人疾病的发生、发展。CD4+CD25+ Treg细胞表达多种表面分子,Foxp3是目前公认的CD4+CD25+ Treg细胞的特异性标志。Zhao等[7]研究发现,与幼鼠相比,老龄小鼠胸腺中CD4+CD25+Foxp3+ Treg细胞数量显著下降,但其较胸腺CD4单阳性细胞的比例增加,说明相对于胸腺中其他细胞,CD4+CD25+Foxp3+ Treg细胞更耐受衰老。有关人Treg细胞与衰老的研究亦显示,老年人与青年人外周血Treg细胞数量水平相似,而CD4+CD25+Foxp3+ Treg比例显著降低[8]。
糖尿病是一种以高血糖为特点的常见慢性病,T2DM患者的胰岛素合成、分泌、作用缺陷破坏了糖稳态,可能出现高血糖、糖毒性及糖尿病并发症[9]。除了遗传、环境因素外,越来越多的证据提示免疫功能紊乱可能参与了T2DM的发病。Mahmoud等[10]发现,T2DM患者外周血中CD4+CD25+Foxp3+ Treg等T细胞数目减少,与本实验中老年T2DM患者CD4+CD25+Foxp3+ Treg比例与正常健康对照组相比降低结果一致,提示免疫功能紊乱与T2DM的发生、发展有关。
糖尿病及其慢性并发症的发生发展与慢性免疫和炎症反应密切相关[11]。Zhang等[12]研究表明,外周血CD4+CD25+ Treg细胞比例在T2DM肾病并发症患者中显著减少,与糖尿病肾病的病情进展显著相关,提示低水平的CD4+CD25+ Treg细胞可能是糖尿病并发症发生发展重要病因。DPN患者周围神经典型病理改变为轴索变性和节段性脱髓鞘损害。Milicevic等[13]对糖尿病性神经病变患者的腓肠神经进行活检,在神经束膜和神经内膜处发现免疫球蛋白IgG、IgM和补体沉积,证实糖尿病时神经组织自身免疫性损伤的原因可能与高血糖引起神经血管屏障破坏,导致机体对某些神经组织产生免疫反应有关。本课题组前期研究亦显示,DPN患者周围神经存在T淋巴细胞浸润,亦提示其发生发展可能与免疫紊乱有一定的关系[14]。
本研究结果证实,老年DPN患者外周血CD4+CD25+Foxp3+ Treg细胞水平明显低于单纯2型糖尿病患者及健康对照者,且CD4+CD25+Foxp3+ Treg细胞比例与DPN病情评分负相关。我们推测,随着机体衰老,高糖环境加重了免疫系统功能异常,易诱发并发症。CD4+CD25+Foxp3+ Treg细胞的持续减少可能在DPN病变的发生和加重过程中发挥重要作用。然而,本研究尚有一定的局限性,需要在今后的研究中扩大样本量,探讨糖尿病不同病程、糖尿病神经病变亚组(特别是痛性神经病变作为临床关注的重点之一)以及性别差异与CD4+CD25+Foxp3+ Treg细胞水平的关系,进一步揭示CD4+CD25+Foxp3+ Treg细胞在老年DPN中的作用,为临床应用提供理论基础。
随着人口老龄化,机体免疫系统衰老到一定程度,老年人患病概率大大增加。T2DM患者易出现多种代谢紊乱和免疫功能异常,老年T2DM患者外周血CD4+CD25+Foxp3+ Treg细胞比例显著下降,诱发持续存在的轻度慢性炎症及免疫功能异常加重,导致患者并发周围神经病变的危险性显著增加。因此,对老年T2DM患者免疫功能监测和调节应予重视,对外周血CD4+CD25+Foxp3+ Treg细胞比例的监测有助于对糖尿病及其慢性并发症,尤其是DPN做出早期诊断和准确预测。通过研究调控CD4+CD25+Foxp3+ Treg细胞比例的机制,对今后探索DPN治疗策略和方法提供了有益的启迪。调节老年DPN患者体内Treg水平的平衡,以改善机体免疫炎症状态,对最终实现防治DPN发生发展的目的有重要意义。
| [1] | Yang W, Lu J, Weng J, Jia W, Ji L, Xiao J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362: 1090-1101. |
| [2] | Tang W, Lv Q, Chen X F, Zou J J, Liu Z M, Shi Y Q. CD8+ T cell-mediated cytotoxicity toward Schwann cells promotes diabetic peripheral neuropathy[J]. Cell Physiol Biochem, 2013,32: 827-837. |
| [3] | Feldman E L, Stevens M J, Thomas P K, Brown M B, Canal N, Greene D A. A practical two-step quantitative clinical and electrophysiological assessment for the diagnosis and staging of diabetic neuropathy[J]. Diabetes Care, 1994, 17: 1281-1289. |
| [4] | Haque M, Fino K, Lei F, Xiong X, Song J. Utilizing regulatory T cells against rheumatoid arthritis[J].Front Oncol, 2014, 4: 209. |
| [5] | Xu W H, Zhang A M, Ren M S, Zhang X D, Wang F, Xu X C, et al. Changes of Treg-associated molecules on CD4+CD25+Treg cells in myasthenia gravis and effects of immunosuppressants[J]. J Clin Immunol,2012, 32: 975-983. |
| [6] | Zhai N, Chi X, Li T, Song H, Li H, Jin X, et al. Hepatitis C virus core protein triggers expansion and activation of CD4+CD25+ regulatory T cells in chronic hepatitis C patients[J].Cell Mol Immunol,2014 Dec 22. doi: 10.1038/cmi.2014.119. [Epub ahead of print] |
| [7] | Zhao L, Sun L, Wang H, Ma H, Liu G, Zhao Y. Changes of CD4+CD25+Foxp3+ regulatory T cells in aged BALB/c mice[J]. J Leukoc Biol,2007, 81:1386-1394. |
| [8] | Chatila T A. Role of regulatory T cells in human diseases[J].J Allergy Clin Immunol,2005, 116: 949-959. |
| [9] | Yamamoto M, Yamaguchi T, Yamauchi M, Kaji H, Sugimoto T. Diabetic patients have an increased risk of vertebral fractures independent of BMD or diabetic complications[J]. J Bone Miner Res,2009,24:702-709. |
| [10] | Mahmoud F, Al-Ozairi E. Inflammatory cytokines and the risk of cardiovascular complications in type 2 diabetes[J].Dis Markers,2013,35:235-241. |
| [11] | Bour-Jordan H, Salomon B L, Thompson H L, Szot G L, Bernhard M R, Bluestone J A. Costimulation controls diabetes by altering the balance of pathogenic and regulatory T cells[J]. J Clin Invest,2004, 114: 979-987. |
| [12] | Zhang C, Xiao C, Wang P, Xu W, Zhang A, Li Q, et al. The alteration of Th1/Th2/Th17/Treg paradigm in patients with type 2 diabetes mellitus: relationship with diabetic nephropathy[J]. Hum Immunol,2014,75: 289-296. |
| [13] | Milicevic Z,Newlon P G,Pittenger G L,Stansberry K B,Vinik A I. Anti-ganglioside GM1 antibody and distal symmetric "diabetic polyneuropathy" with dominant motor features[J].Diabetologia,1997, 40: 1364-1365. |
| [14] | 汤 玮, 闾 倩, 梁 翠, 宋 艳, 邹俊杰, 刘志民, 等. 高糖激活p38丝裂原活化蛋白激酶信号通路诱导CD8+ T淋巴细胞表达辅助性T淋巴细胞1型趋化因子受体3[J].上海医学, 2013, 36: 438-440. |
 2015, Vol. 36
2015, Vol. 36


