2. 第二军医大学基础部生物物理学教研室, 上海 200433
2. Department of Biophysics, School of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
近年来,随着超声诊断应用范围的扩展,超声诊断仪输出功率不断提高,而关于超声安全性研究也逐渐成为超声应用基础研究的热点。由于超声在产科检测应用的常规化及在不同孕期应用的广泛化,且胚胎组织对超声辐射的敏感性很高,控制产科超声剂量的重要性不容忽视[1]。以往研究主要聚焦于多普勒超声对某一孕龄胚胎的潜在影响[2, 3],缺乏对不同孕期胎鼠影响的研究。因此,本研究主要探讨相同超声辐照条件对不同孕期胎鼠脑组织超微结构的影响,从而为产科多普勒超声的临床应用提供指导。
1 材料和方法 1.1 动物来源及分组选择健康成熟SD大鼠60只(第二军医大学动物实验中心提供),雄性12只,雌性48只,体质量300~350 g。按雌雄鼠4∶1比例合笼饲养,第2天起每日检查阴栓及阴道涂片,镜检到有活性精子的SD大鼠记录为受孕0 d,以此推算孕龄。根据大鼠孕龄将孕鼠分为3组:孕期12、15、18 d组(n=8),各组大鼠再按是否接受辐照分为两个亚组,即实验组和对照组。
1.2 仪器来源及孕期大鼠的彩超辐照彩超仪器使用日立公司PREIRUS型彩色电脑声像仪,EUP LTM4探头,二维频率5.0 MHz,组织热指数(Tis)=0.4,机械指数(Micd)=1.2。达到孕期孕鼠用异氟烷麻醉后固定,使用脱毛膏脱毛,下腹部浸透耦合剂,超声探头在孕鼠子宫体表投影区按照既定时间分别进行滑行辐照30 min,对照组进行假辐照。
1.3 脑组织的获取及超微结构的观察各组大鼠在辐照24 h后,使用异氟烷气体麻醉,麻醉满意后,将孕鼠固定试验台上,剖宫取胎,每只孕鼠随机选取2只胎鼠,迅速取出胎鼠脑组织,经2%戊二醛初期固定后,将脑组织切成小块(1 mm×1 mm×1 mm),经0.1 mol/L PBS溶液漂洗过夜,1%锇酸后固定。梯度乙醇、丙酮脱水,浸透后用环氧树脂Epon812包埋,聚合,用超薄切片机(Leica UC6,德国)进行切片,经铀 铅双重染色后,在透射电镜(H 7650,日本)下观察细胞超微结构并记录观察结果。
2 结 果 2.1 超声辐照对神经元胞核超微结构的影响由于不同孕期对照组之间超微结构并没有差异,因此本研究选用孕期18 d对照组的观察结果与各实验组进行比较。电镜下可见孕期18 d对照组胎鼠神经元细胞中细胞核呈近似圆形,形状较规则,细胞核电子密度较均匀(图 1A);孕期12 d实验组胎鼠脑组织神经元胞核结构呈轻度不规则(图 1B);孕期15 d实验组胎鼠脑组织神经元胞核不规则更加明显(图 1C);孕期18 d实验组胎鼠脑组织神经元胞核呈明显不规则形状(图 1D)。随着孕期的延长,细胞核不规则更加明显,且高孕龄胎鼠细胞核呈现不规则形状的比例高于低孕龄胎鼠。

|
图 1 超声辐射对神经元细胞中细胞核超微结构的影响 A: 孕期18 d对照组; B:孕期12 d实验组; C : 孕期15 d实验组; D: 孕期18 d实验组. 箭头示细胞核 |
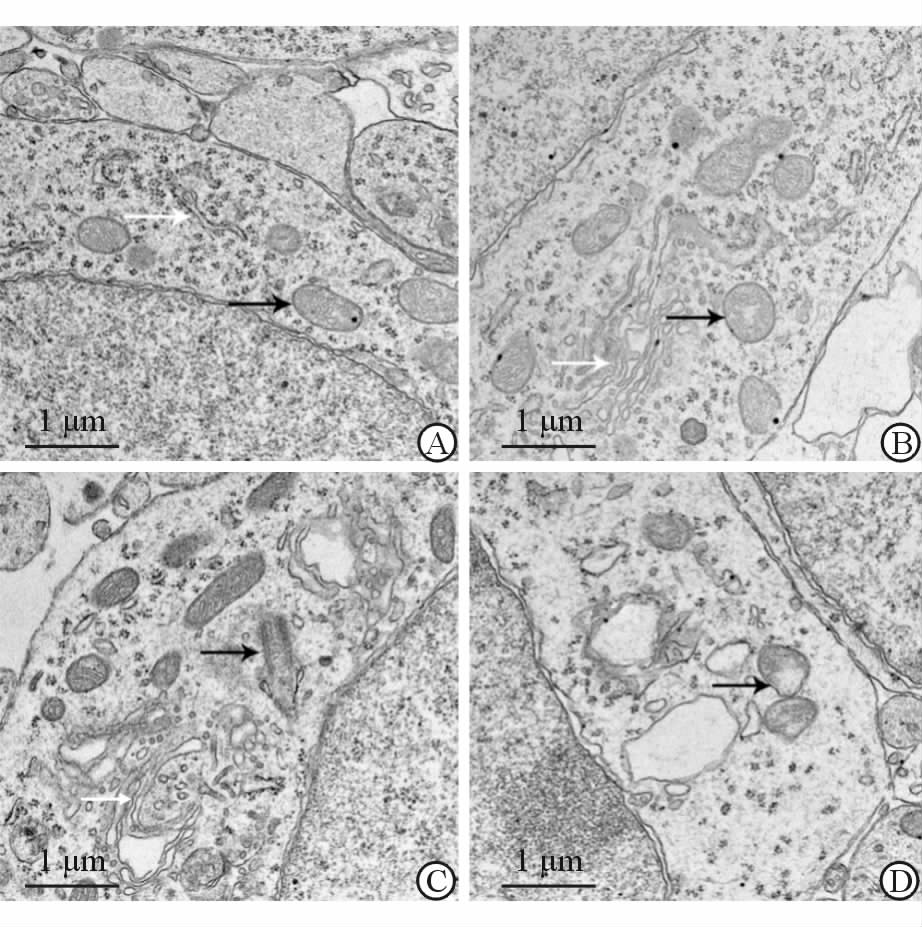
电镜下可见对照组线粒体结构正常,线粒体嵴清晰,无肿胀现象(图 2A)。实验组中,孕期12 d和15 d组大鼠脑组织可见部分线粒体嵴溶解现象(图 2B、2C)。图 2C中可见高尔基体肿胀,并且胞质中出现较小空泡。孕期18 d脑组织神经元大部分线粒体嵴出现溶解现象,并且胞质出现较大空泡,胞质电子密度降低(图 2D),提示胞质成分可能溶解。
|
图 2 超声辐照对神经元细胞中线粒体的影响 A: 孕期18 d对照组; B:孕期12 d实验组; C: 孕期15 d实验组; D: 孕期18 d实验组. 黑色箭头示线粒体,白色箭头示内质网 |
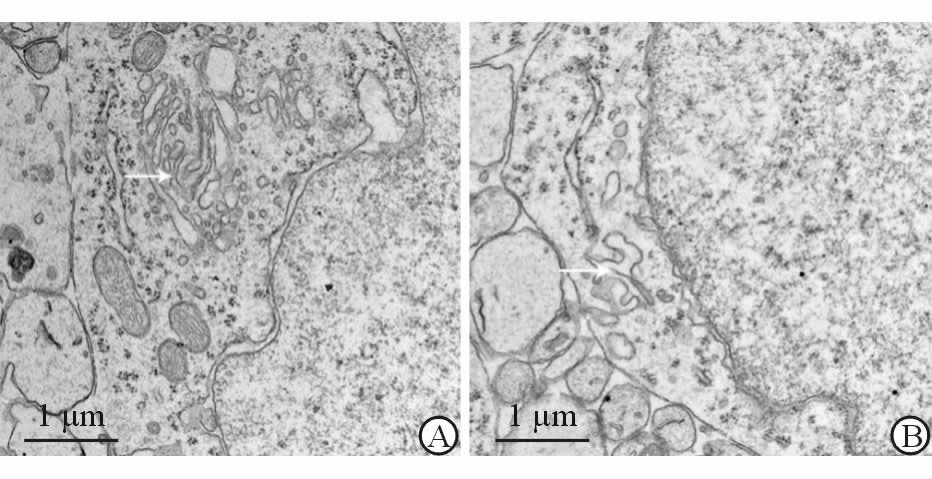
对照组内质网超微结构正常,没有出现肿胀等现象(图 2A)。孕期12 d实验组:脑组织神经元内质网未见明显异常(图 3A),但局部可见核间隙增宽现象。孕期15 d实验组:脑组织神经元内质网出现肿胀(图 2B),细胞局部也可见核间隙增宽现象,并且与孕期12 d实验组相比更加明显。孕期18 d实验组:内质网出现明显肿胀(图 3B),局部可见核间隙增宽现象。
|
图 3 超声辐照对神经元内质网超微结构的影响 A:孕期12 d实验组; B:孕期18 d实验组. 白色箭头示内质网 |
随着电子设备应用的广泛和人们健康意识的提高,对如何减少孕期辐射的关注度越来越高。但由于超声检查在产科应用的广泛性,超声应用的安全性一直是研究热点[4]。超声辐照超过一定时间可引起敏感组织的损伤,但由于现在对超声能量的控制,普通的形态学检查方法较难检测出超声对组织形态的损伤效应。因此,近年来多采用电镜检测超声对细胞超微结构的影响[2]。
超声生物学效应与超声剂量相关,不过因剂量表示的复杂性,超声对各种细胞、分子具体的量效关系仍未确定。普遍认为,超声强度越大及超声次数越多,照射时间越长,引起的生物学效应越严重[5]。赵晶等[2]对胎鼠大脑皮质神经元超声辐照的研究发现,单次照射组、重复照射组照射10 min 超微结构上并没有发生明显变化,而照射20 min、30 min超微结构发生明显变化,并且重复照射组比单次照射组超微结构变化更明显。免疫组化方法检测Fos 蛋白的表达也发现随着辐照时间的延长,其对细胞结构的影响越大[6]。在超声能量方面,美国FDA要求新型产科超声仪器必须显示MI及TI[7]。而近些年以来,随着技术不断取得进步,频谱多普勒超声、彩色多普勒超声、三维超声甚至四维超声技术已经在临床广泛应用,这些技术和传统的二维灰阶成像相比,输出功率大幅度提高,检查时间也相对延长。Whittingham[8]采用颅骨模型,发现应用不同超声技术所致的热效应有差异。结果表明:超声能量输出越高,对组织的危害越大,而实验也证明当温度上升超过2℃时会导致生长发育异常。
超声辐照主要通过以下方式对机体产生效应,从而造成组织细胞形态学改变:热效应、机械效应、空化效应[9, 10, 11, 12]。目前超声使用的主要是脉冲波,引起的瞬态温度上升在骨表面尤为明显[11]。超声引起的温度上升主要集中在浅表部位以及聚焦区,但是当声束轴上有骨组织,则最大温度上升将发生在骨附近,而胎儿的脑组织被颅骨包裹。因此在超声中脑组织对超声的敏感性会很高。Dalecki等[13]用超声脉冲波辐照孕18 d的大鼠(脉冲重复频率100 Hz,持续时间为10 ms,照射3 min),结果发现胎鼠脑出血的比例明显高于正常组。Suresh等[14]应用诊断级超声波辐照怀孕瑞士小鼠,分别在孕14 d和16 d时辐照30 min,结果显示产后发育标志和产后死亡率不受超声辐照影响,然而学习能力和记忆能力明显受损。
本研究主要采用电镜检测脑组织超微结构的变化,一方面是由于现在国际上对超声剂量的控制[15, 16, 17],形态学很难检测出组织形态损伤;另一方面是因为超微结构的检测能较好反映细胞超微结构的改变,提供更可信的证据。本研究结果显示,在诊断剂量超声辐照条件下照射30 min后,不同孕期胎鼠脑组织均存在细胞器超微结构改变。照射时间的延长及重复照射对胎鼠脑组织神经细胞超微结构的损伤逐渐加重[2],在其他方面也证实了超声的生物效应[18]。程颜苓等[6]用彩超辐照孕龄18 d胎鼠20 min以上,胎鼠大脑神经元凋亡明显增加,电镜检测胎鼠脑组织超微结构发现细胞核染色质边集、严重时凝聚成环状、线粒体不同程度肿胀等超微结构变化;超声辐照甚至可引起小鼠大脑神经元迁移[19, 20]。
本研究采用高频探头对孕鼠进行30 min辐照,实验结果发现孕龄越小超声对胎鼠影响越小,分析原因如下:(1)在以往研究超声对胎鼠脑部超微结构影响的实验中,使用的都是辐照强度较大的彩色频率,而本实验使用的是高频,能量相对较低,所以只是导致细胞器超微结构的改变,在细胞水平上并没有太大改变,在组织形态学上更没有发现明显改变,从检测结果中也可以看出神经细胞内染色质并没有明显的变化。(2)孕龄越小的胎鼠,其细胞代谢活性较高,细胞对损伤的修复能力较强,可能是导致其损伤较小的原因之一。
综上所述,本研究发现多普勒彩超辐照对不同孕期胎鼠脑组织中细胞器超微结构的影响不同,胎鼠孕期越早,相同的辐照对其影响越小,值得引起临床重视。
志谢: 第二军医大学长海医院超声科对本研究给予了支持和帮助,在此表示衷心感谢!
| [1] | Barnett S B, Maulik D; International Perinatal Doppler Society. Guidelines and recommendations for safe use of Doppler ultrasound in perinatal applications[J].J Matern Fetal Med,2001,10:75-84. |
| [2] | 赵 晶,段云友,贾华平,周 宁,曹铁生. 晚孕期彩超重复照射对胎鼠中枢神经P53蛋白表达及超微结构的影响[J].中国医学影像技术,2005,21:1169-1171. |
| [3] | 贾化平,段云友,赵 晶,周 宁,周海燕,曹铁生.中孕期彩超辐照对胎鼠肾脏P53蛋白表达的影响[J].中国临床医学影像杂志,2006,17:32-35. |
| [4] | 吴国旺,栗建辉,边怡超. 超声波生物学效应及产科超声检查的安全性[J].中国医疗设备,2013,28:43-48. |
| [5] | 周海燕,段云友,贾化平,赵 晶,周 宁. 孕期彩超辐照对胎鼠肾脏的影响[J].中国医疗前沿,2012,7:27-28. |
| [6] | 程颜苓,段云友,曹铁生,田 蓉. 诊断剂量超声与胎鼠中枢神经元的凋亡[J].中华超声影像学杂志, 2001,10:624-626. |
| [7] | Miller M W, Brayman A A, Abramowicz J S. Obstetric ultrasonography: a biophysical consideration of patient safety--the "rules" have changed[J].Am J Obstet Gynecol,1998,179:241-254. |
| [8] | Whittingham T A. Estimated fetal cerebral ultrasound exposures from clinical examinations[J].Ultrasound Med Biol,2001,27:877-882. |
| [9] | Palmeri M L, Frinkley K D, Nightingale K R. Experimental studies of the thermal effects associated with radiation force imaging of soft tissue[J].Ultrason Imaging,2004,26:100-114. |
| [10] | Myers M R. Transient temperature rise due to ultrasound absorption at a bone/soft-tissue interface[J].J Acoust Soc Am,2004,115:2887-2891. |
| [11] | Vykhodtseva N, McDannold N, Martin H, Bronson R T, Hynynen K. Apoptosis in ultrasound-produced threshold lesions in the rabbit brain[J].Ultrasound Med Biol,2001,27:111-117. |
| [12] | 冯 若. 超声生物效应及诊断超声的安全阈值剂量[J]. 中国超声医学杂志, 2000,16:193-195. |
| [13] | Dalecki D, Child S Z, Raeman C H, Cox C. Hemorrhage in murine fetuses exposed to pulsed ultrasound[J].Ultrasound Med Biol,1999,25:1139-1144. |
| [14] | Suresh R, Ramesh Rao T, Davis E M, Ovchinnikov N, Mc Rae A. Effect of diagnostic ultrasound during the fetal period on learning and memory in mice[J].Ann Anat,2008,190:37-45. |
| [15] | Stratmeyer M E, Greenleaf J F, Dalecki D, Salvesen K A. Fetal ultrasound: mechanical effects[J].J Ultrasound Med,2008,27:597-605. |
| [16] | Chervenak F A, Chervenak J L. Medical legal issues in obstetric ultrasound[J].Clin Perinatol, 2007,34:299-308, vi. |
| [17] | American Institute of Ultrasound in Medicine. AIUM practice guideline for the performance of obstetric ultrasound examinations[J]. J Ultrasound Med, 2013, 32:1083-1101. |
| [18] | 王 莹,李智刚,赵艳晶,冯克俭,李文媛,孙 平,等. 低强度脉冲超声对大鼠糖尿病周围神经病坐骨神经p53表达的影响[J].牡丹江医学院学报, 2014,35:9-10. |
| [19] | Ang E S Jr, Gluncic V, Duque A, Schafer M E, Rakic P. Prenatal exposure to ultrasound waves impacts neuronal migration in mice[J].Proc Natl Acad Sci USA,2006,103:12903-12910. |
| [20] | 付岩松,任春玲,王军艳,栗建辉,张 雷.诊断用实时三维超声对晚孕胎鼠大脑皮层神经细胞超微结构的影响[J].中国医疗设备,2013,28:24-27. |
 2015, Vol. 36
2015, Vol. 36


