骨关节退变(osteoarthrosis,OA)和骨质疏松症(osteoporosis,OP)是老年人群,特别是绝经妇女面临的健康威胁[1]。卵巢切除大鼠在骨量减少的同时发生腰椎间盘退变,提示绝经后骨质疏松也是促进骨关节退变发生的高危因素。研究表明,降钙素和雌激素对双侧卵巢切除大鼠均具有抑制骨量流失和延缓腰椎间盘退变的作用[2, 3, 4];尼尔雌醇则可通过促进大鼠骨组织中Ⅰ型胶原蛋白提高大鼠骨密度、改善骨质量[5]。
阿仑膦酸钠作为一种氨基二膦酸盐类药物,具有抑制破骨细胞活性,减少骨量流失的作用,已被证实能改善骨关节退变[6, 7],并已广泛应用于骨质疏松症的治疗。奈立膦酸钠的结构与阿仑膦酸钠相似,同属于氨基二膦酸盐,二者结构差异在于侧链中甲基数量的不同[8]。奈立膦酸钠在骨组织相关疾病中也有一定的功效,其对成骨不全症患儿进行脊椎矫正的同时不会导致颌骨坏死[9, 10];在意大利奈立膦酸钠用于治疗成骨不全症和佩杰特病(变形性骨炎)等疾病[11];适量的奈立膦酸钠在临床上有缓解急性Ⅰ型局部疼痛综合征的功效,并且能提高地中海贫血症患者骨密度并减轻疼痛[12, 13]。
但目前尚未见关于奈立膦酸钠对卵巢切除大鼠腰椎间盘退变影响的文献报道。本研究首先建立双侧卵巢切除大鼠模型,再对其进行药物干预,并采用骨组织形态计量学、生物力学性能测试以及分子生物学等研究方法,评价奈立膦酸钠对双侧卵巢切除大鼠腰椎间盘退变的影响,为将其进一步开发为治疗腰椎间盘退变的潜在药物提供初步的数据支持。
1 材料和方法 1.1 动物分组及处理3个月龄雌性SD大鼠30只,购自上海医科大学实验动物中心,体质量210~230 g,随机分为3组:假手术组(Sham组),双侧卵巢切除(ovariectomy,OVx)+安慰剂组(OVx+PBO组)和双侧卵巢切除+奈立膦酸钠组(OVx+N组)。OVx+PBO组和OVx+N组大鼠进行腹腔注射麻醉(1%戊巴比妥钠,40 mg/kg),在无菌条件下行背部肋下入路双侧卵巢切除,术后正常饲养满1周后开始用药;Sham组大鼠卵巢暴露不切除。OVx+N组皮下注射奈立膦酸钠(10 μg/kg),每周2次,持续6个月,OVx+PBO组注射相同剂量的安慰剂。6个月后处死所有大鼠并取标本。在处死前10 d和4 d,大鼠皮下注射30 mg/kg盐酸四环素和6 mg/kg钙黄绿素作双荧光标记。
1.2 骨密度测定切取大鼠第3腰椎(L3)和第4腰椎(L4),采用小物体模式扫描,双能X线骨密度仪(Norland-XR36,U.S.)测量大鼠L3、L4脊柱节段骨密度。
1.3 骨组织形态计量学检测分离L1,于70%乙醇中固定,梯度乙醇脱水,乙醇和丙酮混合液(1∶1,V/V)脱脂,用甲基丙烯酸甲酯包埋后,硬组织切片机(Leica SM 2000R,德国)制备5 μm和8 μm切片,5 μm切片采用Masson-Goldner Trichrome观察骨静态指标,再采用H-E染色观察破骨细胞数;非染色的8 μm切片用以动态观察组织形态计量学荧光双标记,在荧光显微镜下,沉积在骨表面的四环素荧光呈黄色,沉积在骨表面的钙黄绿素荧光显绿色,可用来观察骨表面矿化程度及矿化沉积率,反映成骨细胞活性。然后用半自动图像数字化分析仪(Nikon,日本)对骨组织作静态和动态测量及计算。
骨组织形态计量学静态参数:骨小梁相对体积、骨小梁厚度、骨小梁分离度;动态参数:矿化沉积率以及单位骨小梁面积上的破骨细胞数。
1.4 生物力学性能测试分离L2,去除附着的肌肉和软组织,将磨制好的腰椎于生物力学测试机(Shimadzu AG-IS,日本)进行生物力学性能测试。压缩速度为1 mm/min,直至椎体断裂,检测指标包括:极限负荷(maximum load),屈服应力(yield stress),极限应力(maximum stress)及弹性模量(elastic modulus)。
1.5 椎间盘组织学评分将L5节段在10%中性缓冲甲醛液中固定,甲酸脱钙,正中矢状面切开,石蜡包埋,制备5 μm切片进行Collagen van Gieson (VG)染色。显微镜下观察该脊柱节段的组织形态。参照椎间盘组织学评分系统[14]对大鼠L5腰椎间盘退变程度进行评分,主要以大鼠椎间盘髓核、纤维环和骨赘的形态学退变程度进行评分,椎间盘评分为这3项得分的总和。
1.6 椎间盘高度和软骨终板厚度的测量椎间盘高度:采用病理组织学方法检测各组大鼠L6椎间盘高度,测量标本为VG染色切片,测量范围为椎间盘的头侧生长板至尾侧生长板间的区域,选取3个点进行测量,取平均值进行统计学分析。
软骨终板厚度:采用病理组织学方法检测各组大鼠L6椎体软骨终板厚度。VG染色石蜡切片。检测范围为头侧生长板至软骨终板与髓核交接之间的范围。将终板10等分,测量每一点的软骨终板厚度,求平均值进行统计学分析。
1.7 骨组织相关基因的蛋白表达测定细胞裂解法提取总蛋白,Folin-酚试剂法测定蛋白浓度;100 μL样品加入等体积缓冲液,SDS-PAGE凝胶电泳,PVDF膜印迹。加入一抗羊抗TRPV5多克隆抗体(Santa Cruz,美国,1∶800)和二抗碱性磷酸酶标记的兔抗羊IgG(北京中山生物公司,1∶1 200),室温下分别孵育2 h,DBA显色法显色。采用凝胶成像系统成像。使用Scion Image软件对蛋白电泳带进行灰度值分析,以β-actin作为内参蛋白,通过目标蛋白灰度值/β-actin灰度值来评价目标基因的相对蛋白表达水平。
1.8 骨组织相关基因转录水平的测定通过real-time RT-PCR评价大鼠骨组织中Ⅰ型胶原(COL-Ⅰ)、Ⅱ型胶原(COL-Ⅱ)、基质金属蛋白酶1(MMP-1)、基质金属蛋白酶3(MMP-3)以及基质金属蛋白酶13(MMP-13)的mRNA表达情况。参照高容量cDNA反转录试剂盒(Life Technologies,NY)说明书中所述的方法进行反转录,并取1 μL cDNA产物进行PCR扩增反应。引物序列见表 1。
|
|
表 1 基因的正向和反向引物序列 Tab 1 Sequences of forward (Fw) and reversed (Rv) primers designed for the genes |
采用实时荧光定量PCR仪(Eppendorf,NY)进行扩增反应,反应条件如下:预变性94℃ 2 min;变性94℃ 30 s,退火56℃ 1 min,延伸72℃ 30 s,30个循环;最后延伸72℃ 7 min;储存4℃。
PCR产物检测用12%聚丙烯酰胺凝胶进行电泳分析,溴乙啶染色10 min,应用EC3凝胶成像分析系统(Ultra-Violet Products,美国)拍摄扩增条带。同时使用Scion Image软件对目的条带进行光密度峰值下的总灰度分析,所得数值与相应内标物β-actin灰度值的比值即为mRNA的相对含量。
1.9 统计学处理采用SPSS 11.0统计软件进行统计学分析。数据均以 x±s 表示,利用Student’s t检验比较各组间差异,检验水准(α)为0.05。
2 结 果 2.1 骨密度测定结果(表 2)显示:OVx+PBO组大鼠椎体骨密度低于Sham组(P<0.05);OVx+N组大鼠椎体骨密度低于Sham组,但差异无统计学意义;OVx+N组大鼠椎体骨密度高于OVx+PBO组(P<0.05)。
|
|
表 2 各组大鼠椎体骨密度 Tab 2 Bone mineral density values of vertebral body in the three groups |
结果(表 3)显示:Sham组骨小梁相对体积、骨小梁厚度大于OVx+PBO组和OVx+N组(P<0.05);OVx+N组骨小梁相对体积、骨小梁厚度大于OVx+PBO组(P<0.05)。OVx+PBO组和OVx+N组骨小梁分离度均高于Sham组(P<0.05),OVx+PBO组骨小梁分离度又高于OVx+N组(P<0.05)。与OVx+PBO组相比,OVx+N组矿化沉积率和破骨细胞数较低(P<0.05)。
|
|
表 3 各组大鼠骨形态计量学指标 Tab 3 Bone histomorphometry assay in the three groups |
结果(表 4)显示:OVx+PBO组大鼠L2椎体的极限负荷、屈服应力、极限应力和弹性模量以及OVx+N组大鼠椎体极限应力低于Sham组(P<0.05);OVx+N组大鼠椎体的极限负荷、屈服应力、极限应力和弹性模量高于OVx+PBO组(P<0.05)。
|
|
表 4 各组大鼠椎体生物力学性能 Tab 4 Biomechanical properties of vertebral body in the three groups |
组织学观察结果(图 1)显示:Sham 组椎间盘结构(包括纤维环、髓核以及骺板等)较正常,纤维环结构排列整齐、紧密,髓核含有大量的脊索细胞,黏变程度低且软骨终板排列规律。OVx+PBO组骺板和软骨终板变薄,软骨细胞数量减少,排列紊乱,软骨终板和骺板钙化;髓核脊索细胞数量下降,出现大量团块状的软骨样细胞,髓核黏变;纤维环后部结构紊乱,间隙增宽。与Sham组相比,OVx+N组椎间盘髓核黏变,髓核中脊索细胞数量下降,但其髓核状态明显优于OVx+PBO组,软骨终板的钙化和后部纤维环的紊乱程度较OVx+PBO组低。
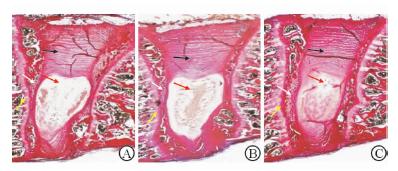
|
图 1 各组大鼠L5腰椎间盘组织形态学结果 Fig 1 VG staining of rat L5 lumbar intervertebral disc in each group A:Sham group; B: OVx+N group; C: OVx+PBO group. OVx: Ovariectomy; PBO: Placebo; N: Neridronate. Black arrows showed annulus fibrosus,red arrows showed nucleus pulposus,white arrow showed cartilage end plate,and yellow arrows showed epiphyseal plate. Original magnification: ×100 |
椎间盘组织学评分结果显示:大鼠L5腰椎间盘组织学评分OVx+PBO组(3.21±1.35)、OVx+N组(1.74±1.23)均高于Sham组(1.17±0.76),差异有统计学意义(P<0.05); OVx+PBO组大鼠L5腰椎间盘组织学评分高于OVx+N组(P<0.05)。
2.5 椎间盘高度和软骨终板厚度的测量 结果(表 5)显示:Sham组大鼠L6椎间盘高度高于OVx+PBO组(P<0.05),OVx+N组大鼠椎间盘高度高于OVx+PBO组(P<0.05),Sham组大鼠椎间盘高度高于OVx+N组,但差异无统计学意义。Sham组大鼠软骨终板厚度低于OVx+PBO组(P<0.05),OVx+N组大鼠软骨终板厚度低于OVx+PBO组(P<0.05),Sham组大鼠软骨终板厚度低于OVx+N组,但差异无统计学意义。|
|
表 5 大鼠L6椎间盘高度和软骨终板厚度 Tab 5 Measurement of the disc height index (DHI) and thickness of cartilage endplates(TCE) |
结果(图 2)显示:OVx+PBO组和OVx+N组大鼠骨组织COL-Ⅰ和COL-Ⅱ蛋白的表达量低于Sham组(P<0.05);OVx+PBO组和OVx+N组大鼠骨组织MMP-1、MMP-3及MMP-13的蛋白表达量高于Sham组(P<0.05);OVx+N组大鼠骨组织COL-Ⅰ蛋白表达量高于OVx+PBO组(P<0.05),COL-Ⅱ蛋白表达量高于OVx+PBO组但差异无统计学意义;OVx+N组MMP-1、MMP-3及MMP-13的蛋白表达量低于OVx+PBO组(P<0.05)。
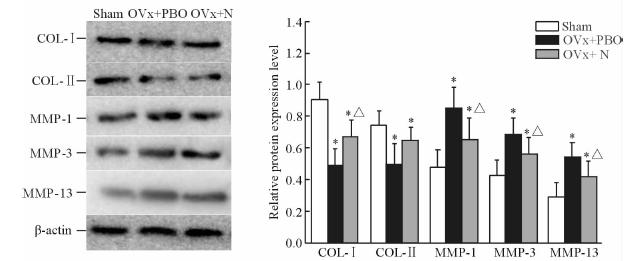
|
图 2 各组大鼠骨组织COL-Ⅰ、COL-Ⅱ、MMP-1、MMP-3及MMP-13蛋白相对表达量 Fig 2 Protein expression of COL-Ⅰ,COL-Ⅱ,MMP-1,MMP-3 and MMP-13 in bone of rats in each group OVx: Ovariectomy; PBO: Placebo; N: Neridronate; COL-Ⅰ: Collagen type Ⅰ; COL-Ⅱ: Collagen type Ⅱ; MMP-1: Matrix metalloproteinase-1; MMP-3: Matrix metalloproteinase-3; MMP-13: Matrix metalloproteinase-13. *P<0.05 vs Sham group; △P<0.05 vs OVx+PBO group. n=10,x±s |

|
图 3 各组大鼠骨组织COL-Ⅰ、COL-Ⅱ、MMP-1、MMP-3及MMP-13 mRNA相对表达量 Fig 3 mRNA expression of COL-Ⅰ,COL-Ⅱ,MMP-1, MMP-3 and MMP-13 in bone of rats in each group OVx: Ovariectomy; PBO: Placebo; N: Neridronate; COL-Ⅰ: Collagen type Ⅰ; COL-Ⅱ: Collagen type Ⅱ; MMP-1: Matrix metalloproteinase-1; MMP-3: Matrix metalloproteinase-3; MMP-13: Matrix metalloproteinase-13. *P<0.05 vs Sham group; △P<0.05 vs OVx+PBO group. n=10,x±s |
PBO组相比,OVx+N组大鼠骨密度和骨量指标升高,说明奈立膦酸钠对骨密度减退表现出明显抑制作用,但不能完全抑制骨量流失。有研究显示,椎间盘组织退化与骨小梁的结构密切相关[15],本研究中,OVx+N组大鼠骨小梁分离度较OVs+PBO组低(P<0.05),提示奈立膦酸钠在一定程度上有助于维持骨组织结构性能。
卵巢切除动物模型由于雌激素等其他卵巢激素缺乏导致成骨细胞和破骨细胞活力增强,骨吸收大于骨形成,从而引起骨量流失[16, 17]。矿化沉积率和破骨细胞数分别反映成骨细胞和破骨细胞的活性[18, 19],通过对骨形态计量学动态指标研究发现,奈立膦酸钠会导致成骨细胞和破骨细胞活性降低。结果说明经过奈立膦酸钠给药后,对切除卵巢引起的骨组织高转换状态具有一定的抑制作用,降低骨转换率,减少骨质流失[20]。成骨细胞能介导奈立膦酸钠对破骨细胞骨吸收的抑制作用,其作用机制可能是奈立膦酸钠与体内羟基磷灰石结合对成骨细胞产生影响,使成骨细胞分泌某种因子,作用于破骨细胞干扰其骨吸收作用;也可能与直接改变破骨细胞活性有关[21]。
极限负荷、屈服应力、极限应力和弹性模量指标反映骨组织的生物力学性能[22],切除双侧卵巢导致大鼠腰椎间盘退化以及骨组织生物力学性能降低[23, 24]。与OVx+PBO组相比,OVx+N组大鼠骨组织极限负荷、屈服应力、极限应力和弹性模量指标较优,表现出较好的生物力学性能。因此,奈立膦酸钠能促进大鼠骨组织生物力学性能提升。结合椎间盘组织学观察及评分结果,奈立膦酸钠有助于卵巢切除大鼠模型腰椎间盘整体性能提高。
与Sham组相比,OVx+N组椎间盘高度降低,可能是由骨密度降低所引起的椎体骨折导致;OVx+N组软骨终板增厚,可能与钙化相关,同时软骨终板增厚会引起椎间盘营养供应减少,加速椎间盘退变的进程[25]。但是OVx+N组椎间盘高度和软骨终板厚度优于OVx+PBO组,由此可知奈立膦酸钠能在一定程度上维持椎间盘高度,延缓软骨终板钙化程度,保持较优的椎间盘营养环境,从而达到抑制椎间盘退行性变的作用。
在腰椎间盘退变过程中,MMP-3可激活MMPs的前体[26],导致MMPs的表达有所升高[27, 28],从而促进MMP-1、MMP-3、MMP-13等合成。COL-Ⅰ和COL-Ⅱ是构成骨组织细胞外基质的重要蛋白质,有利于保持骨架完整性[29]。然而,COL-Ⅰ和COL-Ⅱ分别能被MMP-1和MMP-13裂解[30, 31],细胞外基质被降解,加速骨量流失。
在本研究中,卵巢切除大鼠模型的骨组织中COL-Ⅰ、COL-Ⅱ表达水平降低,同时MMP-1、MMP-3以及MMP-13表达水平上升。与OVx+PBO组相比,OVx+N组骨组织中MMP-1、MMP-3以及MMP-13的蛋白和mRNA表达水平较低,而COL-Ⅰ、COL-Ⅱ的蛋白和mRNA表达水平较高。由此可见,奈立膦酸钠可能通过抑制腰椎间盘退变的过程中MMPs的表达,降低MMP-1、MMP-3以及MMP-13等合成,进一步保持细胞外基质(COL-Ⅰ和COL-Ⅱ)的完整性,降低骨量的流失,提高骨组织营养供应环境,改善腰椎间盘退化状态。
综上所述,本研究结果表明奈立膦酸钠对去卵巢骨质疏松大鼠的治疗作用在于提高骨质量,减少骨质流失,提高生物力学强度,改善骨结构以及有效调控COL-Ⅰ、COL-Ⅱ、MMP-1、MMP-3、MMP-13表达水平,以提高骨的整体性能,进而改善腰椎间盘退化状态。
| [1] | 王子江,向 川.骨质疏松症与骨关节炎的相关性研究新进展[J].中国骨质疏松杂志, 2014, 20:310-314. |
| [2] | 张 蕾, 徐振华, 林顺新, 贾吉光, 陈 森, 郑晓佐. 雌激素在大鼠颈椎间盘退变中的作用[J]. 武汉大学学报: 医学版, 2009, 30: 788-790. |
| [3] | 刘彬彬, 张 柳, 田发明, 王文雅. 椎间盘退变动物模型及降钙素治疗的研究进展[J]. 中国修复重建外科杂志, 2014, 28: 1051-1054. |
| [4] | 王文雅, 张 柳, 汪 韬, 张祥宏, 张英泽. 降钙素治疗延缓卵巢切除大鼠腰椎间盘退变[J].解剖学杂志, 2008, 31: 158-161. |
| [5] | 朱志刚, 郭向阳, 张秀珍. 尼尔雌醇对去卵巢大鼠骨组织中Ⅰ型胶原代谢及组织蛋白酶K表达的影响[J].中原医刊, 2006, 33: 30-32. |
| [6] | Neogi T, Nevitt M C, Ensrud K E, Bauer D, Felson D T. The effect of alendronate on progression of spinal osteophytes and disc-space narrowing[J].Ann Rheum Dis,2008,67:1427-1430. |
| [7] | Luo Y, Zhang L, Wang W Y, Hu Q F, Song H P, Su Y L, et al. Alendronate retards the progression of lumbar intervertebral disc degeneration in ovariectomized rats[J].Bone, 2013,55:439-448. |
| [8] | Gatti D, Antoniazzi F, Prizzi R, Braga V, Rossini M, Tatò L, et al.Intravenous neridronate in children with osteogenesis imperfecta: a randomized controlled study[J].J Bone Miner Res,2005,20:758-763. |
| [9] | Semler O, Beccard R, Palmisano D, Demant A, Fricke O, Schoenau E, et al. Reshaping of vertebrae during treatment with neridronate or pamidronate in children with osteogenesis imperfecta[J].Horm Res Paediatr,2011,76:321-327. |
| [10] | Maines E, Monti E, Doro F, Morandi G, Cavarzere P, Antoniazzi F. Children and adolescents treated with neridronate for osteogenesis imperfecta show no evidence of any osteonecrosis of the jaw[J].J Bone Miner Metab,2012,30:434-438. |
| [11] | Gatti D, Rossini M, Viapiana O, Idolazzi L, Adami S.Clinical development of neridronate: potential for new applications[J].Ther Clin Risk Manag,2013,9:139-147. |
| [12] | Varenna M, Adami S, Rossini M, Gatti D, Idolazzi L, Zucchi F, et al. Treatment of complex regional pain syndrome type Ⅰ with neridronate: a randomized, double-blind, placebo-controlled study[J].Rheumatology (Oxford), 2013,52:534-542. |
| [13] | Forni G L, Perrotta S, Giusti A, Quarta G, Pitrolo L, Cappellini M D, et al. Neridronate improves bone mineral density and reduces back pain in β-thalassaemia patients with osteoporosis: results from a phase 2, randomized, parallel-arm, open-label study[J].Br J Haematol,2012,158:274-282. |
| [14] | Wang T, Zhang L, Huang C, Cheng A G, Dang G T. Relationship between osteopenia and lumbar intervertebral disc degeneration in ovariectomized rats[J].Calcif Tissue Int, 2004, 75:205-213. |
| [15] | Ding Y, Jiang J, Zhou J, Wu X, Huang Z, Chen J, et al. The effects of osteoporosis and disc degeneration on vertebral cartilage endplate lesions in rats[J].Eur Spine J, 2014,23:1848-1855. |
| [16] | 王 健,陶海荣.雌激素及相关化合物干预骨关节炎作用机制:关节保护与骨软骨细胞的修复[J].中国组织工程研究, 2014, 18: 5372-5376. |
| [17] | Lee E J, Kim J L, Kim Y H, Kang M K, Gong J H, Kang Y H. Phloretin promotes osteoclast apoptosis in murine macrophages and inhibits estrogen deficiency-induced osteoporosis in mice[J].Phytomedicine,2014,21:1208-1215. |
| [18] | 查丁胜, 陈建庭, 邓轩庚, 孙学刚, 佟 丽, 王建钧,等. 不同频率振动应变对成骨细胞增殖及分化能力的影响[J].中国骨质疏松杂志, 2008, 14: 303-307. |
| [19] | 汪春风, 林柏云, 李朝阳. 实验骨组织形态计量学参数分析与意义[J]. 广东解剖学通报, 1995, 17: 97-101. |
| [20] | 谢 肇, 李起鸿, 许建中, 孟 萍. BEMF对卵巢切除骨质疏松大鼠治疗作用的骨形态计量学研究[J]. 中国骨质疏松杂志, 2007, 13: 236-238. |
| [21] | 程志强, 尹 潍, 马通军, 樊继援.阿仑膦酸钠对兔破骨细胞功能的影响[J]. 基础医学与临床, 2002, 22: 417-421. |
| [22] | Ito M, Nishida A, Koga A, Ikeda S, Shiraishi A, Uetani M, et al. Contribution of trabecular and cortical components to the mechanical properties of bone and their regulating parameters[J].Bone, 2002, 31:351-358. |
| [23] | Wang Y X, Griffith J F, Ma H T, Kwok A W, Leung J C, Yeung D K, et al. Relationship between gender, bone mineral density, and disc degeneration in the lumbar spine: a study in elderly subjects using an eight-level MRI-based disc degeneration grading system[J].Osteoporos Int,2011,22:91-96. |
| [24] | de Almeida Jackix E, Cúneo F, Amaya-Farfan J, de Assunção J V, Quintaes K D. A food supplement of hydrolyzed collagen improves compositional and biodynamic characteristics of vertebrae in ovariectomized rats[J].J Med Food, 2010,13: 1385- 1390. |
| [25] | Magnier C, Boiron O, Wendling-Mansuy S, Chabrand P, Deplano V. Nutrient distribution and metabolism in the intervertebral disc in the unloaded state: a parametric study[J].J Biomech,2009,42:100-108. |
| [26] | 杨春花, 黄 烽. 炎性关节疾病与基质金属蛋白酶-3[J].军医进修学院学报, 2005, 26:147-149. |
| [27] | Le Maitre C L, Freemont A J, Hoyland J A. Human disc degeneration is associated with increased MMP 7 expression[J].Biotech Histochem,2006,81(4-6): 125-131. |
| [28] | 张小卫, 郭团茂, 刘 淼, 张银刚. 人颈椎间盘退变基因表达谱的研究[J]. 西安交通大学学报: 医学版, 2011, 32: 340-343. |
| [29] | Lee H S, Park S Y, Park Y, Bae S H, Suh H J. Yeast hydrolysate protects cartilage via stimulation of type Ⅱ collagen synthesis and suppression of MMP-13 production[J].Phytother Res, 2013, 27:1414-1418. |
| [30] | Kook S H, Jang Y S, Lee J C. Involvement of JNK-AP-1 and ERK-NF-κB signaling in tension-stimulated expression of type Ⅰ collagen and MMP-1 in human periodontal ligament fibroblasts[J].J Appl Physiol (1985), 2011,111:1575-1583. |
| [31] | 王淑静, 赵 敏, 娄玉钤, 张广辉,李 坚,赵幸熬. 健膝丸含药血清对 IL-1β 作用下兔关节软骨细胞 Type-Ⅱ Collagen、MMP-1、MMP-13蛋白表达的影响[J].风湿病与关节炎, 2014, 3: 17-20. |
 2015, Vol. 36
2015, Vol. 36


