2. 延安大学附属医院普通外科, 延安 716000
2. Department of General Surgery, Affiliated Hospital of Yan'an University, Yan'an 716000, Shaanxi, China
子宫绒毛叶状分割性平滑肌瘤伴发静脉内平滑肌瘤病又被称为子宫绒毛叶状水泡状静脉内平滑肌瘤病,是非常罕见的良性平滑肌瘤,指绒毛叶状分割性平滑肌瘤同时累及血管,具有静脉内平滑肌瘤病的特点[1, 2, 3]。2002年由Jordan等[1]首先报道,大体标本外观相似于绒毛叶状分割性平滑肌瘤,但显微镜检查发现累及血管。由于其不同寻常的外观易导致临床误诊误治,本研究以本院2014年诊断的1例患者为例,结合国内外文献,总结其临床诊治经验。
1 资料和方法 1.1 一般资料患者,女,42岁,于2014年11月3日入院,体检B超提示子宫形态失常,约15.8 cm×15 cm× 7.5 cm大小,轮廓清晰,正常肌壁回声基本消失,探究范围约10.6 cm×5.4 cm混合回声区,边界尚清,内回声不均匀,可见较强回声及散在无回声相见分布,突向右侧阔韧带内(图 1A)。彩色多普勒血流显像(CDFI)示:周边可见点线状血流信号,宫颈处探及数个大小不等无回声区,测较大直径约1.2 cm(图 1B);子宫下段见4 cm×3 cm占位,B超提示子宫肌瘤伴液化,遂入院行手术治疗。临床拟诊断子宫肉瘤。术中发现子宫如孕4个月大小,子宫右侧壁15 cm×13 cm的肌瘤样突起,质软,突向阔韧带内。子宫下段可见4 cm×3 cm肌瘤突起。临床医师发现肿瘤质软,与子宫平滑肌层分界不清,术中取小块组织行冷冻检查,冷冻诊断为子宫平滑肌瘤。因肌瘤与子宫肌层分离困难,遂行全子宫及右侧输卵管切除术,术后标本送病检。
 |
图 1 患者术前影像学检查及术后大体观 A:术前盆腔B超所见;B:术前盆腔彩色多普勒血流显像所见;C:术后全子宫及右侧输卵管整体观;D:术后标本切面可见囊腔内的灰白色突起 |
10%甲醛溶液固定标本,取材、脱水,常规石蜡包埋,切片,苏木精-伊红染色,光学显微镜下观察。同时行免疫组织化学法检测。免疫组织化学染色采用EnVision两步法,所有抗体均购自福州迈新生物技术开发有限公司。
2 结 果 2.1 大体标本观察全子宫加右侧输卵管切除标本,子宫体积15 cm×15 cm×7 cm,表面灰红光滑已剖开,肌壁见15 cm×13 cm×9 cm大小肌瘤,向浆膜外突起呈类圆形,有包膜,灰红质软似胎盘绒毛样外观(图 1C)。切面灰红,大部分实性呈结节状,质韧。部分区域呈囊性,质软,局部黏液样变性。子宫肌壁厚2~13 cm,肌壁似有破坏,并见肌壁内大小不等的腔隙,直径0.2~2 cm,腔隙间见大小不等的灰白色突起,切面质韧(图 1D)。子宫内膜厚0.2~0.4 cm,宫颈管长4 cm,宫颈外口直径3 cm,右侧输卵管长15 cm,直径0.4~0.7 cm,伞端清楚。
2.2 光学显微镜检查镜下肿瘤主要由分化良好的平滑肌细胞、大小不等呈丛状分布的血管组成,近浆膜处血管丛密度增高。血管壁多数较薄,管腔扩张,腔内充满血液,少数血管壁较厚,可见血管壁玻璃样变性或水肿。周围基质水肿明显,水肿液主要是无结构絮状嗜伊红蛋白样物质,其中水肿液将肿瘤细胞分割形成大小不一的细胞巢或宽窄不一的细胞索或构成大小不等的结节,缺乏经典型子宫平滑肌瘤的组织结构特点(图 2A)。平滑肌细胞交错散乱排布,稀疏分布于周围基质中,细胞形态与普通平滑肌瘤细胞形态相似。在肌层部分瘤结节交错在邻近正常的平滑肌层中表现出分割样(图 2B)。肿瘤组织向子宫壁内延续性生长,分割正常平滑肌细胞并与其之间存在狭长的裂隙。同时在子宫肌层的静脉血管内有形态良好的平滑肌增生,未见超出血管外。血管内增生的平滑肌形态为短梭形,核卵圆形,染色质细腻,无核仁或有隐约小核仁。细胞不具备异型性、核分裂像及凝固性坏死。子宫内膜呈分泌性改变。
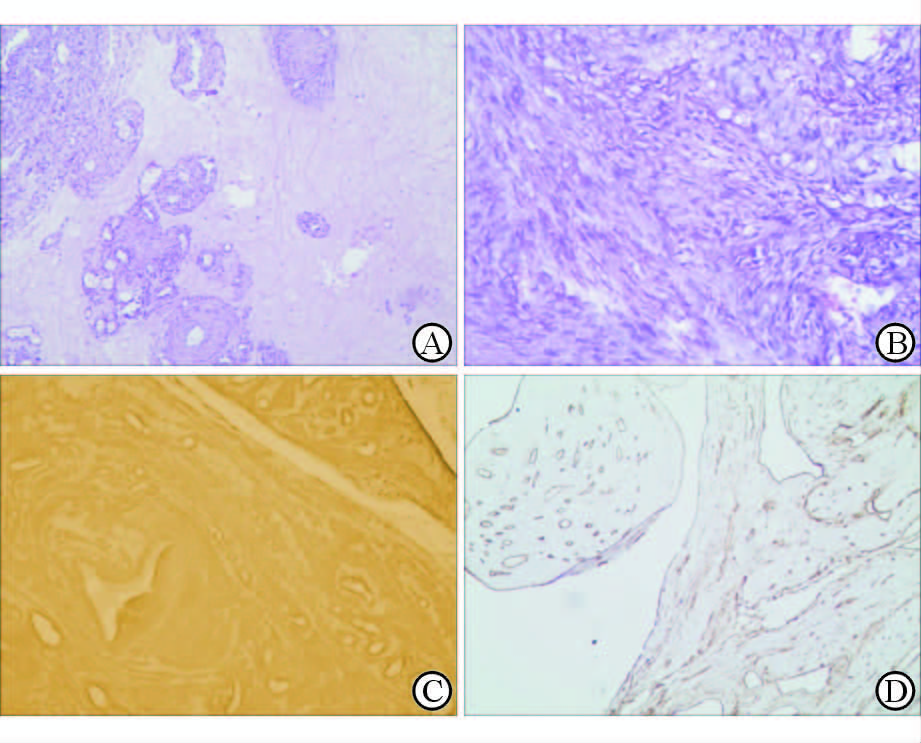 |
图 2 肿瘤组织H-E染色(A、B)及免疫组化染色(C、D)观察 A: H-E染色提示平滑肌瘤结节间水肿明显;B: H-E染色提示子宫肌层内瘤结节呈分割样;C:肿瘤组织平滑肌肌动蛋白免疫组化染色;D:血管壁内平滑肌瘤CD31免疫组化染色. Original magnification: ×100 |
应用免疫组织化学染色,肿瘤细胞阳性结果的为雌激素受体(ER)、孕激素受体(PR)、结蛋白(Desmin)、平滑肌肌动蛋白(SMA,图 2C);阴性为细胞角蛋白(CK)、CD10、Ki-67阳性表达<1%。应用CD31(图 2D) 和CD34两种抗体免疫组织化学染色,发现子宫肌层空白间隙表面有内皮细胞覆盖,即静脉管壁内有平滑肌瘤细胞生长。
2.4 病理诊断及治疗病理诊断为:子宫绒毛叶状分割性平滑肌瘤伴发静脉内平滑肌瘤病(子宫绒毛叶状水泡状静脉内平滑肌瘤病)。该病例采取手术治疗,经腹全子宫与单侧输卵管切除,术中冷冻及最后病理诊断结果均为良性,因此手术方式恰当。术后患者又进一步做了下腔静脉、心脏及肺脏的影像学检查,结果均为阴性。目前术后随访6个月,患者一般状况良好,未见复发。后期予以继续随访。
3 讨 论子宫平滑肌瘤是女性生殖道最常见的肿瘤,在40岁以上的妇女中的发病率约40%[2, 3, 4]。多数平滑肌瘤显示明确的平滑肌分化,易诊断。子宫平滑肌瘤的组织起源,推测起自子宫肌层细胞,其发病机制还不十分清楚。目前普遍认为其发生与长期过度的雌激素刺激有关,部分子宫平滑肌瘤的发生具有遗传倾向。平滑肌瘤是单克隆肿瘤,含有大量的细胞外基质如纤维连接蛋白、蛋白多糖等[5]。X染色体失活是其重要特征。在单个子宫中,等位基因失活的类型是随机的,说明每个克隆性的平滑肌瘤起源于独立的转化事件[6]。
子宫绒毛叶状分割性平滑肌瘤又称Sternberg 瘤。Sternberg 最早报道了20世纪40~70年代中期发生的病例,1975年David等[7]将其病变描述为“葡萄粒样子宫平滑肌瘤”;1996年Roth等[8]对Sternberg收集的病例进行重新报道并命名为子宫绒毛叶状分割性平滑肌瘤。绒毛叶状分割性平滑肌瘤临床特点是多发生于生育年龄的女性,发病年龄23~73岁,中位年龄43岁[9],也有在绝经后[10]、妊娠期[11]发生的报道;肿瘤直径6~20 cm,患者并无特异性临床表现,部分患者出现骨盆疼痛。肿瘤的大体所见呈奇特的肉瘤样,表现为大的外生性,蕈样、多结节或息肉样肿物,生长于子宫浆膜下肌层内,沿着横向生长,从子宫角延伸至阔韧带、骨盆。外生部分柔软、暗红似胎盘组织并伴有广泛的水肿变性。因此被命名为子宫绒毛叶状分割性平滑肌瘤[7]。这种外观是由肿瘤细胞几种生长方式共同作用的结果,包括浆膜下生长、分割性生长和结节周围水肿变性。由于子宫平滑肌瘤的广泛水肿、黏液变性突向子宫外,在重力的作用下,柔软部分下垂,血液淤积呈红色,类似胎盘绒毛。生长在子宫侧壁、宫角部位与浆膜下的平滑肌瘤,因为此处子宫肌壁较薄,利于子宫肌瘤向子宫外扩展,再还有子宫底和子宫侧壁处盆腔空间大,天然体腔利于肿瘤外生性生长。子宫绒毛叶状分割性平滑肌瘤的超微结构为特征性杆状核,细胞质内有中间丝和高密度微丝,胶原纤维丰富,类似于普通平滑肌瘤细胞。流式细胞仪检测肿瘤细胞呈现脱氧核糖核苷酸的二倍体核和少量S期细胞,同样符合良性平滑肌瘤细胞特点。本例除了有绒毛叶状分割性生长的特点,还有静脉内平滑肌瘤病的特点,因此又称为绒毛叶状水肿性静脉内平滑肌瘤病,外观更加独特[12, 13]。由于其特殊的生长方式,容易被误诊为平滑肌肉瘤、子宫内膜间质肉瘤。
静脉内平滑肌瘤病非常少见,是指形态学上良性的平滑肌瘤累及静脉管腔。按肿瘤和血管的关系有3种情况:(1)血管腔病变局限于原发性平滑肌瘤内,即镜下见平滑肌瘤内有灶状的血管内肿瘤;(2)肉眼可见孤立的或多发的肿物,并在肌层静脉内形成蠕虫样肿物;(3)镜下见平滑肌瘤以外的静脉和淋巴管内有平滑肌瘤生长。第一种情况称为平滑肌瘤伴有血管浸润,可能是某些静脉内平滑肌瘤病的前驱病变;也可能是某些良性转移性平滑肌瘤的起源。后两种情况称为静脉内平滑肌瘤病。有时仅见静脉和淋巴管内有平滑肌瘤生长[14]。大多数子宫静脉内平滑肌瘤病可从子宫壁扩展到盆腔静脉,如果不予切除,病变可以延伸到腔静脉甚至心脏[15]。镜下可见肌层脉管(至少有些是大静脉)内有形态良好的平滑肌增生,一般不超出血管外,但在肺部有可能见到血管外病变。大多数组织学类型的子宫肌瘤(上皮样、黏液样、奇异型或脂肪平滑肌瘤等)均可表现为血管内生长,偶尔还可出现内膜成分,其他常见特征有大量小的厚壁血管的透明变性和水肿。
静脉内平滑肌瘤病的起源还不甚清楚。最初认为该病起源于血管平滑肌,目前多数学者认为该病与普通型子宫平滑肌瘤有关。免疫组织化学标记和细胞遗传学分析也提示静脉内平滑肌瘤病起源于子宫,肿瘤细胞可表达ER和PR[16]。肿瘤向静脉内延伸可以被认为是一种侵袭性的生物学特性,但是这种血管内生长通常是缓慢的,临床症状主要取决于肿瘤生长范围。如果主要累及盆腔,可以出现盆腔疼痛或阴道流血;累及腔静脉时,可能出现晕厥和呼吸困难;也有静脉内平滑肌瘤病延伸到心脏导致死亡甚至肺转移。对于大多数病例的治疗,可以切除肿瘤以消除血流动力学的影响并切除伴有平滑肌瘤的子宫。更有学者主张对于年龄超过45岁,子宫外脉管内有侵犯着,行全子宫及双附件切除,同时高位结扎卵巢动、静脉以减少复发[17]。
鉴别诊断:(1)结节周围水肿性平滑肌瘤,其大体和镜下检查是在典型的平滑肌瘤的基础上,伴有局部水肿液蓄积(水肿变性)、有多少不等的胶原(透明变性)、有时还有明显的酸性黏蛋白蓄积(黏液样变性)。这些非细胞区在肿瘤内有各种形式的分布。当它分布于小的平滑肌瘤细胞巢周围时,形成特征性的结节周围无细胞区(结节周围水肿改变),与静脉内平滑肌瘤病相似。结合黏液染色和内皮细胞抗原的免疫组化染色有助于诊断。(2)黏液样平滑肌肉瘤,其通常表现为子宫壁内的孤立性肿块,切面灰黄湿润细腻、有出血坏死带。镜下肉瘤细胞非常丰富,伴有核非典型性和多形性,核分裂像活跃,并且伴有坏死区域。分裂像指数通常>15/10 HPF。子宫绒毛叶状水泡状静脉内平滑肌瘤病特征是质韧,镜下表现为广泛变性的平滑肌瘤,尽管表现为分割状结构,但细胞学形态良好,子宫和盆腔静脉管壁内有成熟的平滑肌生长,并且可由此产生。肿瘤沿血管生长,常延伸到阔韧带和子宫的血管以及髂静脉。肿瘤也可沿着下腔静脉生长甚至达到右心房。然而,远处转移非常少见,而且长期预后非常好。(3)子宫内膜间质肉瘤,在大体标本上子宫内膜间质肉瘤可见息肉样肿物,肿瘤局部浸润可以延伸至阔韧带、输卵管和卵巢。显微镜下显示细胞的非典型性和核分裂像,与子宫绒毛叶状分割性平滑肌瘤伴发静脉内平滑肌瘤病可以区别。同时,前者免疫组化CD10阳性,ER、PR阴性,可与后者鉴别。
综上所述,临床需对子宫绒毛叶状分割性平滑肌瘤合并静脉内平滑肌瘤病正确认识,结合患者的年龄与生育要求,采取恰当的手术治疗,保留年轻妇女的生育能力并防止过度治疗。但由于合并子宫静脉内平滑肌瘤病,手术彻底切除难度较大,易复发,患者需终生随诊[18]。
| [1] | Jordan L B, Al-Nafussi A, Beattie G. Cotyledonoid hydropic intravenous leiomyomatosis: a new variant leiomyoma[J].Histopathology,2002,40:245-252. |
| [2] | Robboy S J, Bentley R C, Butnor K, Anderson M C. Pathology and pathophysiology of uterine smooth-muscle tumors[J].Environ Health Perspect,2000,108 (Suppl 5):779-784. |
| [3] | Salama S S, Kılıç G S.Uterine fibroids and current clinical challenges[J].J Turk Ger Gynecol Assoc, 2013,14:40-45. |
| [4] | Bostancl M S, Bayram M, Bakacak S M, Yıldırım O K, Attar R, Yıldırım G, et al. The role of TWIST, SERPINB5, and SERPIN1 genes in uterine leiomyomas[J].J Turk Ger Gynecol Assoc, 2014,15:92-95. |
| [5] | Parker W H. Etiology, symptomatology, and diagnosis of uterine myomas[J].Fertil Steril, 2007,87:725-736. |
| [6] | Dikareva L V, Shvarev E G, Shvarev G E, Teplyǐ D L. Age, structural and biochemical characteristics of endometrial secretion in patients with hysteromyoma[J].Adv Gerontol,2008,21:596-601. |
| [7] | David M P, Homonnai T Z, Deligdish L, Loewenthal M. Grape-like leiomyomas of the uterus[J].Int Surg,1975, 60:238-239. |
| [8] | Roth L M, Reed R J, Sternberg W H. Cotyledonoid dissecting leiomyoma of the uterus: the Sternberg tumor[J].Am J Surg Pathol,1996,20:1455-1461. |
| [9] | 张 晶,李全荣,武艳霞,林 蓓.39例子宫绒毛叶状分割性平滑肌瘤的荟萃分析[J].现代肿瘤医学,2011,19:2063-2066. |
| [10] | Gezginç K, Yazici F, Selimoğ lu R, Tavli L. Cotyledonoid dissecting leiomyoma of the uterus with intravascular growth in postmenopausal woman: a case presentation[J].Int J Clin Oncol,2011,16:701-704. |
| [11] | Mathew M, Gowri V, Al Hamdani A, Machado L, Rao K, Shabnam S. Cotyledonoid leiomyoma in pregnancy[J].Obstet Gynecol,2007,109(2 Pt2):509-511. |
| [12] | Shele-khova K V, Kazakov D V, Michal M.Cotyledonoid dissecting leiomyoma of the uterus with intravascular growth: report of two cases[J].Virchows Arch,2007,450:119-121. |
| [13] | Fukunaga M, Suzuki K, Hiruta N. Cotyledonoid dissecting leiomyoma of the uterus: a report of four cases[J].APMIS,2010,118:331-333. |
| [14] | Mariyappa N, Manikyam U K, Krishnamurthy D, Preeti K, Agarwal Y, Prakar U. Intravenous leiomyomatosis[J].Niger J Surg,2012,18:105-106. |
| [15] | Polizzi V, Pergolini A, Zampi G, Lo Presti M, Pino P G, Cartoni D, et al. Intravenous leiomyomatosis extending to the heart: a multimodality imaging approach[J].Herz,2014,39:720-721. |
| [16] | Buza N, Xu F, Wu W, Carr R J, Li P, Hui P. Recurrent chromosomal aberrations in intravenous leiomyomatosis of the uterus: high-resolution array comparative genomic hybridization study[J].Hum Pathol,2014,45:1885-1892. |
| [17] | Matos A P, Ramalho M, Palas J, Herédia V. Heart extension of an intravenous leiomyomatosis [J].Clin Imaging,2013,37:369-373. |
| [18] | Tielliu I F, Otterman M L, Meuzelaar J J, Zeebregts C J, Peeters P M. Intravenous leiomyomatosis: report of two cases and strategy for surgical resection[J].Minerva Chir,2010,65:489-493. |
 2015, Vol. 36
2015, Vol. 36

