核糖体蛋白除了在蛋白质合成中起重要作用外,近年来报道有些核糖体蛋白还有独特的核糖体外功能[1]。一般认为,核糖体蛋白表达上调直接反映细胞内蛋白的合成增加,但在成神经细胞瘤的研究中发现,虽然有大量的核糖体蛋白转录水平上调,但蛋白合成并未全面增加[2],提示核糖体蛋白基因的表达改变增高可能参与调节许多细胞生理活动即核糖体外功能。核糖体蛋白S3a(ribosomal protein S3a,RPS3a)是核糖体40S亚基的组成成分之一,相对分子质量为29 800。其主要作用是参与细胞生命活动的重要蛋白质的合成,从而影响细胞的正常代谢[3, 4, 5]。与正常组织相比,RPS3a在很多恶性肿瘤组织中如结肠腺癌、髓质甲状腺癌、肝癌、颅内动脉瘤、鳞状细胞肺癌、弥漫性大B细胞淋巴结组织、猿猴免疫缺陷病毒(SIV)相关的淋巴瘤中表达升高[6],但在人前列腺癌细胞向神经内分泌细胞分化的过程中,RPS3a mRNA的水平降低[7]。Kho等[8]研究发现,人正常龟头细胞系在血清刺激后,RPS3a mRNA表达上升,且在细胞周期S期表达最高。此外,RPS3a还能与转录因子CHOP、Bcl 2、EB病毒编码的EBNA 5等相互作用调控红细胞生成[9]、调节p53通路[10]和抑制多聚(ADP 核糖)聚合酶活性[11, 12]。RPS3a作为乙肝病毒X蛋白(HBX)的陪伴蛋白,可以通过调控HBX活化的NF κB信号通路,诱发肿瘤[13]。在对全身血管炎基因表达网络的生物学信息分析中有研究发现,RPSL31、RPS3a、RPL9等核糖体蛋白在全身血管炎的病理组织中高表达[14],且RPS3a与神经退行性疾病相关蛋白α syn的功能息息相关[15]。我们近期文献综述了RPS3a调控细胞增殖、生长周期、分化调控、凋亡和耐药性等生物学过程[16]。RNA干扰技术可在转录水平上沉默基因表达,被广泛应用于基因功能的研究。本实验构建小鼠RPS3a 特异性RNA干扰重组慢病毒载体(Lenti shmRPS3a),并分析其基因沉默效率及对细胞凋亡的影响,为进一步研究RPS3a的核糖体外新功能提供工具。
1 材料和方法 1.1 材料及主要试剂克隆载体pLLU2G和辅助质粒pLV/helper SL3、pLV/helper SL4、pLV/helper SL5购自赛业生物科技有限公司。293T细胞和RAW264.7细胞为本实验室保存。限制性内切酶Hpa Ⅰ和Xho Ⅰ、T4 连接酶、Stb13 感受态菌购自TaKaRa公司。质粒抽提试剂盒购自天根生化科技有限公司。Fugen 6转染试剂购自Promega公司。兔抗小鼠RPS3a抗体购自Abnova公司。GAPDH抗体和荧光二抗购自Santa Cruz公司。Annexin Ⅴ FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司。
1.2 靶向RPS3a基因的寡核苷酸设计根据小鼠RPS3a的mRNA序列,利用在线设计软件Invitrogen “Block iT RNAi Designer”挑选4条包含21 个碱基的与RPS3a同源的特异性核苷酸序列,序列如下:(1) CGT GTG TTT GAA GTG AGC CTT;(2)CAG ATA AGA AAG ACA TCC TAT;(3)GCT AAG AAG AAA GTG GTC GAT;(4)GCA TTG GGA AAG ACA TAG AAA。经BLAST表明所挑选的4条目的序列均不与其他任何基因同源。同时设计一段阴性对照随机序列NC: GCG CGC TTT GTA GGA TTC。 再根据以上5段序列分别设计合成4对RPS3a特异性发夹RNA (shRNA)序列,每对包含一条正义链和一条反义链,中间以一个loop序列5′ CTCGAG 3′相连,后面接有RNA聚合酶Ⅲ转录终止位点,同时模板链两端分别添加Hpa Ⅰ和Xho Ⅰ酶切位点,合成相应的寡核苷酸链,4组寡核苷酸序列的正反义链(下划直线标记的是靶基因序列及反义序列)分别是RPS3a 1F:5′-TCG子TGT GTT TGA AGT GAG CCT TCT CGA GAA GGC TCA CTT CAA ACA CAC G TT TTT C-3′,RPS3a-1R:5′-T CG AGA AAA ACG TGT GTT TGA AGT GAG CCT T CT CGA GAA GGC TCA CTT CAA ACA CAC G A-3′; RPS3a-2F:5′-T CA GAT AAG AAA GAC ATC CTA T CT CGA G AT AGG ATG TCT TTC TTA TCT G TT TTT C-3′,RPS3a-2R:5′-TCG AGA AAA A CA GAT AAG AAA GAC ATC CTA T CT CGA GAT AGG ATG TCT TTC TTA TCT G A-3′;RPS3a-3F:5′-T GC TAA GAA GAA AGT GGT CGA T CT CGA GAT CGA CCA CTT TCT TCT TAG C TT TTT C-3′,RPS3a-3R:5′-TCG AGA AAA A GC TAA GAA GAA AGT GGT CGA T CT CGA GAT CGA CCA CTT TCT TCT TA G CA-3′;RPS3a-4F:5′-T GC ATT GGG AAA GAC ATA GAA A CT CGA GTT TCT ATG TCT TTC CCA ATG C TT TTT C-3′,RPS3a-4R:5′-TCG AGA AAA A GC ATT GGG AAA GAC ATA GAA A CT CGA GTT TCT ATG TCT TTC CCA ATG C A-3′。对照组寡核苷酸序列NC-1F:5′-T GC GCG CTT TGT AGG ATT C CT CGA G CG CGC GAA ACA TCC TAA G TT TTT C-3′,NC-1R:5′-TCG AGA AAA A GC GCG CTT TGT AGG ATT C CT CGA G CG CGC GAA ACA TCC TAA G A-3′。
1.3 pLLU2G shmRPS3a重组慢病毒载体的构建与鉴定将合成的寡核苷酸正义链与反义链在退火缓冲液中进行连接,反应体系如下:50 μmol/L的正义链oligo 20 μL,50 μmol/L反义链oligo 20 μL,ddH2O 40 μL,5×通用缓冲液20 μL,共100 μL反应体系,混匀后按如下程序设置PCR仪进行退火反应:95℃ 2 min;每8 s下降0.1℃,降至25℃ 约90 min;4℃保存。在37℃条件下用内切酶Hpa Ⅰ和Xho Ⅰ酶切pLLU2G载体以使其线性化,将酶切回收的线性载体pLLU2G与退火后的双链 DNA连接,连接反应条件如下:pLLU2G酶切回收产物(200~300 ng) 8 μL;退火的oligo DNA(1/10 dilute) 1 μL;10×T4 DNA 连接酶缓冲液 2.5 μL;T4 DNA 连接酶 1 μL;补H2O至总体系为25 μL,4℃连接过夜。连接产物转化至Stb13 感受态菌中,经氨苄青霉素平板筛选,挑选阳性克隆抽提质粒,使用载体酶切位点两端的引物进行PCR扩增出目的片段验证阳性菌落,同时测序。PCR引物序列:pLLU2G F为AGG CTT AAT GTG CGA TAA AAG AC,pLLU2G R为GAG CTT ATC GAT ACC GTC GAC。
1.4 pLLU2G shmRPS3a慢病毒的包装和病毒滴度的测定分别将重组质粒pLLU2G shmRPS3a 1~4及辅助包装质粒pLV/helper SL3、pLV/helper SL4、pLV/helper SL5共转染293T细胞,培养48 h后荧光显微镜下观察转染效果,并收集含有病毒的培养上清。将收集的上清离心后,用0.45 μm滤器过滤,高速离心90 min沉淀病毒颗粒,用适量培养液重悬病毒沉淀,置-80℃保存。
接种293T细胞到6孔板中,使细胞汇合度达到30%~50%,培养过夜。分别用完全培养基按10倍梯度稀释病毒液,稀释倍数从10-3到10-7。 去除293T细胞的上清液,加入稀释后的病毒样品,加入6 μg/mL的聚凝胺,轻轻吹打均匀,同时设置不加病毒的细胞做空白对照。感染24 h后弃去含病毒的培养液,加入2 mL新鲜的完全培养液,继续培养至72 h后,荧光细胞计数,按公式计算病毒滴度。病毒滴度=接种细胞数×稀释度×荧光细胞百分比。
1.5 Real time PCR与蛋白质印迹法检测RPS3a的表达 Lenti shmRPS3a慢病毒感染RAW264.7细胞,48 h后收获细胞,抽提总RNA,以shRNA control组为对照,RT PCR检测RPS3a的mRNA表达水平,按照2-ΔΔCt法分析处理数据。引物序列如下。RPS3a Forward:ACC GAT GGG TAT TTG CTC CGA CTT,RPS3a Reverse:TGG CGG ACT TGC TGG TGC TG; GAPDH Forward: TCG TCC GGT AGA CAA AAT GG,GAPDH Reverse: GAG GTC AAT GAA GGG GTC GT。
Lenti shmRPS3a慢病毒感染RAW264.7细胞,48 h后提取总蛋白,BCA法定量后调整上样量,每组均取8 μg蛋白加入5×SDS PAGE Loading Buffer上样,蛋白经SDS PAGE分离后转移至硝酸纤维素膜上,检测RPS3a和Actin的特异性抗体免疫印迹。
将RAW264.7细胞以每孔3万个细胞接种至12孔板,待细胞贴壁后加入稀释后的病毒,培养48 h后用不含EDTA的胰酶消化收集细胞,离心后弃上清,含1%牛血清白蛋白的磷酸盐缓冲液洗涤细胞,再次离心后的细胞沉淀用Binding buffer 重悬,避光加入2.5 μL Annexin Ⅴ FITC,室温避光反应15 min;上机前加入2.5 μL碘化丙啶,吹打均匀后流式细胞仪检测。
1.7 统计学处理3次独立实验的数据以 x±s 表示,组间差异比较采用t检验,检验水准(α)为0.05。
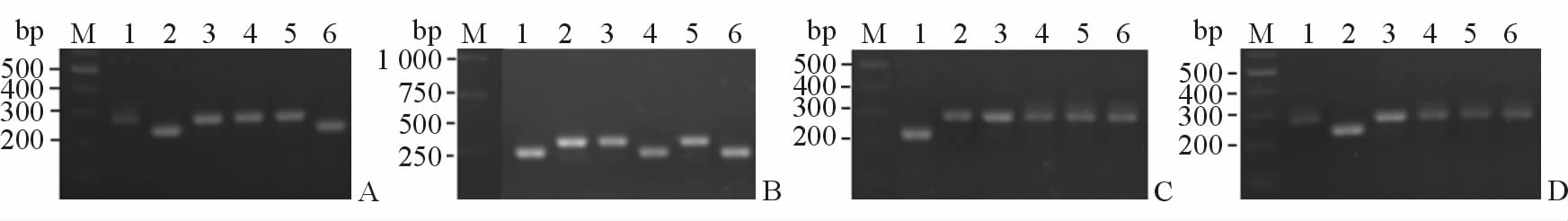
2 结 果 2.1 重组慢病毒质粒鉴定以氨苄青霉素平板上阳性克隆抽提的质粒做模板,用载体酶切位点两端的引物进行PCR扩增。图 1可见,因插入目的片段的影响,PCR扩增重组载体得到的片段大于空载体,初步证实RPS3a shRNA正确插入载体pLLU2G中。测序的结果经BLAST序列比对证明目的基因插入到载体中,4种重组质粒均构建成功。
|
图 1 pLLU2G shmRPS3a阳性重组克隆的酶切鉴定
Fig. 1 Restriction endonuclease digestion analysis of the recombinant plasmid pLLU2G shmRPS3a A: pLLU2G shmRPS3a 1; B: pLLU2G shmRPS3a 2; C: pLLU2G shmRPS3a 3; D: pLLU2G shmRPS3a 4. M: Marker; 1: Positive control; 2: Negative control; 3 6: pLLU2G shmRPS3a |
pLLU2G shmRPS3a重组质粒和辅助包装质粒共转染293T细胞48 h后,可见胞质胞核有不同程度的绿色荧光蛋白(GFP)表达,见图 2。

|
图 2 pLLU2G shmRPS3a转染293T细胞48 h后绿色荧光蛋白的表达
Fig. 2 Expression of GFP in 293 cells transfected with pLLU2G shmRPS3a for 48 h A D: pLLU2G shmRPS3a 1 4. Original magnification:×100 |
慢病毒感染细胞72 h后,荧光细胞数随病毒稀释倍数的增加而减少。计算出Lenti shmRPS3a 1、Lenti shmRPS3a 2、Lenti shmRPS3a 3、Lenti shmRPS3a 4的滴度分别为6.6×107、7.8×107 、6.0×107 、8.4×107 TU/mL。对照病毒Lenti shNC的滴度为7.0×107 TU/mL。
2.3 干扰效果测定Lenti shmRPS3a慢病毒感染RAW264.7细胞48 h后荧光显微镜下观察,发现5组病毒均能有效感染细胞,且转导率均大于70%。Real time PCR检测细胞内RPS3a的mRNA表达水平,结果显示,Lenti shmRPS3a 1、Lenti shmRPS3a 2、Lenti shmRPS3a 4的沉默效率分别为(72.64±8.09)%、(63.4±6.56)%、(60.22±4.22)%,与对照病毒Lenti shNC相比差异有统计学意义 (P<0.05)。这说明,与对照组相比,本研究中构建的RPS3a的干扰慢病毒沉默效率增加。
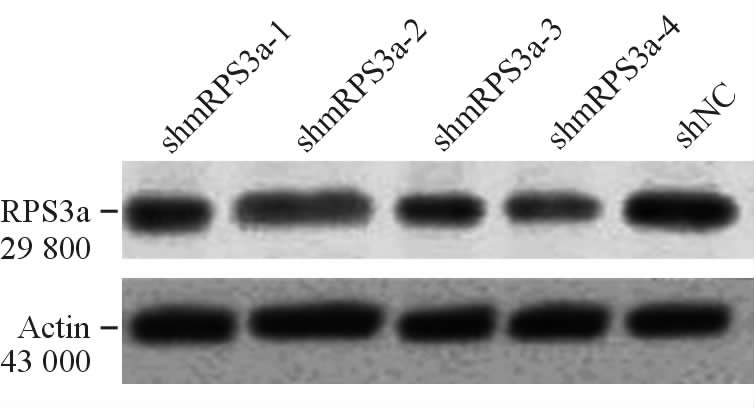
蛋白质印迹检测结果(图 3)显示,RAW264.7细胞感染对照病毒shNC后,RPS3a蛋白水平没有明显变化,而细胞感染针对目的基因RPS3a的干扰慢病毒后,RPS3a蛋白水平减少,灰度扫描的结果显示,与对照组相比,Lenti shmRPS3a 1、Lenti shmRPS3a 2、Lenti shmRPS3a 4作用RAW264.7细胞后,RPS3a的表达水平分别为(64.59±7.55)%、(54.99±6.24)%、(44.16±3.52)%。
|
图 3 RNA干扰慢病毒对RPS3a蛋白水平的影响
Fig. 3 Down regulated expression of RPS3a protein in RAW264.7 cells transfected with the recombinant lentiviral vectors RAW264.7 cells were transfected with lentiviral shNC or Lenti shmRPS3a for 48 h,and RPS3a protein expression was detected by Western blotting analysis |
综合real time PCR和蛋白质印迹法的检测结果,shmRPS3a 2干扰效果最好,故在后续研究中主要采用该序列进行RPS3a的 RNA干扰。
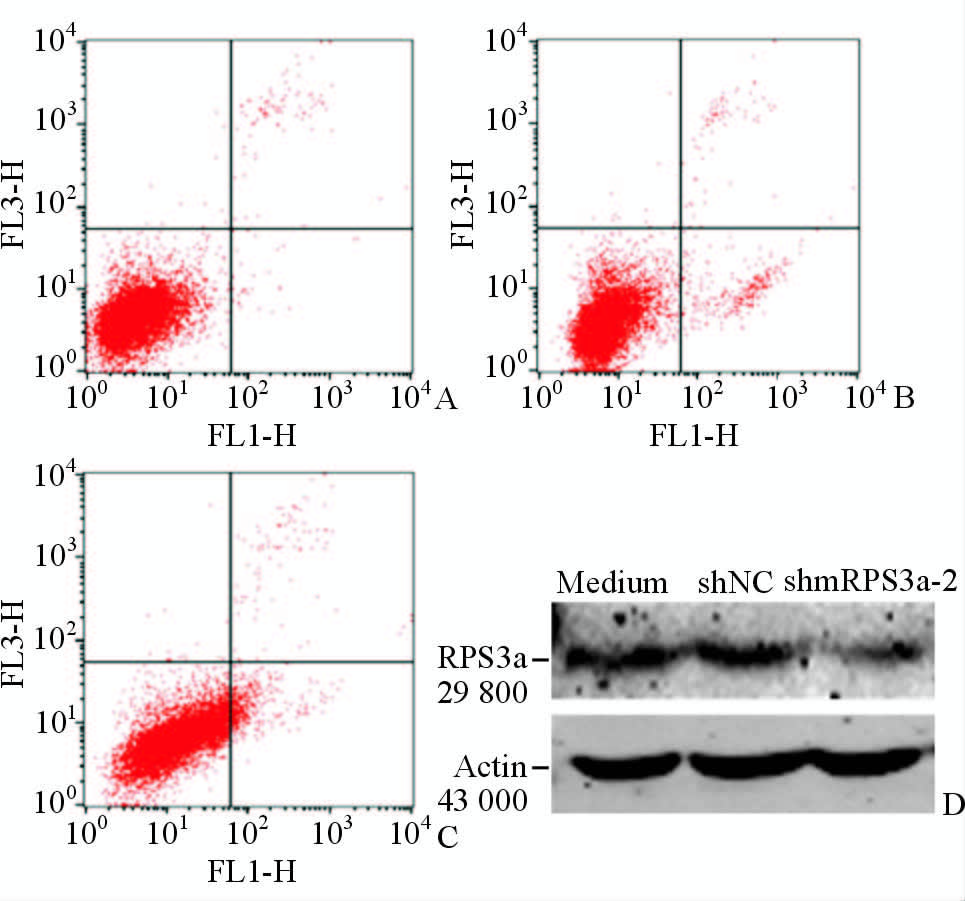
2.4 RPS3a下调对RAW264.7细胞凋亡的影响流式细胞仪分析的结果显示,RAW264.7细胞感染对照病毒shNC后,细胞几乎不凋亡,而感染了针对目的基因RPS3a的干扰慢病毒后的细胞凋亡率增加2倍(P<0.05,图 4A~4C)。蛋白质印迹检测结果(图 4D)显示,感染了shNC慢病毒的细胞与未处理的细胞(对照组)RPS3a蛋白表达无明显差异,而感染shmRPS3a 2慢病毒的细胞内RPS3a的表达较对照组减少;灰度扫描结果显示,与对照组相比,Lenti shmRPS3a 2作用后的细胞中RPS3a的表达水平为(40.38±4.12)%。
|
图 4 流式细胞术(A~C)和蛋白质印迹法(D)检测shmRPS3a对RAW264.7细胞凋亡的影响
Fig. 4 Effect of shmRPS3a on RAW264.7 cell apoptosis as shown by flow cytometry (A C) and Western blotting analysis (D) A: Non treatment control; B: Lenti shNC treatment; C: Lenti shmRPS3a 2 treatment; D: RPS3a expression levels after RAW264.7 cells were transfected with Lenti shNC or Lenti shmRPS3a for 48 h |
核糖体蛋白RPS3a已被证明是一个多功能蛋白,参与了蛋白质合成、细胞增殖、生长周期、分化、凋亡和耐药性等许多生物过程。RNAi是近年来功能基因组学和疾病基因组学研究的热点,在本实验中我们拟利用基因干扰的方法进一步研究RPS3a的生物学功能。 慢病毒载体是由人类免疫缺陷病毒HIV改造而来,具有可感染非分裂细胞、免疫反应小、目的基因整合至靶细胞基因组长期表达等优点。本实验采用慢病毒载体pLLU2G EGFP介导RPS3a的RNAi,靶基因RPS3a的干扰效果明显、持久,且病毒本身对细胞生长没有明显的作用,说明本研究构建的Lenti shmRPS3a慢病毒载体是有效的、副作用少的载体,可用于后续RPS3a的功能研究。
RPS3a与细胞凋亡的关系目前尚不完全清楚。Naora等[3]报道小鼠给予地塞米松,小鼠胸腺细胞大量凋亡伴随RPS3a表达水平增加;该作者还报道,肿瘤细胞中RPS3a的表达量高于正常细胞,利用反义核酸技术抑制肿瘤细胞RPS3a表达则诱导肿瘤细胞凋亡[17]。此外,也有报道在全反式维甲酸处理的慢性髓性白血病细胞中,RPS3a与B细胞淋巴瘤/白血病 2 (bcl 2)相互作用,肿瘤细胞高表达RPS3a促进细胞生长,而且增加肿瘤细胞对化疗药物阿糖胞苷和多柔比星的敏感性;而细胞转染RPS3a反义核酸则具有相反的作用[11]。本研究应用shmRPS3a 2慢病毒感染RAW264.7细胞,流式细胞术分析显示这些细胞凋亡率较对照组增加,表明RPS3a表达减少可促进细胞凋亡。
| [1] | Lindström M S. Emerging functions of ribosomal proteins in gene-specific transcription and translation[J]. Biochem Biophys Res Commun, 2009, 379: 167-170. |
| [2] | Angelastro J M, Töröcsik B, Greene L A. Nerve growth factor selectively regulates expression of transcripts encoding ribosomal proteins[J]. BMC Neurosci, 2002, 3: 3. |
| [3] | Naora H, Nishida T, Shindo Y, Adachi M, Naora H. Association of nbl gene expression and glucocorticoid-induced apoptosis in mouse thymus in vivo[J]. Immunology, 1995, 85: 63-68. |
| [4] | Malygin A A, Shatsky I N, Karpova G G. Proteins of the human 40S ribosomal subunit involved in hepatitis C IRES binding as revealed from fluorescent labeling[J]. Biochemistry (Mosc), 2013, 78: 53-59. |
| [5] | Yan Q, Cui X, Su L, Xu N, Guo N, Xing H, et al. GmSGT1 is differently required for soybean Rps genes-mediated and basal resistance to Phytophthora sojae[J]. Plant Cell Rep, 2014, 33: 1275-1288. |
| [6] | Tarantul V Z, Nikolaev A I, Martynenko A, Hannig H, Hunsmann G, Bodemer W. Differential gene expression in B-cell non-Hodgkin's lymphoma of SIV-infected monkey[J]. AIDS Res Hum Retroviruses, 2000, 16: 173-179. |
| [7] | Goodin J L, Rutherford C L. Characterization of human ribosomal S3a gene expression during adenosine 3':5' cyclic monophosphate induced neuroendocrine differentiation of LNCaP cells. Regulation of S3a gene expression in LNCaP[J]. Mol Biol Rep, 2002, 29: 301-316. |
| [8] | Kho C J, Wang Y, Zarbl H. Effect of decreased fte-1 gene expression on protein synthesis, cell growth, and transformation[J]. Cell Growth Differ, 1996, 7: 1157-1166. |
| [9] | Cui K, Coutts M, Stahl J, Sytkowski A J. Novel interaction between the transcription factor CHOP (GADD153) and the ribosomal protein FTE/S3a modulates erythropoiesis[J]. J Biol Chem, 2000, 275: 7591-7596. |
| [10] | Kashuba E, Yurchenko M, Szirak K, Stahl J, Klein G, Szekely L. Epstein-Barr virus-encoded EBNA-5 binds to Epstein-Barr virus-induced Fte1/S3a protein[J]. Exp Cell Res, 2005, 303: 47-55. |
| [11] | Hu Z B, Minden M D, McCulloch E A, Stahl J. Regulation of drug sensitivity by ribosomal protein S3a[J]. Blood, 2000, 95: 1047-1055. |
| [12] | Song D, Sakamoto S, Taniguchi T. Inhibition of poly(ADP-ribose) polymerase activity by Bcl-2 in association with the ribosomal protein S3a[J]. Biochemistry, 2002, 41: 929-934. |
| [13] | Lim K H, Kim K H, Choi S I, Park E S, Park S H, Ryu K, et al. RPS3a over-expressed in HBV-associated hepatocellular carcinoma enhances the HBx-induced NF-kappaB signaling via its novel chaperoning function[J]. PLoS One, 2011, 6: e22258. |
| [14] | Gan S J, Ye B, Qian S X, Zhang C, Mao J Q, Li K, et al. Immune- and ribosome-related genes were associated with systemic vasculitis[J]. Scand J Immunol, 2015, 81: 96-101. |
| [15] | De Graeve S, Marinelli S, Stolz F, Hendrix J, Vandamme J, Engelborghs Y, et al. Mammalian ribosomal and chaperone protein RPS3A counteracts alpha-synuclein aggregation and toxicity in a yeast model system[J]. Biochem J, 2013, 455: 295-306. |
| [16] | 李英华,胡振林,张俊平. 核糖体蛋白S3a在肿瘤细胞增殖分化和凋亡调控作用的研究概况[J]. 药学实践杂志, 2012, 30: 165-167, 225. |
| [17] | Naora H, Nishida T, Shindo Y, Adachi M, Naora H. Antisense sequences of the nbl gene induce apoptosis in the human promyelocytic leukemia cell line HL-60[J]. Leukemia, 1998, 12: 532-541. |
 2015, Vol. 36
2015, Vol. 36


