2. 广州军区广州总医院心血管外科中心, 广州 510010
2. Centre of Cardiovascular Surgery, Guangzhou General Hospital, PLA Guangzhou Military Area Command, Guangzhou 510010, Guangdong, China
生物瓣以其良好的血流动力学特性和无需终身抗凝的优点,在临床上得到广泛应用,据统计,全球每年近50万的植入瓣膜中57%~60%为生物瓣,在发达国家甚至达到80%[1]。随着技术的进步,生物瓣的使用寿命不断延长。据报道,第三代生物瓣膜术后12年的瓣膜衰败豁免率可达到(92±8)%[2]。生物瓣置换后早期(小于5年)衰败(early bioprosthesis failure,EBF)少见。第二军医大学长海医院2001年1月到2014年1月间收治的650例生物瓣置换手术病例中仅3例(占0.5%)因EBF行再次换瓣手术。本研究通过回顾这3例患者的病例资料,并结合国外文献对EBF原因进行分析,并提出相应对策。
1 资料和方法 1.1 3例患者的临床资料病例1为男性患者,57岁。2010年因“右房室瓣重度关闭不全”行右前外侧切口不停跳右房室瓣置换术(TVR,保留原右房室瓣结构),植入31 mm Medtronic生物瓣。术后长期抗血小板治疗(拜阿司匹林,100 mg/d)。2013年9月,患者因“TVR后3年,活动后胸闷、乏力伴反复双下肢水肿半年”再次入院。患者既往14年前行“右心室永久起搏器植入术”,5年前行“起搏器更换+血栓清除+右房室瓣成形术”。查体:双下肢轻度水肿,胸骨左缘4~5肋间闻及Ⅱ/6级收缩期吹风样杂音。心脏超声提示:右房室瓣生物瓣回声增强,呈Ⅰ度纤维化,瓣叶活动度下降,开放受限,跨瓣压差24 mmHg(1 mmHg=0.133 kPa),伴大量返流(瞬时量为21.4 mL),左房室瓣中度关闭不全,全心增大。心电图提示:起搏心律,起搏器工作正常。予再次行TVR,术中见右房室瓣生物瓣与自身瓣膜粘连,生物瓣瓣叶纤维增生,瓣周血管翳增生,以右室面为主(图 1A)。给予换31 mm SJM机械瓣,同时左房室瓣采用成形环成形。衰败生物瓣标本送病理检查。
 |
图 1 3位患者再次手术取出生物瓣的大体照片 A:病例1;B:病例2;C:病例3 |
病例2,患者男。2010年5月因“退行性瓣膜病、冠心病、高血压病、高血脂症”于长海医院行主动脉瓣置换术(AVR)和冠状动脉搭桥术(CABG),植入23 mm Carpentier Edwards生物瓣,术后恢复良好。2013年11月患者因“活动后胸闷、气急2个月,加重1周”再次入院。查体:主动脉瓣第二听诊区可闻及舒张期叹气样杂音,左房室瓣听诊区闻及Ⅱ/6级收缩期吹风样杂音。心脏超声提示:AVR术后3年,主动脉瓣大量返流(瞬时量17 mL),升主动脉扩张(内径4.2 cm),左房室瓣前叶脱垂伴重度关闭不全(瞬时量13 mL),左房、左室增大,心包腔少量积液。实验室检查提示高脂血症。入院诊断为“AVR+CABG术后,主动脉瓣生物瓣重度关闭不全,左房室瓣重度关闭不全;高血压病;高脂血症”。予再次行AVR,术中见主动脉瓣生物瓣钙化并衰败,右冠瓣损毁(图 1B)。给予置换23 mm St.Jude生物瓣,同时左房室瓣采用成形环成形。衰败生物瓣标本送病理检查。
病例3,患者男,67岁。2009年10月因“主动脉瓣右冠瓣脱垂并重度关闭不全”于长海医院行AVR,植入23 mm St. Jude生物瓣。术后恢复顺利,华法林抗凝6个月,INR维持在1.5~2.5,停华法林治疗后长期口服阿司匹林(100 mg/d)。2013年3月因“AVR后3年余,活动后胸闷气急1年”再次入院。查体:主动脉瓣听诊区闻及Ⅴ/6级收缩期喷射样杂音。心脏超声提示:右冠瓣位置生物瓣瓣叶回声明显增强,活动受限,主动脉瓣生物瓣重度狭窄(跨瓣压差为128 mmHg)。心电图提示:窦性心律;不完全性右束支传导阻滞。予再次行AVR,术中见生物瓣瓣窦大量纤维组织沉着致瓣叶开放严重受限,生物瓣无明显钙化(图 1C)。给予换23 mm Carbomedics双叶机械瓣,将生物瓣及赘生物送病理。
1.2 文献检索利用PubMed以“bioprosthesis”、“heart valve prosthesis”、“early failure”、“bioprosthesis failure” 为关键词对1994年至2014年间发表的EBF相关文献进行检索,排除介入心脏瓣膜、心脏移植后EBF、带瓣管道置换、儿童患者、人工瓣膜感染性心内膜炎等文献。
2 结 果 2.1 病理及随访结果病例1的送检标本病理结果提示生物瓣瓣周结缔组织增生,生物瓣和自身右房室瓣交界处融合,部分区域可见自身右房室瓣的细胞长入生物瓣;生物瓣瓣叶退行性变,纤维结缔组织和血管增生,胶原纤维嗜伊红变性,部分区域出血、坏死,局灶性淋巴、浆细胞浸润(图 2A)。患者术后恢复良好,无明显并发症,复查心脏超声结果满意,康复出院。
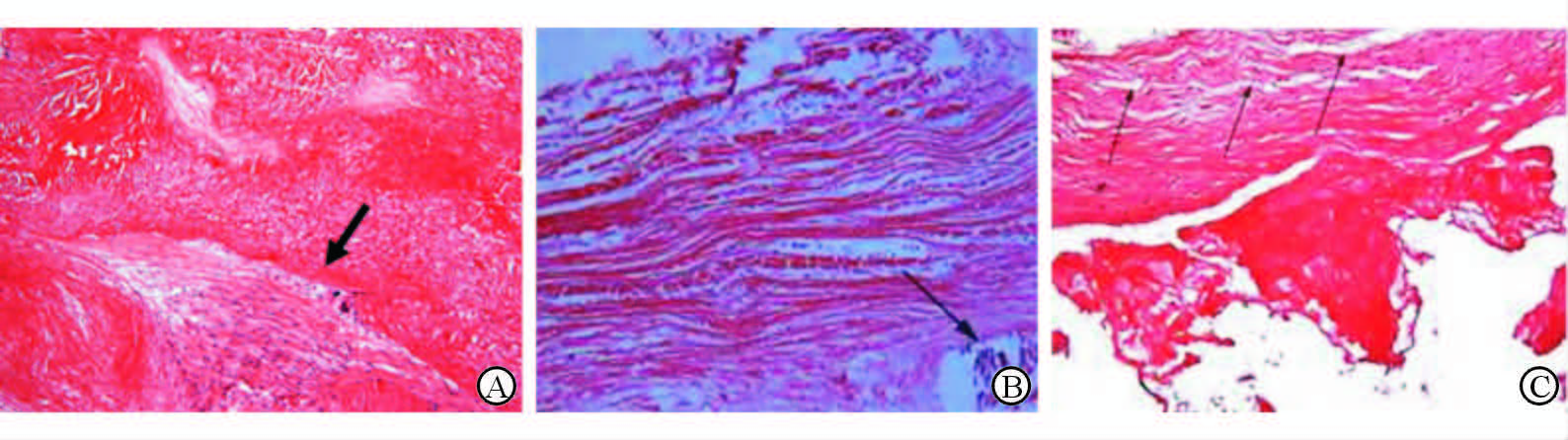 |
图 2 3位患者再次手术取出生物瓣的病理结果 A:病例1,箭头示生物瓣和自身右房室瓣瓣叶融合,自身的瓣膜间质细胞长入生物瓣;B:病例2,箭头示钙盐沉积以及钙化斑块形成;C:病例3,箭头示生物瓣瓣叶局部纤维断裂. Original magnification:×100(A,B),×200(C) |
病例2患者的病理结果提示生物瓣瓣叶钙化,主要位于瓣叶交接处,生物瓣右冠瓣损毁,瓣叶内广泛胶原纤维增生,少量淋巴细胞、浆细胞浸润,钙化斑块形成(图 2B)。患者术后恢复良好,无明显并发症,复查心脏超声结果满意,康复出院。
病例3患者病理结果提示生物瓣上附着大量血栓,主要位于瓣窦内,与瓣叶粘连较紧密,生物瓣瓣叶结构大致正常,但局部见明显胶原和弹力纤维断裂,瓣叶未见明显钙化(图 2C)。患者术后恢复顺利,无明显并发症,复查心脏超声结果满意,康复出院。
2.2 文献回顾根据文献检索及排除标准,共纳入文献12条,计14例EBF病例[3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14]。这14例EBF的原因主要为:生物瓣与自身瓣叶粘连6例(42.9%)[5, 7, 12, 13];患者代谢异常导致生物瓣早期退变、钙化3例(21.4%),其中1例为合并代谢综合征[14],1例因术后长期摄入钙剂导致血钙增高[11],1例因透析导致甲状旁腺功能亢进[10];术后早期生物瓣血栓形成2例(14.3%)[6, 9];慢性炎症反应导致瓣膜增厚、瓣口狭窄2例(14.3%)[3, 4];因生物瓣环缝合不均匀导致生物瓣变形并瓣口狭窄1例(7.1%)[8]。
3 讨 论生物瓣膜在植入人体后衰败不可避免,但大部分发生于植入12年以后[15]。目前关于生物瓣耐久性和失功能原因的研究有很多,但EBF的研究很少。EBF是一个多因素参与的连续性过程,可以导致EBF的原因复杂多样,其具体机制尚不明确。本研究通过总结3例EBF病例,并回顾国外文献,对导致EBF的原因进行了初步分析。
生物瓣瓣叶粘连是导致EBF的重要原因。生物瓣瓣叶粘连分两种情况:生物瓣-自身保留瓣叶粘连,或生物瓣自身瓣叶间粘连。左房室瓣置换术(MVR)或TVR多保留部分或全部自身瓣膜结构,这有利于保护心室功能及避免损伤传导束[16],但是,通过本研究和Takeda等[13]的报道都发现,这可能会导致自身瓣膜结构与生物瓣叶粘连,导致EBF。Bianchi等[5]报道1例MVR术后3年后因乳头肌与键索冲击生物瓣瓣叶并最终与生物瓣瓣叶粘连导致瓣口狭窄的罕见病例。针对这个问题,Bianchi等提出应对残存瓣叶进行折叠以避免此类并发症。Robertson等[12]认为,MVR手术应有选择性的保留瓣下结构以尽量避免这种罕见但严重的并发症,我们也建议在生物瓣左房室瓣或右房室瓣置换时,应反复确认保留的自身瓣膜结构与生物瓣叶的关系,如果有互相影响的可能,则减少或不保留自身瓣膜。生物瓣瓣叶间粘连比较罕见。Glaser等[7]报道,2例在体外心肺循环系统(ECOM)维持下MVR术后发生植入瓣瓣叶粘连导致EBF,推测可能原因为ECOM支持下体循环低灌注压导致植入瓣膜不发生完全开放而使瓣叶根部长期接触最终导致粘连。
患者本身代谢异常,如合并代谢综合征或高钙血症等会加速生物瓣膜衰败。据报道能导致血浆中钙浓度升高的因素如血液透析、钙剂与维生素D补充等可加速生物瓣植入后的钙化从而导致EBF,其机制可能为血浆中的高钙浓度导致生物瓣植入后钙化加速[17]。Boeken等[18]报道在肾衰竭患者中,鉴于生物瓣会加速钙化,使用机械瓣获益高于生物瓣,但亦有研究认为肾衰竭患者生物瓣置换后耐久性无明显影响[19]。另有研究认为代谢综合征(MS)是导致EBF的危险因素[20, 21, 22],我们报道的1例AVR+CABG术的患者与文献[14]报道的1例AVR术后EBF病例均为合并MS患者。但是Kulik等[23]进行的一项观察性研究表明,生物瓣置换术后的降脂治疗并不能降低生物瓣衰败的发生率。我们认为对于合并高钙血症或代谢综合征的患者,积极纠正代谢紊乱,将钙离子和血脂水平控制在正常水平,对提高生物瓣的耐久性有意义。
术后早期血栓形成是导致EBF的一个重要原因,在我们的研究中占14.3%,而生物瓣术后血栓形成往往又与生物瓣本身的退变有关。引起人工瓣膜血栓形成的原因可分为机械性原因与非机械性原因。机械性原因方面,Fasol等[6]报道1例在MVR术后由于后叶保留引起局部血流动力学异常而导致的早期血栓形成。非机械性原因方面较为复杂,本研究中的病例3患者其病理发现生物瓣膜出现了明显的纤维断裂,而这会加速生物瓣的退变,并诱发瓣膜血栓的形成。抗血小板治疗对于生物瓣血栓形成的预防是否有效尚无定论;Gutiérrez Morlote等[9]报道1例AVR术后在规范抗凝下仍发生早期血栓形成,我们这例患者术后也长期抗血小板治疗,这说明即使在规范抗凝下仍有可能发生导致EBF的早期血栓形成。抗血小板治疗对于生物瓣血栓形成的预防是否有效尚缺乏更全面的研究,我们认为从生物瓣植入后持续退变的角度考虑终生抗血小板治疗应该有其益处,同时术后应加强随访,以期早期发现,早期干预。
生物瓣植入后的免疫炎症反应与EBF的发生也有重要关系。Bajaj等[4]报道1例MVR术后9个月因慢性炎症反应导致纤维结缔组织重度增生引起生物瓣瓣口狭窄的EBF病例,并提出生物瓣置换后应进行仔细的心脏超声随访以避免此类并发症。还有文献报道了1例接受Medtronic 3F无支架生物瓣AVR术后由于慢性炎症反应,在室间隔与左室游离面之间形成纤维带连接,并导致左室流出道狭窄的EBF病例[3]。这2例病例都与生物瓣植入后机体对生物瓣的慢性免疫排斥反应有关。有文献报道无支架瓣膜由于失去瓣架保护导致生物瓣瓣叶结构与受体直接接触而易发生慢性炎症反应导致EBF[24, 25]。有研究发现,同时在某些发生EBF的患者血液中检测到抗生物瓣膜(porcine xenograft valve)抗体,这也证明了机体对生物瓣存在免疫排斥反应[26]。但是,也有研究发现在细胞免疫缺陷小鼠中植入生物瓣膜并不能改变预后,提示免疫反应在瓣膜衰败过程中并不扮演重要角色[27]。目前,关于免疫炎症反应与EBF的确切关系尚不明确。
手术技术也是影响EBF的因素之一。Gualis等[8]报道了1例AVR术后因瓣环缝合不均匀导致生物瓣变形、瓣口狭窄的罕见病例,并指出Mitroflow LF生物瓣由于瓣架过于柔软而易受瓣环缝合不均匀所致的受力偏差影响。
综上所述,导致EBF的病因复杂多样,患者自身代谢异常、生物瓣与保留的自身瓣叶粘连、早期瓣膜血栓形成、慢性免疫排斥反应等是导致EBF的重要原因。在临床工作中,应针对每个患者的具体情况,制定不同的防治措施,比如,纠正代谢紊乱、延长抗凝时间或长期抗血小板治疗、生物瓣置换时如需保留自身瓣膜结构需考虑到与生物瓣叶粘连的可能性并规范手术操作等。生物瓣置换后EBF少见,但后果严重,目前这方面的研究明显不足,需引起心脏外科医生的充分重视。
| [1] | Zilla P, Brink J, Human P, Bezuidenhout D.Prosthetic heart valves: catering for the few[J].Biomaterials,2008,29:385-406. |
| [2] | El Oakley R, Kleine P, Bach D S.Choice of prosthetic heart valve in today's practice[J].Circulation,2008,117:253-256. |
| [3] | Al Kindi A H, Le Huu A, Shum-Tim D.Early stenosis of stentless aortic valve prosthesis: a word of caution[J].Ann Thorac Surg,2012,94:983-985. |
| [4] | Bajaj M, Abuissa H, Main M L.Rapid bioprosthetic valve degeneration resulting in severe mitral stenosis[J].J Am Soc Echocardiogr,2008,21:90. |
| [5] | Bianchi G, Solinas M, Gilmanov D, Glauber M.Early bioprosthetic mitral valve degeneration due to subchordal apparatus impingement[J].J Card Surg,2013,28:122-123. |
| [6] | Fasol R, Lakew F.Early failure of bioprosthesis by preserved mitral leaflets[J].Ann Thorac Surg,2000,70:653-654. |
| [7] | Glaser N, Liska J, Hultman J, Svenarud P.Early bioprosthetic mitral valve failure due to fusion of the cusps[J].Ann Thorac Surg,2013,96:699-701. |
| [8] | Gualis J, Castaño M, Gómez-Plana J, Callejo F.Mitroflow bioprosthesis stent deformation: a rare cause of early prosthetic stenosis[J].Heart Surg Forum,2009,12:E121-E122. |
| [9] | Gutiérrez Morlote J, Obieta Fresnedo I, Carrión Alvarez M, San José Garagarza J M, Cabrera Pozuelo E.[Early thrombosis of aortic porcine bioprosthesis][J].Rev Esp Cardiol,1996,49:773-775. |
| [10] | Ito Y, Ohuchi S, Okubo T, Harima T, Sato M, Igarashi T.[Early calcification of bioprosthetic valve in a hemodialysis patient with secondary hyperparathyroidism;report of a case][J].Kyobu Geka,2013,66:833-836. |
| [11] | Izutani H, Shibukawa T, Kawamoto J, Mochiduki S, Nishikawa D.Early aortic bioprosthetic valve deterioration in an octogenarian[J].Ann Thorac Surg,2008,86:1369-1371. |
| [12] | Robertson J O, Durrani A K, Mihaljevic T.Early failure of bioprostheses caused by adhesion of preserved leaflets after chordal-sparing mitral valve replacement[J].J Thorac Cardiovasc Surg,2008,135:1180-1181. |
| [13] | Takeda K, Lee R.Early bioprosthetic valve failure caused by preserved native mitral valve leaflets[J].Interact Cardiovasc Thorac Surg,2012,14:226-227. |
| [14] | Wiedemann D, Bonaros N, Laufer G, Kocher A.Aortic bioprosthetic valve deterioration 8 months after implantation[J].Ann Thorac Surg,2010,89:277-279. |
| [15] | Bach D S, Metras J, Doty J R, Yun K L, Dumesnil J G, Kon N D.Freedom from structural valve deterioration among patients aged ≤ 60 years undergoing freestyle stentless aortic valve replacement[J].J Heart Valve Dis,2007,16:649-656. |
| [16] | 朱晓东,张宝仁. 心脏外科学[M].北京:人民卫生出版社, 2007: 744-765. |
| [17] | Speer M Y, Giachelli C M.Regulation of cardiovascular calcification[J].Cardiovasc Pathol,2004,13:63-70. |
| [18] | Boeken U, Schurr P, Feindt P, Litmathe J, Kurt M, Gams E.Cardiac valve replacement in patients with end-stage renal failure: impact of prosthesis type on the early postoperative course[J].Thorac Cardiovasc Surg,2010,58:23-27. |
| [19] | Chan V, Jamieson W R, Fleisher A G, Denmark D, Chan F, Germann E.Valve replacement surgery in end-stage renal failure: mechanical prostheses versus bioprostheses[J].Ann Thorac Surg,2006,81:857-862. |
| [20] | Briand M, Pibarot P, Després J P, Voisine P, Dumesnil J G, Dagenais F, et al.Metabolic syndrome is associated with faster degeneration of bioprosthetic valves[J].Circulation,2006,114(1 Suppl):I512-I517. |
| [21] | Nollert G, Miksch J, Kreuzer E, Reichart B.Risk factors for atherosclerosis and the degeneration of pericardial valves after aortic valve replacement[J].J Thorac Cardiovasc Surg,2003,126:965-968. |
| [22] | Antonini-Canterin F, Zuppiroli A, Popescu B A, Granata G, Cervesato E, Piazza R, et al.Effect of statins on the progression of bioprosthetic aortic valve degeneration[J].Am J Cardiol,2003,92:1479-1482. |
| [23] | Kulik A, Masters R G, Bédard P, Hendry P J, Lam B K, Rubens F D,et al.Postoperative lipid-lowering therapy and bioprosthesis structural valve deterioration: justification for a randomised trial?[J].Eur J Cardiothorac Surg,2010,37:139-144. |
| [24] | Nair V, Law K B, Li A Y, Phillips K R, David T E, Butany J.Characterizing the inflammatory reaction in explanted Medtronic Freestyle stentless porcine aortic bioprosthesis over a 6-year period[J].Cardiovasc Pathol,2012,21:158-168. |
| [25] | Butany J, Collins M J, Nair V, Leask R L, Scully H E, Williams W G, et al.Morphological findings in explanted Toronto stentless porcine valves[J].Cardiovasc Pathol,2006,15:41-48. |
| [26] | Rocchini A P, Weesner K M, Heidelberger K, Keren D, Behrendt D, Rosenthal A.Porcine xenograft valve failure in children: an immunologic response[J].Circulation,1981,64(2 Pt 2):II162-II171. |
| [27] | Levy R J, Schoen F J, Howard S L.Mechanism of calcification of porcine bioprosthetic aortic valve cusps: role of T-lymphocytes[J].Am J Cardiol,1983,52:629-631. |
 , Vol. 36
, Vol. 36


