2. 传染病监测预警中国疾病预防控制中心重点实验室研究基地, 海口 571100;
3. 第二军医大学热带医学与公共卫生学系热带传染病学教研室, 上海 200433;
4. 海南省疾病预防控制中心, 海口 570203
2. CDC Key Laboratory of Surveillance and Early-Warning on Infectious Disease, Haikou 571100, Hainan, China;
3. Department of Tropical Infectious Diseases, Faculty of Tropical Medicine and Public Health, Second Military Medical University, Shanghai 200433, China;
4. Center for Disease Control and Prevention of Hainan Province, Haikou 570203, Hainan, China
白纹伊蚊(Aedes albopictus)在我国分布广泛,是多地登革热、登革出血热和基孔肯雅热的重要传播媒介[1, 2]。使用化学杀虫剂一直是控制蚊虫的主要措施,是蚊媒病防控的重要环节。拟除虫菊酯类(下称菊酯类)杀虫剂因具高效低毒的特点,从20世纪80年代到目前都是常用的、用量较多的杀虫剂,但长期大量使用已导致我国多地白纹伊蚊群体对菊酯类杀虫剂产生了不同水平的抗药性[2, 3, 4, 5, 6, 7, 8, 9]。
蚊虫对杀虫剂的抗性机制主要包括代谢抗性和靶标改变,靶标改变是因杀虫剂的作用靶点突变导致蚊虫对其敏感度下降,产生抗药性[10]。菊酯类杀虫剂最主要的作用靶点是与其抗性相关的击倒抗性(knockdown resistance,kdr)基因突变。已证实击倒抗性的分子机制为蚊虫神经细胞膜上电压门控钠离子通道(voltage-gated sodium channel,VGSC)编码基因出现点突变,导致相应氨基酸改变,钠通道结构变化,与杀虫剂的结合能力减弱,敏感性降低[11, 12, 13, 14, 15, 16]。
我国海南省地处热带北缘,属热带季风气候,海口市位于海南省北部。据历史记录,登革热曾于1979—1982年和1985—1988年2次在海南全岛暴发流行,波及周边多个市县,病死率达78.5/10万[17]。近年来,毗邻国家和地区如泰国、菲律宾[18],以及我国的广东、福建和云南等地[17]的登革热疫情持续存在。2014年,广东省大规模暴发流行登革热疫情,报告病例超过45 000例,海南省也出现本地登革热病例,故登革热的防控形势严峻[2]。近年的调查显示,在海南岛包括海口市的中华按蚊(Anopheles sinensis)、迷走按蚊(An. vagus)和微小按蚊(An. minimus)等对菊酯类杀虫剂已产生一定水平的抗药性[19, 20, 21],也检测到部分按蚊的kdr基因产生了突变[16, 21],而白纹伊蚊的抗性情况目前鲜见报道。本研究在海口市选择代表性地点采集白纹伊蚊,在生物测定溴氰菊酯和氯菊酯敏感性的基础上,对应检测其kdr突变型,并探讨其间的相互关系,为当地制定科学合理的防控技术方案提供科学依据。
1 材料和方法 1.1 供试蚊虫将海口市划分为东、南、西、北、中5个片区,并结合不同的生态环境,选择5个代表性地点,即新埠岛(城镇居民区)、龙塘镇(农村)、石山镇(农村)、白沙门(公园)和花卉市场(绿化带)。于2015年4月和5月在上述各点的孳生地采集白纹伊蚊幼虫,带回实验室常规养殖,待羽化后喂血,之后收集虫卵,依据成虫形态特征鉴定为白纹伊蚊[1]。将其卵下水孵化,养殖至Ⅳ龄初幼虫时供实验。白纹伊蚊敏感品系引自第二军医大学热带传染病学教研室。
1.2 主要试剂测定用杀虫剂标准品95.95%溴氰菊酯和99.09%氯菊酯,均由中国疾病预防控制中心传染病预防控制所媒介生物控制室提供。基因组提取试剂盒购自北京艾德莱生物科技有限公司,Taq PCR预混液和DNA标记物购自天根生化科技(北京)有限公司,引物由铂尚生物技术(上海)有限公司合成。
1.3 杀虫剂敏感性测试 1.3.1 幼虫浸渍法操作步骤依照《全国重要病媒生物抗药性监测(试行)方案》(中疾控传发[2014]9号)中的方法进行,该方案是基于WHO推荐的测定方法[22]制定。用丙酮将杀虫剂原药配制成5~7个系列浓度药液,在250 mL烧杯中加入200 mL脱氯水,再加入0.1 mL相应药液,充分混匀,然后将20~25条供试幼虫放入其中,各浓度设3个重复,对照组加入等量丙酮。在养蚊室[温度(26±1)℃、湿度(70±10)%、光周期10 h∶14 h]中饲养24 h,记录死亡数。若化蛹率>10%,对照组死亡率>20%,则视为实验无效。
1.3.2 抗性判定标准幼虫死亡的标准是用锐器触动不动或抽搐、震颤不能主动逃避。依据所测的数据采用POLO-PC系统软件计算各药物的半数致死浓度(LC50)、90%致死浓度(LC90)及其95%置信区间(CI)[22],并与敏感试虫测试结果比较。在测试浓度中死亡的个体视为对杀虫剂敏感的表型,存活的个体则是抗性的表型。按照抗性倍数(R/S)确定抗性级别,R/S=现场试虫LC50/敏感试虫LC50。若R/S≤3,则为敏感群体;3
将各采集地杀虫剂敏感性测试中存活和死亡的幼虫分别于75%乙醇中保存,进行kdr基因突变型检测。
1.4.1 kdr基因扩增和测序使用试剂盒抽提单蚊基因组DNA,以此为模板扩增白纹伊蚊的kdr基因部分片段。参照文献[12]合成引物,引物序列:正向aegSCF7 5′-GAG AAC TCG CCG ATG AAC TT-3′,反向 aegSCR8 5′-TAG CTT TCA GCG GCT TCT TC-3′。PCR反应体系中包含2×Taq PCR预混液12.5 μL,10 μmol/L正、反向引物各1 μL,模板1 μL,加双蒸水至25 μL。反应条件:94℃ 2 min;94℃ 30 s,52℃ 30 s,72℃ 30 s,共35个循环;72℃ 8 min。扩增产物经1%琼脂糖凝胶电泳检测后,送铂尚生物技术(上海)有限公司,应用四色荧光标记的双脱氧末端终止法,以正向引物测序。
1.4.2 数据分析 使用Seqman、BioEdit和ClustalX等软件对测得的kdr基因部分序列进行峰图分析和比对,观察各位点的突变情况,确定等位基因类型和基因型,分别统计和计算各采集地样本kdr基因型的频率。
1.5 统计学处理采用SPSS 15.0统计软件进行统计学分析,以χ2检验法分析kdr基因型与生物测定的杀虫剂种类及抗药性表型的相互关系。检验水准(α)为0.05。
2 结 果 2.1 生物测定的结果结果显示,新埠岛的白纹伊蚊群体对2种杀虫剂均为敏感。而花卉市场和白沙门的群体对2种杀虫剂均产生抗性,花卉市场的群体对溴氰菊酯的抗性倍数高达436.36。龙塘镇和石山镇的群体对氯菊酯均为敏感,对溴氰菊酯的抗性为低度(9.09)或中度(18.18)。详见表 1。
|
|
表 1 海口市白纹伊蚊幼虫对溴氰菊酯和氯菊酯的敏感性生物测定结果 Tab 1 Susceptibility of Aedes albopictus larvae to deltamethrin and permethrin in Haikou City |
本研究测定的序列在GenBank上进行Blast比对,与白纹伊蚊(KC152046.1)和埃及伊蚊(A. aegypti)(KM677279.1)VGSC基因第3编码区的部分序列一致性达99%。
将所有的317条白纹伊蚊kdr基因部分片段序列进行比对分析,发现在1 534位点存在点突变,共检测到3种等位基因类型,即编码苯丙氨酸的野生型TTC(F1534)和2种突变等位基因,编码半胱氨酸的TGC(F1534C)、编码丝氨酸的TCC(F1534S)。获得的5种基因型和频率分别为野生型纯合子TTC/TTC(197,62.15%)、野生/突变型杂合子TTC/TGC(2,0.63%)、TTC/TCC(51,16.09%),以及突变型纯合子TCC/TCC(66,20.82%)和突变型杂合子TGC/TCC(1,0.32%)。详见表 2。
|
|
表 2 海口市白纹伊蚊对菊酯类杀虫剂生物测定标本的kdr基因型 Tab 2 kdr genotypes in Aedes albopictus populations to deltamethrin and permethrin bioassay groups in Haikou City |
本研究对应分析了白纹伊蚊抗性群体的kdr基因型频率(图 1),显示在溴氰菊酯抗性群体中kdr野生型与突变型的基因频率与氯菊酯抗性群体间的差异有统计学意义(P<0.01),说明kdr突变基因型频率与氯菊酯抗性表型关系密切。
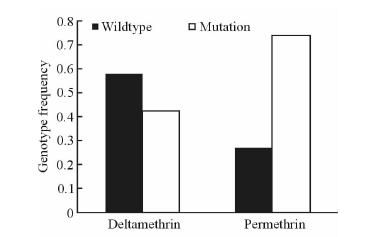
|
图 1 海口市白纹伊蚊溴氰菊酯和氯菊酯抗性群体的kdr基因型频率 Fig 1 kdr genotype frequency of Aedes albopictus resistant population to deltamethrin and permethrin in Haikou City |
在白纹伊蚊溴氰菊酯测试组的74只敏感表型个体中,包含kdr野生型51只(68.91%),kdr突变型23只(31.08%);在88只抗性表型个体中,野生型51只(57.95%),突变型37只(42.05%),见表 2。接触溴氰菊酯后敏感表型与抗性表型个体的kdr基因型间的差异无统计学意义(P>0.05)。
在氯菊酯测试组的73只敏感表型个体中,包含kdr野生型49只(67.12%),kdr突变型24只(32.88%);在82只抗性个体中,野生型46只(56.10%),突变型36只(43.90%),见表 2。接触氯菊酯后敏感表型与抗性表型个体的kdr基因型间的差异无统计学意义(P>0.05)。
将所有的敏感和抗性表型个体进行分析,结果显示,接触菊酯类杀虫剂后,在敏感表型个体中,kdr野生型占68.03%,突变型为31.97%;抗性个体中,野生型和突变型分别为57.06%和42.94%(表 2);敏感表型与抗性表型个体的kdr基因型间的差异有统计学意义(P<0.05),抗性表型中的突变型基因型频率明显多于敏感表型。
3 讨 论白纹伊蚊的幼虫主要孳生于容器小积水中,如水生植物、盆罐等,一般通过翻盆倒罐、清除积水等措施控制其群体数量,接触杀虫剂的机会相对较少,客观上减缓了其对杀虫剂产生抗药性的进程。但在白纹伊蚊成虫阶段,仍可直接或间接接触大量杀虫剂,如2014年广东省使用杀虫剂1 985吨,灭蚊面积47 351万平方米[23]。因此,有报道在广东、浙江、陕西和安徽等地白纹伊蚊群体对不同杀虫剂产生了不同水平的抗药性[2, 3, 4, 5, 6, 7, 8, 9]。抗药性监测数据显示,在北京、青岛、郑州、慈溪、衢州、南昌和海口的白纹伊蚊对溴氰菊酯抗性达3~12倍[2]。本研究在海口市选择不同的环境采集白纹伊蚊,生物测定其对溴氰菊酯和氯菊酯的抗药性,结果显示,仅农村(龙塘镇和石山镇)和城镇(新埠岛)环境对氯菊酯或溴氰菊酯杀虫剂敏感;而市区的公园(白沙门)和绿化带(花卉市场)环境的白纹伊蚊群体对2种杀虫剂均产生抗性。总体来看,海口市的白纹伊蚊对溴氰菊酯的抗性高于氯菊酯,这是因溴氰菊酯所用时间和数量均长于和大于氯菊酯所致。本研究不同环境白纹伊蚊抗性水平不同的结果,与使用杀虫剂的种类和数量密切相关,如花卉市场的孳生地较多(售卖水生植物),是重点的蚊虫控制区域,杀虫剂的使用相对于其他环境种类最多,数量最大,频率也最高,故该环境的白纹伊蚊群体抗性倍数也最高,对溴氰菊酯的抗性倍数高达436.36。针对本研究生物测定当地白纹伊蚊对杀虫剂的抗药性结果,提示未来对白纹伊蚊的防制应注重统筹规划杀虫剂的合理使用,同时也需开展对其他种类杀虫剂的抗性检测,以便及时调整使用的杀虫剂,减缓抗药性的发生和发展。另外,及时清理清除孳生地,减少杀虫剂的使用频率,才是有效防制白纹伊蚊和治理抗药性的根本措施。
多项研究表明,不同伊蚊的VGSC基因的不同位点突变与抗性表型相关,如埃及伊蚊不同抗性群体,VGSC基因突变的密码子有3个(I1011M/V,V1016G/I和F1534C)与DDT和菊酯类杀虫剂抗性相关[24, 25, 26, 27, 28, 29]。S989P仅与菊酯类杀虫剂抗性相关[30]。在新加坡的白纹伊蚊抗性群体26个个体中73.1%为F1534C[12]。 作者对我国海口的白纹伊蚊进行了kdr基因型与生物测定数据相关性分析,发现VGSC基因的密码子F1534的突变与溴氰菊酯和氯菊酯杀虫剂抗性表型相关,且与氯菊酯的抗性关系更加密切,与其他研究者的结论一致[11, 12, 13, 14]。本研究在我国首次发现白纹伊蚊中存在kdr等位基因的F1534C,并检测到了新的等位基因突变类型F1534S,而是否存在其他的突变位点尚需进一步研究。
介导蚊虫产生抗性包括代谢解毒机制和击倒抗性机制,代谢抗性是由于代谢解毒酶的活性增高,使杀虫剂的代谢加速,导致蚊虫产生抗性,但因酶活性检测需要新鲜样本而较难在现场实现。击倒抗性与蚊虫神经系统对杀虫剂敏感度下降有关,击倒抗性可以通过检测kdr基因突变确定。若蚊虫的抗性表型与kdr基因突变存在相关性,则可通过检测kdr突变判断现场蚊虫的抗性水平,也可避免生物测定中的一些主观因素(如死亡个体的判定)导致的误差。本研究结果支持此观点,即海口的白纹伊蚊群体对菊酯类杀虫剂的抗药性与kdr突变密切相关,提示抗性由击倒抗性机制介导,但并不能排除代谢机制在其中的贡献,因为在印度、马来西亚和斯里兰卡等的白纹伊蚊抗性群体中未见kdr突变型[11, 13, 14, 30, 31, 32],推测可能是在上述群体中代谢解毒机制足以清除拟除虫菊酯,使VGSC基因不会受到强大的选择压力,无需突变,与我国某些地区的中华按蚊[16]情况类似;另外,kdr等位基因在不同群体间的扩散可能受到地理屏障的阻碍,以及有效群体大小的影响。因此,白纹伊蚊群体中kdr等位基因的产生和扩散机制需要进一步研究。
| [1] | 陆宝麟.中国动物志昆虫纲第八卷双翅目蚊科(上)[M].北京:科学出版社,1997:243-245. |
| [2] | 孟凤霞,王义冠,冯 磊,刘起勇. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志,2015,26:2-10. |
| [3] | 李成玲,胡志刚,江毅民,伍浩荣,罗小蕾,严子锵.广州地区白纹伊蚊对常用杀虫剂抗药性的初步研究[J].热带医学杂志,2010,10:429-430,447. |
| [4] | 徐建敏,梁雪莹,严子锵,胡志刚,江毅民,李成玲.白纹伊蚊对3种拟除虫菊酯类杀虫剂的抗药性调查[J].中华卫生杀虫药械,2014,20:439-440,443. |
| [5] | 孙养信,吕 文,霍丽霞,周以军,王 博.陕西省白纹伊蚊抗药性研究和防制策略[J].中国媒介生物学及控制杂志,2013,24:47-49. |
| [6] | 蔡松武,林立丰,段金花,阴伟雄.广东省白纹伊蚊抗药性现状与抗性治理对策[J].中国媒介生物学及控制杂志,2006,17:274-276. |
| [7] | 龚震宇,侯 娟,任樟尧,凌 锋,郭 颂.浙江省淡色库蚊和白纹伊蚊对常用化学杀虫剂的抗性调查[J]. 中国媒介生物学及控制杂志,2012,23:458-460. |
| [8] | 蔡 蓉,邵宗贤,范 刚,陈 跃.淮安市不同生境白纹伊蚊对9种化学杀虫剂的抗药性研究[J].中国预防医学杂志,2015,16:65-67. |
| [9] | 李袁飒,孟凤霞,蔡松武,刘起勇.广东省湛江市抗溴氰菊酯白纹伊蚊代谢酶活性及其特征研究[J].中国媒介生物学及控制杂志,2013,24:103-107. |
| [10] | Hemingway J, Ranson H. Insecticide resistance in insect vectors of human disease[J]. Ann Rev Entomol, 2000, 45: 369-389. |
| [11] | Ishak I H, Jaal Z, Ranson H, Wondji C S. Contrasting patterns of insecticide resistance and knockdown resistance (kdr) in the dengue vectors Aedes aegypti and Aedes albopictus from Malaysia[J]. Parasit Vectors, 2015, 8: 181. |
| [12] | Kasai S, Ng L C, Lam-Phua S G, Tang C S, Itokawa K, Komagata O, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64: 217-221. |
| [13] | Kushwah R B, Dykes C L, Kapoor N, Adak T, Singh O P. Pyrethroid-resistance and presence of two knockdown resistance (kdr) mutations, F1534C and a novel mutation T1520I, in Indian Aedes aegypti[J]. PLoS Negl Trop Dis, 2015, 9: e3332. |
| [14] | Kushwah R B, Mallick P K, Ravikumar H, Dev V, Kapoor N, Adak T, et al. Status of DDT and pyrethroid resistance in Indian Aedes albopictus and absence of knockdown resistance (kdr) mutation[J]. J Vector Borne Dis, 2015, 52: 95-98. |
| [15] | Ibrahim S S, Manu Y A, Tukur Z, Tuker Z, Irving H, Wongdji C S. High frequency of kdrL1014F is associated with pyrethroid resistance in Anopheles coluzzii in Sudan savannah of northern Nigeria[J]. BMC Infect Dis, 2014, 14: 441. |
| [16] | Wang Y, Yu W Q, Shi H, Yang Z Z, Xu J N, Ma Y J. Historical survey of the kdr mutations in the populations of Anopheles sinensis in China in 1996-2014[J]. Malar J, 2015, 14: 120. |
| [17] | 杜建伟,潘先海.中国登革热流行概况与流行特征[J].中华流行病学杂志,2010,31:1429-1433. |
| [18] | WHO. Dengue guidelines for diagnosis, treatment, prevention and control[M]. Geneva:World Health Organization, 2009: 14. |
| [19] | 孙定炜,王善青,卓开仁,曾林海,李善干. 海南省中华按蚊对3种杀虫剂的抗药性研究[J]. 中国寄生虫学与寄生虫病杂志,2014,32:127-129. |
| [20] | 曾林海,王善青,孙定炜,赵 伟,李善干,杨 霞. 海南省部分地区传疟媒介按蚊对4种常用杀虫剂的抗药性测定[J]. 中国寄生虫学与寄生虫病杂志,2011,29:200-203. |
| [21] | Qin Q, Li Y, Zhong D B, Zhou N, Chang X L, Li C Y, et al. Insecticide resistance of Anopheles sinensis and An. vagus in Hainan Island, a malaria-endemic area of China[J]. Parasit Vectors, 2014,7: 92. |
| [22] | WHO. Guidelines for laboratory and field testing of mosquito larvicides[M]. Geneva:World Health Organization, 2005. |
| [23] | 广东省爱国卫生运动委员会. 我省全面开展以灭蚊为重点的爱国卫生运动[EB/OL]. (2014-09-20)[2015-01-21].http://www.gdaw.gov.cn/ArtieleShow.asp?ArticleID=5909. |
| [24] | Brengues C, Hawkes N J, Chandre F, Mccarrol L, Duchon S, Guillet P, et al. Pyrethroid and DDT cross-resistance in Aedes aegypti is correlated with novel mutations in the voltage-gated sodium channel gene[J]. Med Vet Entomol, 2003, 17: 87-94. |
| [25] | Harris A F, Rajatileka S, Ranson H. Pyrethroid resistance in Aedes aegypti from Grand Cayman[J]. Am J Trop Med Hyg, 2010, 83: 277-284. |
| [26] | Saavedra-Rodriguez K, Urdaneta-Marquez L, Rajatileka S, Moulton M, Flores A E, Fernandez-Salas I, et al. A mutation in the voltage-gated sodium channel gene associated with pyrethroid resistance in Latin American Aedes aegypti[J]. Insect Mol Biol, 2007, 16: 785-798. |
| [27] | Yanola J, Somboon P, Walton C, Nachaiwieng W, Somwang P, Prapanthadara L A. High-throughput assays for detection of the F1534C mutation in the voltage-gated sodium channel gene in permethrin-resistant Aedes aegypti and the distribution of this mutation throughout Thailand[J]. Trop Med Int Health, 2011, 16: 501-509. |
| [28] | Kawada H, Higa Y, Komagata O, Kasai S, Tomita T, Thi Yen N, et al. Widespread distribution of a newly found point mutation in voltage-gated sodium channel in pyrethroid-resistant Aedes aegypti populations in Vietnam[J]. PLoS Negl Trop Dis, 2009, 3: e527. |
| [29] | Kawada H, Oo S Z, Thaung S, Kawashima E, Maung Y N, Thu H M, et al. Co-occurrence of point mutations in the voltage-gated sodium channel of pyrethroid-resistant Aedes aegypti populations in Myanmar[J]. PLoS Negl Trop Dis, 2014, 8: e3032. |
| [30] | Vontas J, Kioulos E, Pavlidi N, Morou E, della Torre A, Ranson H. Insecticide resistance in the major dengue vectors Aedes albopictus and Aedes aegypti[J]. Pest Biochem Physiol, 2012, 104: 126-131. |
| [31] | Tantely M L, Tortosa P, Alout H, Berticat C, Berthomieu A, Rutee A, et al. Insecticide resistance in Culex pipiens quinquefasciatus and Aedes albopictus mosquitoes from La Reunion Island[J]. Insect Biochem Mol Biol, 2010, 40: 317-324. |
| [32] | Liu N, Xu Q, Zhang L. Sodium channel gene expression in mosquitoes, Aedes albopictus (S)[J]. Insect Sci, 2006, 13:431-436. |
 2015, Vol. 36
2015, Vol. 36


