2. 第二军医大学长征医院肾内科, 解放军肾脏病研究所, 上海 200003;
3. 第二军医大学东方肝胆外科医院信号转导研究室, 上海 200438
2. Department of Nephrology, Kidney Institute of PLA, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China;
3. International Cooperation Laboratory on Signal Transduction, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
慢性肾脏病(chronic kidney disease,CKD)已成为全球范围内越来越严重的公共卫生问题。肾小球系膜细胞在CKD进展中的地位和作用逐渐受到研究者的重视。系膜细胞在不同的损伤因素下,可出现凋亡、裂解、迁移等现象,进一步造成其他肾脏固有细胞的损害,从而引起CKD的持续进展。近年来,醛固酮已成为公认的系膜细胞损伤因子之一,高醛固酮刺激在肾脏的炎症状态及纤维化发展过程中起重要作用[1, 2, 3, 4]。研究发现,醛固酮通过激活表皮生长因子受体系统,进一步活化了RAS/MAPK和PI3K/Akt信号通路,从而促进肾小球系膜细胞增殖及向成纤维细胞表型转化,增加系膜基质的分泌[5, 6],促进CKD的发展。
自噬是体内最基本的生理过程之一。在炎症、凋亡等生理及病理过程中,多伴随着细胞自噬活性的变化,并发挥着极为重要的作用[7, 8]。已有研究表明自噬活性的异常改变与肿瘤、神经退行性疾病、心血管疾病以及感染等密切相关[9]。自噬在肾脏疾病中的作用正受到越来越多的关注。不同条件下细胞自噬活性的变化对于肾脏的生理和病理都有着重要的影响[10]。有研究发现,在敲除自噬关键基因Beclin-1纯合子小鼠的肾脏,系膜区Ⅰ型胶原的沉积明显较野生型增加,证实系膜细胞自噬活性的改变参与了细胞内Ⅰ型胶原的降解过程,进而参与了肾脏纤维化的进程[11]。
研究发现,醛固酮作为来自循环的系膜细胞损伤因子,和维持系膜细胞自稳态及增加系膜基质清除的生理过程自噬,都参与了系膜细胞的纤维化表型转化及随之而来的CKD进展过程。不同的是,醛固酮可以促进这一过程,而在系膜细胞内激活自噬可以抑制这种转化。本研究通过观察在醛固酮干预下系膜细胞自噬活性的变化,研究醛固酮与系膜细胞自噬的关系,明确醛固酮对于系膜细胞自噬的影响及其在系膜细胞氧化应激损伤中的作用,为后续研究奠定基础。
1 材料和方法 1.1 实验材料GFP-LC3质粒由中国科学院赵慕钧教授惠赠。人肾小球系膜细胞系(HMCL)来自第二军医大学长征医院转化医学中心实验室。高糖DMEM培养基、胎牛血清(FBS)及胰蛋白酶购自Gibco BRL公司。血清饥饿培养基EBSS、醛固酮购自Sigma公司。二甲亚砜(DMSO)、过氧化氢(H2O2)购自上海试剂一厂。雷帕霉素购自Gene Operation公司。多克隆兔及单克隆鼠抗LC3抗体购自日本MBL公司。SQSTM1/P62抗体购自美国Cell Signaling公司。聚腺苷二磷酸-核糖聚合酶(PARP)及其剪切体Cleaved-PARP、GAPDH抗体购自美国Abcam公司。荧光鼠、兔第二抗体购自上海华舜生物技术有限公司。
1.2 实验仪器蛋白电泳槽(Bio-Rad)、转膜仪(Bio-Rad)、多功能酶标仪(BioTek公司)、Odyssey 荧光扫描仪(Lincoln公司)、激光共聚焦显微镜(Leica TCS SP5,德国莱卡显微系统有限公司);透射电子显微镜(H-7650,日立公司)。
1.3 醛固酮对体外培养的HMCL自噬的影响 1.3.1 蛋白质印迹法检测自噬相关蛋白的表达(1)饥饿诱导自噬:对数生长期的细胞用高糖DMEM培养基(含10%FBS)贴壁培养至融合度50%时,换用EBSS培养基激活细胞自噬,并将细胞分为空白对照组、醛固酮10-6 mol/L孵育组、醛固酮10-7 mol/L孵育组和醛固酮10-8 mol/L孵育组,分别加入0、10-6、10-7、10-8 mol/L醛固酮。然后放入37℃的5% CO2培养箱中培养,于干预后0、6、12、24、48 h收取细胞样品,每个实验重复3次。采用蛋白质印迹法检测HMCL中自噬相关蛋白标记物LC3、SQSTM1/P62的表达。使用Odyssey 荧光扫描仪自带程序进行荧光扫描及半定量分析。 (2)雷帕霉素诱导自噬:使用1 ng/mL雷帕霉素诱导HMCL 自噬激活并分为雷帕霉素组和雷帕霉素+10-7 mol/L醛固酮组。观察时间点为0、6、12、24、48 h。采用蛋白质印迹法检测HMCL自噬相关的蛋白标记物LC3、P62/SQSTM1的表达。
1.3.2 共聚焦荧光显微镜观察自噬点的变化实验分为6组:(1)高糖DMEM培养基培养(普通培养,下同)转入GFP-LC3质粒的HMCL;(2)普通培养的转入GFP-LC3质粒的HMCL +10-7 mol/L醛固酮组;(3)EBSS培养组;(4)EBSS+10-7 mol/L醛固酮组;(5)1 ng/mL雷帕霉素组;(6)1 ng/mL雷帕霉素+10-7 mol/L醛固酮组。分组计数后传代,每皿细胞1×105个。24 h后转染GFP-LC3质粒,转染成功后于37℃孵育箱内培养24 h。更换培养基并调整每皿培养基体积为2 mL。待细胞状态稳定,约3 h后给予分组刺激。醛固酮干预浓度选取10-7 mol/L,雷帕霉素干预浓度根据文献报道选择[12]。根据预实验的结果选取系膜细胞自噬变化最为明显的干预后12 h作为观察时间点,在激光共聚焦显微镜下观察、拍照。镜下每组分别计数随机5个视野中所有细胞的荧光自噬点的数量,进行统计学分析。
1.3.3 电子显微镜观察自噬泡数量的变化实验分为6组:(1)普通培养组;(2)EBSS培养组;(3)1 ng/mL雷帕霉素组;(4)10-7 mol/L醛固酮组;(5)EBSS+10-7 mol/L醛固酮组;(6)1 ng/mL 雷帕霉素+10-7 mol/L醛固酮组。干预后12 h进行观察。细胞分组干预后,常规冲洗消化后加入1.5 mL EP管,常规离心及重悬后于4℃悬浮固定3~4 h。在电镜观察前再次采用血清法固定标本,以2.5%戊二醛固定12 min后离心,然后沿EP管壁加入100 μL抗凝的大鼠血清;混合均匀后5 000×g离心12 min,细胞成团后弃去上清液,再次缓慢滴入2.5%戊二醛,避免细胞分散,静置于4℃冰箱中,使用电镜专用铜网制作电镜标本并观察。对每组干预的细胞,通过计数随机5个形态完整的细胞在10 000倍下可明确分辨的自噬泡的数量,最后取平均值来代表该组的自噬活性水平。
1.4 醛固酮干预对氧化应激下HMCL细胞凋亡的影响分为对照组、2.5×10-6 mol/L过氧化氢组、10-7 mol/L醛固酮组、10-7 mol/L醛固酮+2.5×10-6 mol/L过氧化氢组。醛固酮干预12 h后给予过氧化氢刺激,6 h后在光镜下观察细胞形态并计数凋亡细胞比率。在过氧化氢刺激0、3、6、12 h时收集蛋白,用蛋白质免疫印迹法检测各组PARP剪切体的表达变化并进行半定量分析。
1.5 统计学处理应用SPSS11.0统计软件对资料进行分析,计量资料以 x±s 表示,两组间比较采用t检验。 检验水准(α)为0.05。
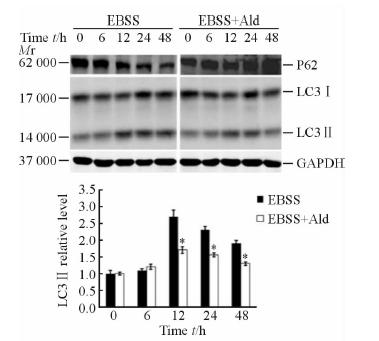
2 结 果 2.1 醛固酮对HMCL自噬激活的影响 2.1.1 蛋白质印迹法检测自噬相关蛋白表达的变化EBSS可诱导HMCL细胞自噬激活,从饥饿12 h开始,细胞LC3Ⅰ向LC3Ⅱ的转化明显增加;相应的,细胞内SQSTM1/P62表达呈下降趋势。10-6、10-7、10-8 mol/L醛固酮均可抑制HMCL的自噬激活,其抑制效应随醛固酮浓度的增加而增强。本研究选择抑制自噬效应较强且更接近生理浓度的10-7 mol/L 醛固酮作为后续研究的干预浓度。图 1显示,经10-7 mol/L醛固酮干预后,EBSS诱导的HMCL自噬激活被抑制,LC3Ⅱ表达增加的幅度及SQSTM1/P62表达降低的幅度减小,提示HMCL自噬活性下降。半定量分析显示,抑制效果较为明显的时间点为12、24 h,其抑制效应分别为40%和35%。
|
图 1 蛋白质印迹法检测醛固酮(10-7 mol/L)对血清饥饿诱导的HMCL自噬激活的抑制作用 Fig 1 Serum-starvation-induced autophagy activation in HMCL was inhibited by 10-7 mol/L Ald (Western blotting) Ald: Aldosterone; EBSS: Earle’s balanced salt solution;HMCL:Human mesangial cell line. *P<0.05 vs EBSS group. n=3,x±s |
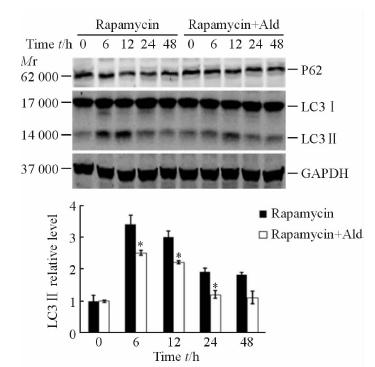
雷帕霉素可以时间依赖性地激活自噬,在施加干预后6、12 h时这种激活作用较为明显。10-7 mol/L醛固酮可以抑制雷帕霉素对HMCL自噬激活的作用(图 2)。半定量分析结果显示,抑制效果最为明确的时间点为12 h,其抑制效应为30%。本研究选择干预12 h作为后续研究的观察时间点。
|
图 2 蛋白质印迹法检测醛固酮(10-7 mol/L)对雷帕霉素诱导的系膜细胞自噬的抑制作用 Fig 2 Rapamycin-induced autophagy activation in HCML was inhibited by 10-7 mol/L Ald (Western blotting) Ald: Aldosterone. *P<0.05 vs rapamycin group. n=3,x±s |
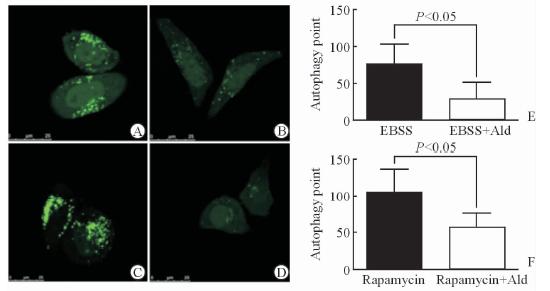
向HMCL细胞内转入GFP-LC3质粒,共聚焦检测结果显示,饥饿可增加细胞自噬点的数量(图 3A),给予10-7 mol/L醛固酮干预12 h可降低饥饿导致的系膜细胞自噬点的增加(图 3B),降低比率为60%(图 3E)。10-7 mol/L醛固酮处理也可以降低雷帕霉素导致的细胞自噬点增加,降低比率为47%(图 3C、3D、3F)。
|
图 3 共聚焦荧光显微镜观察醛固酮干预后系膜细胞内自噬激活情况 Fig 3 Detection of autophagy activation in mesangial cells by fluorescence microscopy A: EBSS group; B: EBSS+aldosterone 10-7 mol/L group; C: Rapamycin 1 ng/mL group; D: Rapamycin 1 ng/mL + aldosterone 10-7 mol/L group; E: Comparison of the number of autophagy points between A and B; F: Comparison of the number of autophagy points between C and D. Ald: Aldosterone; EBSS: Earle’s balanced salt solution. Original magnification: ×630 (A-D). n=3,x±s |
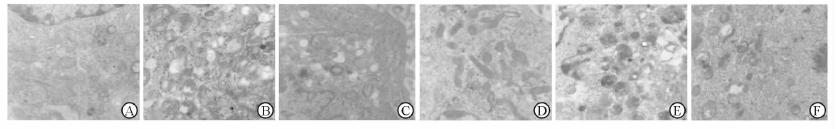
与普通培养组(图 4A)比较,饥饿处理和雷帕霉素干预诱导了系膜细胞自噬泡数量的增加并呈局部聚集状态(图 4B、4C)。醛固酮单独处理正常细胞对细胞自噬无明显影响(图 4D)。醛固酮处理后可明显减少饥饿和雷帕霉诱导的系膜细胞自噬泡的增加(图 4E、4F)。
|
图 4 电镜观察醛固酮对系膜细胞自噬泡形成的影响 Fig 4 Effect of aldosterone on autophagic vacuoles forming in mesangial cells by transmission electron microscopy A: Control group; B: EBSS group; C: Rapamycin 1 ng/mL group; D: Aldosterone 10-7 mol/L group; E: EBSS + aldosterone 10-7 mol/L group; F: Rapamycin + aldosterone 10-7 mol/L group. Original magnification: × 10 000 |
光镜下观察细胞形态及计数凋亡细胞比率显示,经醛固酮干预后增加了过氧化氢诱导的系膜细胞凋亡(图 5A)。蛋白质印迹结果(图 5B)显示:3、6、12 h时醛固酮干预后明显增加了PARP蛋白剪切体的表达(P<0.05),提示醛固酮诱导的自噬抑制使得系膜细胞在面临氧化应激的刺激时更容易发生凋亡。
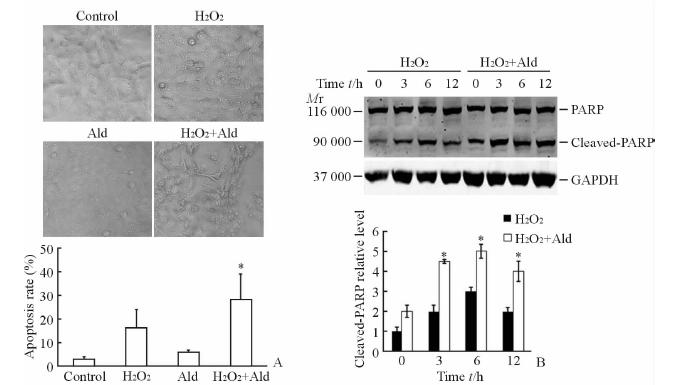
|
图 5 醛固酮干预对自噬抑制细胞凋亡的影响 Fig 5 Influence of aldosterone on the apoptosis of autophagy inhibited mesangial cells A: Apoptotic cells were observed by light microscopy; B: Aldosterone intervention significantly increased the expression of PARP spliced variant. H2O2: Hydrogen peroxide (2.5×10-6 mol/L); Ald: Aldosterone (10-7 mol/L); PARP: Poly(ADP-ribose)polymerase. Original magnification: ×400 (A). *P<0.05 vs H2O2 group. n=3,x±s |
醛固酮可以造成肾损伤,系膜细胞正是其主要效应细胞之一。在原发性醛固酮增多症及CKD “醛固酮逃逸”的患者之中,异常升高的醛固酮作为内源性肾损伤因子,促进了肾小球系膜细胞的损伤和肾纤维化[13]。而作为细胞基本的生理过程之一,自噬的活性变化广泛参与了饥饿、氧化应激、缺血再灌注等刺激下多种细胞复杂的生理及病理应激,并在其中发挥着重要的作用[7] 。本研究关注于醛固酮干预后系膜细胞自噬活性是否发生了变化以及这一变化对细胞在进一步的氧化应激损伤中的影响。
正常细胞内LC3蛋白以LC3Ⅰ和LC3Ⅱ两种形式存在,细胞发生自噬时LC3Ⅰ向LC3Ⅱ转化,LC3Ⅱ/LC3Ⅰ直接反映了细胞自噬活性的改变,其中LC3Ⅱ定位于前自噬泡和自噬泡膜表面,被认为是自噬活性的标志分子。本研究中,饥饿及雷帕霉素都可成功激活系膜细胞的自噬,LC3Ⅱ的表达随干预时间的延长而逐渐增加;而在此基础上增加醛固酮干预后,细胞LC3Ⅱ蛋白表达明显降低,提示细胞自噬激活被醛固酮所抑制。将GFP-LC3 质粒转染目标细胞,利用LC3Ⅱ定位于自噬泡表面的特征,通过荧光强度的变化监测细胞自噬的进程是研究细胞自噬的重要方法。本研究也用此方法证实了醛固酮干预后系膜细胞的自噬激活受到了抑制,表现为共聚焦显微镜下细胞内荧光自噬点数量的减少。电镜下观察自噬泡的数量是检测自噬的金指标,本研究通过电镜观察系膜细胞自噬泡数量的变化,同样证实了醛固酮干预可以抑制系膜细胞的自噬激活。
本实验还发现,单纯的高浓度醛固酮并不能明显增加细胞的凋亡比率,但处于高醛固酮造成的自噬抑制的状态下,细胞在受到氧化应激的刺激时更容易发生凋亡。这与临床上观察到的“醛固酮逃逸”的患者肾脏损害加重相吻合[14, 15]。因为CKD患者本身可能存在肾脏血流量的不足,系膜区细胞数量的增加以及低蛋白血症、缺氧等类似于营养不良状态,这些因素在正常条件下可以激活自噬,激活的自噬能够在一定程度保护细胞对抗外界不良的刺激。 但如果患者出现“醛固酮逃逸”,以及局部肾素-血管紧张素-醛固酮系统的激活,造成高醛固酮血症持续抑制细胞自噬,降低了自噬对于细胞的保护作用,则必然加重系膜细胞的损伤,导致这些患者肾损害的持续进展。因此,本研究结果在一定程度上佐证了醛固酮的肾脏毒性可能与其抑制了包括系膜细胞在内的肾脏细胞的自噬激活有关。
自噬是非常复杂又极为精密的体内调控系统,在肾脏的细胞及不同的肾脏疾病中都有着重要的作用。本研究还发现,醛固酮能够抑制雷帕霉素诱导的系膜细胞自噬激活,基于此我们对于相关的信号通路及靶点蛋白也进行了一系列的探索,包括mTOR通路上的多个关键信号分子以及自噬相关的蛋白复合体,但是其确切的作用机制尚需更加深入的研究。
| [1] | Arima S, Kohagura K, Xu H L, Sugawara A, Abe T, Satoh F, et al.Nongenomic vascular action of aldosterone in the glomerular microcirculation[J].J Am Soc Nephrol,2003,14:2255-2263. |
| [2] | Uhrenholt T R, Schjerning J, Hansen P B, Nørregaard R, Jensen B L, Sorensen G L,et al.Rapid inhibition of vasoconstriction in renal afferent arterioles by aldosterone[J].Circ Res,2003,93:1258-1266. |
| [3] | Nagai Y, Miyata K, Sun G P, Rahman M, Kimura S, Miyatake A, et al.Aldosterone stimulates collagen gene expression and synthesis via activation of ERK1/2 in rat renal fibroblasts[J].Hypertension,2005,46:1039-1045. |
| [4] | Nishiyama A, Yao L, Fan Y, Kyaw M, Kataoka N, Hashimoto K, et al.Involvement of aldosterone and mineralocorticoid receptors in rat mesangial cell proliferation and deformability[J].Hypertension,2005,45:710-716. |
| [5] | Griol-Charhbili V, Fassot C, Messaoudi S, Perret C, Agrapart V, Jaisser F.Epidermal growth factor receptor mediates the vascular dysfunction but not the remodeling induced by aldosterone/salt[J].Hypertension,2011,57:238-244. |
| [6] | Huang S, Zhang A, Ding G, Chen R.Aldosterone-induced mesangial cell proliferation is mediated by EGF receptor transactivation[J].Am J Physiol Renal Physiol,2009,296:F1323-F1333. |
| [7] | Choi A M, Ryter S W, Levine B.Autophagy in human health and disease[J].N Engl J Med, 2013,368:651-662. |
| [8] | Ravikumar B, Sarkar S, Davies J E, Futter M, Garcia-Arencibia M, Green-Thompson Z W.Regulation of mammalian autophagy in physiology and pathophysiology[J].Physiol Rev, 2010,90:1383-1435. |
| [9] | Mizushima N, Levine B, Cuervo A M, Klionsky D J.Autophagy fights disease through cellular self-digestion[J].Nature, 2008,451:1069-1075. |
| [10] | Wang Z, Choi M E.Autophagy in kidney health and disease[J].Antioxid Redox Signal,2014,20:519-537. |
| [11] | Kim S I, Na H J, Ding Y, Wang Z, Lee S J, Choi M E.Autophagy promotes intracellular degradation of type Ⅰ collagen induced by transforming growth factor (TGF)-β1[J].J Biol Chem, 2012,287:11677-11688. |
| [12] | Osman B, Doller A, Akool el-S, Holdener M, Hintermann E, Pfeilschifter J,et al.Rapamycin induces the TGFbeta1/Smad signaling cascade in renal mesangial cells upstream of mTOR[J].Cell Signal,2009,21:1806-1817. |
| [13] | Ponda M P, Hostetter T H.Aldosterone antagonism in chronic kidney disease[J].Clin J Am Soc Nephrol,2006,1:668-677. |
| [14] | Bomback A S, Rekhtman Y, Klemmer P J, Canetta P A, Radhakrishnan J, Appel G B.Aldosterone breakthrough during aliskiren, valsartan, and combination (aliskiren + valsartan) therapy[J].J Am Soc Hypertens,2012,6:338-345. |
| [15] | Nakagawa T.Diabetic nephropathy: aldosterone breakthrough in patients on an ACEI[J].Nat Rev Nephrol,2010,6:194-196. |
 2015, Vol. 36
2015, Vol. 36


