胆道系统肿瘤简称胆系肿瘤,是起源于胆囊和胆管上皮的恶性肿瘤,包括肝内胆管癌、肝外胆管癌、胆囊癌以及壶腹癌[1]。手术切除仍是目前最主要的治疗方法,但手术切除难度较大,且术后复发、转移概率高,对放疗不敏感,预后较差[2, 3]。因此,探讨新的有效的胆系肿瘤治疗方法显得十分必要。肿瘤免疫治疗近年来受到了广泛研究和关注,其中树突状细胞(dendritic cells,DC)是目前所知在体内功能最强的抗原递呈细胞,能够诱导机体产生特异性抗肿瘤免疫反应; 细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK细胞)是由IFN-γ、IL-2及CD3单抗诱导的一种广谱抗肿瘤免疫细胞,二者联合,能够更加有效地发挥抗肿瘤作用,是目前过继细胞免疫治疗的首选方法[4]。本研究采用自体DC疫苗联合CIK细胞治疗胆系肿瘤患者,初步观察其临床疗效,探讨二者联合治疗胆系肿瘤的可行性。
1 资料和方法 1.1 研究对象2012年1月至2014年10月第二军医大学东方肝胆外科医院生物治疗科收治的85例符合入选标准的胆系肿瘤患者,其中男46例,女39例,年龄20~75岁,平均(56.0±10.5)岁。患者中肝内胆管癌41例,肝门部胆管癌12例,肝外胆管癌7例,胆囊癌23例,壶腹癌2例;45例经病理证实,40例经临床资料及影像学诊断。41例为初治的局部晚期患者,32例为术后复发或转移患者,12例为术后辅助治疗。ECOG评分0分8例,1分53例,2分23例,3分1例;根据UICC/AJCC第7版TNM分期:Ⅳ期62例,Ⅲ期17例,Ⅱ期6例。
入选标准:(1)年龄≥18岁,且≤75岁;(2)预期寿命至少为6个月;(3)ECOG评分0~3;(4)主要实验室指标:白细胞≥3.0×109/L、血小板≥60×109/L、血红蛋白≥85 g/L,总胆红素正常范围或≤1.5倍正常值上限,转氨酶正常范围或≤5倍正常值上限,血清肌酐正常范围或≤1.5倍正常值上限。本研究经第二军医大学东方肝胆外科医院伦理委员会批准,所有患者或授权家属均签署DC-CIK治疗知情同意书。
1.2 DC-CIK细胞的制备及治疗方法 1.2.1 外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的采集治疗周期当天用FRESENIUS COM.TEC血细胞分离机(FRESENIUS KABI公司)进行PBMC采集,采用auto MNC程序,P1YA耗材,采集数量约为2×108/L。
1.2.2 DC-CIK的分离及培养采集的PBMC用不含血清的AIM-Ⅴ培养液(Gibco)洗涤2次后,稀释至4×106/L。将细胞转移至培养袋中培养2 h,收集非贴壁细胞,用于培养CIK细胞,贴壁细胞用于制备DC细胞,向其中加入含有GM-CSF(1 000 ng/mL)、IL-4(1 000 U/mL)和FLT-3(50 ng/mL)的培养液,每2 d更换1/2培养液,补充细胞因子,第6天用包含多种肿瘤抗原(TAA)的腺病毒(血清35型)进行转染,收集DC细胞,培养24 h后,向其中加入TNF-α(100 ng/mL)和CD40L(50 ng/mL),然后继续培养2 d。非贴壁细胞收集后将密度调整至2×109/mL,然后放入37℃、5%CO2孵箱中,加入IFN-γ(1 000 U/mL)培养,每天更换1/2培养液,加入CD3多克隆抗体(50 ng/mL)和IL-2(1 000 U/mL)。第9天将经过多抗原刺激的DC加入CIK培养液中,在上述条件下共同培养2 d。经细菌、真菌及内毒素检测阴性后分别于第11、15天收集悬浮的、经表型鉴定的成熟DC,溶于1 mL生理盐水中,皮内注射于腹股沟淋巴结;分别于第11、13、15天收集CIK细胞,细胞总数>2×1010/L,离心、洗涤后,溶于含0.25%人血白蛋白生理盐水溶液300 mL中,静脉滴注,30 min回输入患者体内。所有细胞因子均购自Novoprotein公司(上海),所有细胞培养过程均在GMP标准车间内完成。
1.3 观察指标及疗效评价观察指标包括生活质量、疗效评价、免疫功能、不良反应及生存时间。生活质量评价:对患者临床症状进行问卷调查,然后进行统计和比较。疗效评估:根据WHO制定的实体瘤疗效评估标准进行评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)。免疫功能的评价:采用流式细胞仪检测患者外周血中CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+、CD3+CD56+及调节性T细胞的变化。生存时间从第1次接受细胞治疗开始计算,每30 d 1个疗程,2个疗程后复查增强CT进行疗效评估,随访时间至2014年12月。
1.4 统计学处理采用SPSS 17.0统计软件,计量资料以 x±s 表示,不同时间点的比较采用重复测量方差分析,生存分析采用Kaplan-Meier生存曲线分析,计算中位生存时间。检验水准(α)为0.05。
2 结 果 2.1 临床症状改善情况
治疗前及治疗后2周分别对患者临床症状进行问卷调查、统计和比较,结果(表 1)表明:与治疗前相比,DC-CIK治疗后患者临床症状有明显改善,差异有统计学意义(P<0.05)。
|
|
表 1 胆系肿瘤患者免疫治疗后临床症状改善情况 |
大多数患者治疗后为SD(63.5%,54/85)及PR (16.5%,14/85),个别患者甚至达到CR(2.3%,2/85),但也有部分患者为PD(17.6%,15/85)。其中1例68岁的女性患者,诊断为肝内胆管癌伴肝门部等多发淋巴结转移,治疗后不但达到了PR,且治疗结束后1年病灶仍保持稳定(图 1)。

|
图 1 1例患者免疫治疗前后影像学资料对比 A:免疫治疗前;B:免疫治疗后即刻;C:免疫治疗后6个月;D:免疫治疗后1年 |
结果(表 2)表明:DC-CIK治疗后,淋巴细胞亚群中CD3+、CD3+CD4+、CD3+CD8+、CD3+CD56+及CD4+/CD8+比值均明显升高,而调节性T细胞则明显降低(P<0.05)。
|
|
表 2 DC-CIK治疗后外周血淋巴细胞亚群的变化 |
不良反应一般发生于回输后1~2 h,以发热为主,其中低热(≤38.0℃)22例,未经任何处理体温自行恢复正常;中度热(38.0~39.0℃)8例,其中3例未经特殊处理体温自行恢复,另外5例使用解热镇痛药后体温降至正常;高热(≥39.0℃) 5例,持续时间在2~8 h,行血常规、C反应蛋白等检测无明显异常改变,使用解热镇痛药后体温降至正常。85例患者中,有2例在细胞治疗2 h后出现血压轻度升高(≤160/110 mmHg,1 mmHg=0.133 kPa),经硝苯地平舌下含化后降至正常,无头晕、恶心、呕吐等伴随症状。有26例患者经观察后无任何不良反应。
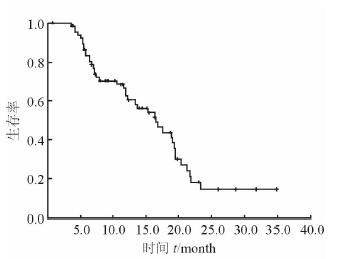
2.5 总生存期至随访结束,共有58例患者死亡,2例失访,25例存活,中位生存期为16.5个月(95% CI: 12.1~20.9个月,图 2)。
|
图 2 胆系肿瘤患者DC-CIK治疗后生存曲线 |
胆系肿瘤的发病原因尚不明确,可能与胆道结石有一定关系[5],发病率逐年增长,目前暂无有效的治疗方法。自Valle等[3]报道吉西他滨联合顺铂一线化疗取得较好的结果后,该方案已作为一线治疗被广泛应用,但多数晚期患者不能耐受,同时化疗有可能打破肿瘤与机体间的动态免疫平衡,使肿瘤细胞进一步增殖及播散[6]。随着分子生物学和免疫学的快速发展,肿瘤生物治疗近年来日益受到重视,已成为与手术、放疗及化疗并列的肿瘤第四大治疗模式[6]。其中过继性细胞免疫治疗以其突出的临床安全性以及能与手术、放疗和化疗有效地结合,显示出良好的临床应用前景[7]。
DC是目前发现的最有效的抗原递呈细胞,它可以激发T细胞应答,参与主动免疫与被动免疫反应,有效抵制肿瘤细胞的免疫逃逸机制[8]。CIK是一群经细胞因子激活和培养后获得的异质细胞,其主要效应细胞的表面标志为CD3+CD56+,对肿瘤细胞的杀伤作用具有高效性和非主要组织相容性复合体(MHC)限制性的特点,是一类杀瘤活性强和抗瘤谱广的新型抗肿瘤效应细胞。CIK扩增速度快,体外制备相对容易,有效成分相对稳定,且同时可增强肿瘤患者的免疫功能[9]。将DC与CIK共培养后产生的细胞群体比同源CIK细胞具有更强的增殖活性,且两者能相互调节而增加细胞因子释放和增强细胞毒性,提高CIK细胞的杀伤活性,同时也能提高DC的功能[10]。
本研究结果发现,DC疫苗联合自体CIK细胞回输可明显改善患者生活质量,包括减轻癌痛、乏力、纳差、恶心、呕吐等症状。同时,可延缓肿瘤进展,减慢肿瘤生长速度,即使在停止细胞免疫治疗后,仍可获得持续的作用。本研究中CR的例数不多,考虑可能与入组患者临床分期绝大多数较晚、肿瘤负荷过大有关,但PR、SD例数较多,且中位生存时间为16.5个月,较以往研究[3]明显延长。研究结果提示,免疫细胞治疗对绝大多数患者可起到延缓及稳定肿瘤生长、延长生存期的作用。本研究中经过治疗的患者T细胞亚群中的效应细胞比例及CD4+/CD8+比值均较治疗前明显上升,差异有统计学意义(P<0.05)。结果说明细胞治疗可提高患者免疫功能,同时Treg比例较治疗前降低(P<0.05),而Treg细胞介导的是抗肿瘤免疫耐受,促进肿瘤生长,Treg的降低提示对肿瘤的预后有明显改善。细胞治疗的不良反应主要为低热,且症状轻微,大多可自行缓解,说明细胞治疗安全可靠。
综上所述,DC疫苗联合CIK细胞回输在晚期胆系肿瘤的治疗中有很大的潜力,是一种疗效满意、临床安全性好、可接受性强的治疗方法,但仍需大样本的随机对照试验来进一步观察其远期疗效。
| [1] | Walter T, Horgan A M, McNamara M, McKeever L, Min T, Hedley D, et al. Feasibility and benefits of second-line chemotherapy in advanced biliary tract cancer: a large retrospective study[J].Eur J Cancer,2013,49:329-335. |
| [2] | Hezel A F, Zhu A X.Systemic therapy for biliary tract cancers[J].Oncologist,2008,13:415-423. |
| [3] | Valle J, Wasan H, Palmer D H, Cunningham D, Anthoney A, Maraveyas A, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer[J].N Engl J Med,2010,362:1273-1281. |
| [4] | Tan G, Zhang X, Feng H, Luo H, Wang Z. The therapeutic effect of cytokine-induced killer cells on pancreatic cancer enhanced by dendritic cells pulsed with K-ras mutant peptide[J].Clin Dev Immunol,2011,2011:649359. |
| [5] | Patel T. Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States[J]. Hepatology,2001, 33:1353-1357. |
| [6] | 汤钊猷.现代肿瘤学[M].上海:复旦大学出版社,2011:620-640. |
| [7] | Hui D, Qiang L, Jian W, Ti Z, Da-Lu K. A randomized, controlled trial of postoperative adjuvant cytokine-induced killer cells immunotherapy after radical resection of hepatocellular carcinoma[J].Dig Liver Dis,2009,41:36-41. |
| [8] | Zhan H L, Gao X, Pu X Y, Li W, Li Z J, Zhou X F, et al. A randomized controlled trial of postoperative tumor lysate-pulsed dendritic cells and cytokine-induced killer cells immunotherapy in patients with localized and locally advanced renal cell carcinoma [J].Chin Med J (Engl), 2012,125:3771-3777. |
| [9] | 要跟东,霍红旗,李 鹏,刘爱民.健康人和肝癌患者CIK体外增殖能力及对原代肝癌细胞抗肿瘤作用的比较研究[J].国际肿瘤学杂志,2011,38:555-558. |
| [10] | Wang Q J, Wang H, Pan K, Li Y Q, Huang L X, Chen S P, et al. Comparative study on anti-tumor immune response of autologous cytokine-induced killer (CIK) cells, dendritic cells-CIK (DC-CIK), and semi-allogeneic DC-CIK[J].Chin J Cancer, 2010, 29:641-648. |
 2015, Vol. 36
2015, Vol. 36


