2. 济南军区青岛第一疗养院, 青岛 266071
2. The 1st Sanatorium of Qingdao, PLA Jinan Military Area Command, Qingdao 266071, Shandong, China
脑梗死是威胁我国乃至世界居民生命健康的最主要疾病之一。脑缺血再灌注损伤是大多数缺血性脑血管病的主要病理生理机制,其中炎症反应[1]和细胞凋亡[2]是主要环节。临床上主要通过早期溶栓和脑神经保护等方法治疗脑梗死,但受到溶栓时间窗等多方面因素影响,大部分患者在治疗后仍遗留有瘫痪、失语等严重后遗症,尚缺乏有效的根治药物及方法。
间充质干细胞(mesenchymal stem cells,MSCs)是一种来源于中胚层的多能干细胞,在机体损伤修复过程中可迁移到受损部位,聚集增殖,并依据不同的损伤信号向不同途径分化,直接或间接影响一系列相关因子分泌,参与组织修复[3]。已有研究证实MSCs能抑制缺血再灌注损伤所产生的级联炎症反应及凋亡损伤的发生,具有保护神经功能的作用[4, 5],但较少涉及MSCs对炎症诱导凋亡通路作用的研究。相较于其他来源干细胞,胎盘间充质干细胞具有来源方便,易于分离、培养、扩增和纯化,干细胞特性强等特点,是临床应用干细胞治疗多种疾病的理想细胞[6, 7, 8]。但传统方法培养获得的MSCs受细胞体积及迁徙力等因素限制,疗效不确定,亟待探索一种更理想的培养方法以提高MSCs临床治疗疗效。
本研究采用三维(3-D)球体MSCs移植干预脑缺血再灌注损伤大鼠模型,并观察其对大鼠脑缺血再灌注损伤后脑组织肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及凋亡相关蛋白Caspase-3、Caspase-8表达的影响,为后续研究奠定基础。
1 材料和方法 1.1 主要药品及试剂人胎盘来源3-D球体MSCs[9, 10](DiL标记,清华大学深圳研究生院);TNF-α ELISA检测试剂盒(美国Uscn Life Science Inc.);TNF-α PCR引物(南京金斯瑞生物科技有限公司);Caspase-3、Caspase-8 兔抗多克隆抗体(Chemicon公司),生物素化羊抗兔IgG(武汉博士德公司)。
1.2 仪器设备Centrifuge 5804R型冷冻离心机(德国艾本德生命科学公司);RT-6100型酶标分析仪(深圳雷杜Rayto仪器有限公司);LeicaCM1860/1860UV冰冻组织切片机(德国Leica公司);PCR仪(美国Bio-Rad T100 Therma Cycler);Quantum ST5凝胶成像系统(法国Vilber)。
1.3 动物分组及模型建立108只健康雄性Wistar大鼠,体质量(300±50) g。随机分为假手术组(Sham组)、大脑中动脉缺血(MCAO)模型溶剂对照组(溶剂对照组)及MCAO模型MSCs治疗组(MSCs组),各组再随机分为第1天、第3天、第7天3个亚组,各亚组含大鼠12只。大鼠MCAO模型的制备参考Longa等[11]的线栓法。缺血后2 h给予再灌注处理,溶剂对照组和MSCs组分别于造模成功后24 h,采用腹腔注射同等体积细胞培养液和MSCs(细胞含量5×106个),假手术组除不插线栓外,其余操作同溶剂对照组和MSCs组。
1.4 检测指标 1.4.1 MSCs在脑组织中的分布各组大鼠分别在移植治疗后的第1、3、7天,腹腔注射10%水合氯醛溶液麻醉(0.3 mL/100 g体质量),9%NaCl溶液灌注取脑,4%多聚甲醛固定,梯度蔗糖脱水,自前囟后4.3 mm处向后切取海马区脑组织制作冰冻切片(厚度25 μm),晾干。通过荧光显微镜观察DiL标记的MSCs在脑组织中的分布。
1.4.2 神经功能评分每组大鼠分别于再灌注清醒时及移植后1、3、7 d观察大鼠神经功能状态,进行单盲法Longa 评分[11]。0分:无明显神经功能缺失;1分:右前肢伸展不良;2分:行走时向缺血侧旋转;3分:行走时向瘫痪侧倾倒;4分:不能自发行走,甚至昏迷。0分、4分、蛛网膜下隙出血或死亡大鼠剔除,符合标准的大鼠纳入实验统计。
1.4.3 TTC染色MCAO模型大鼠再灌注24 h后,断头取脑,置于-20℃冰箱冰冻20 min,取冠状面均匀切成2 mm厚脑片5~6片,浸泡在2%TTC溶液中,37℃避光孵育30 min,不时翻动脑片使液体接触均匀。正常脑组织呈玫瑰红色,而缺血区组织呈白色,将显色好的脑片浸泡在4%多聚甲醛中保存。
1.4.4 RT-PCR检测脑组织TNF-α mRNA的表达取大鼠脑组织缺血周围区100 mg,按照RNA提取试剂盒说明书(康为世纪)制备总RNA,-80℃冻存。反转录反应按照试剂盒说明书操作,总反应体系20 μL,反应条件为:42℃ 40 min,85℃ 5 min,冰上冷却终止反应。采用三步RT-PCR法测定TNF-α水平,反应条件为:95℃ 10 min预变性后,95℃ 10 s、61.3℃ 30 s、72℃ 50 s共35个循环,再于72℃延伸10 min。TNF-α引物序列:上游序列5′-TCG TAG CAA ACC ACC AAG CA-3′;下游序列5′-CCC TTG AAG AGA ACC TGG GAG TA-3′(扩增产物154 bp)。β-actin反应条件:94℃ 5 min预变性后,94℃ 40 s、55℃ 40 s、72℃ 40 s共30个循环,72℃延伸10 min。β-actin上游引物5′-GTG CCC ATC TAC GAG GGC TAT GCT-3′,下游引物5′-TAC CCA AGA AGG AAG GCT GGA AAA-3′(扩增产物104 bp)。1%琼脂糖凝胶电泳,用凝胶成像分析系统成像,ID Image Analysis Software半定量分析条带灰度值,以目的基因与β-actin灰度值的比值表示结果。
1.4.5 ELISA法检测脑组织中TNF-α蛋白表达量变化大鼠于干预处理后1、3、7 d断头取脑。按组织匀浆提取试剂盒(康为世纪)说明,取大鼠缺血区大脑100 μg于1 mL组织抽提剂中,冰上碾磨制成组织匀浆,10 000 转/min (r=9.5 cm)离心20 min,取上清-20℃待用。按照ELISA试剂盒说明测定,酶标仪测定光密度(D)值。
1.4.6 免疫组化法检测缺血再灌注侧脑组织Caspase-3及Caspase-8蛋白的表达采用SABC法,抗体效价1∶100,染色步骤按照免疫组化试剂盒说明进行。用PBS代替一抗作为对照。每只大鼠各取3张切片。取缺血侧海马区,随机采集5个不重复视野,在400倍光镜下计数阳性反应细胞数,结果取平均值。
1.5 统计学处理采用SPSS 17.0统计软件进行单因素方差分析,方差不齐时采用Dunnett T3检验,检验水准(α)为0.05。
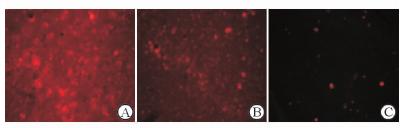
2 结 果 2.1 脑组织中MSCs的分布结果(图 1)表明:冰冻切片荧光显微镜观察DiL标记的移植MSCs细胞,可见MSCs组在脑损伤大鼠海马CA1区有红色荧光信号表达,第1天最多,第3天减少,第7天最少,表明MSCs移植入脑组织并存活良好。
|
图 1 大鼠脑组织海马区标记MSCs的分布 Fig 1 Distribution of labeled MSCs in rat hippocampus brain tissue A:1 d; B: 3 d; C: 7 d. MSCs: Mesenchymal stem cells. Original magnification:×100 |
结果(表 1)表明: 假手术组神经运动功能正常,溶剂对照组与MSCs组均出现行走侧偏、肢体伸展不良等不同程度的缺损表现。与溶剂对照组相比,MSCs组移植后1 d和3 d神经功能缺损评分差异无统计学意义,移植后7 d大鼠神经功能缺损评分降低,差异有统计学意义(P<0.05)。
|
|
表 1 各组大鼠不同时间点神经运动功能评分 Tab 1 Neuromotor function score of rats in each group at different time points |
结果(图 2)显示:大鼠左侧脑缺血区形成,正常脑组织TTC染色呈玫瑰红色,而缺血区组织呈白色。

|
图 2 TTC染色示脑组织缺血 Fig 2 TTC staining of rat brain tissues after cerebral ischemia Arrows indicate ischemia area of the brain |
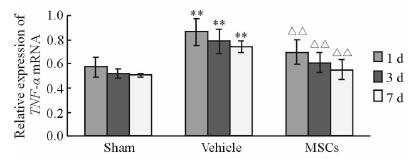
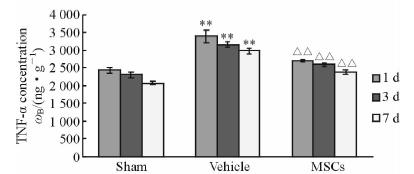
结果(图 3)表明:溶剂对照组大鼠脑组织TNF-α mRNA表达量高于假手术组(P<0.01),MSCs治疗组大鼠脑组织TNF-α mRNA表达量低于溶剂对照组,差异有统计学意义(P<0.01)。ELISA检测结果(图 4)表明:与假手术组相比,溶剂对照组大鼠脑组织TNF-α蛋白含量升高(P<0.01);与溶剂对照组相比,MSCs治疗组大鼠脑组织TNF-α蛋白表达降低(P<0.01)。
|
图 3 RT-PCR 测定各组大鼠脑组织TNF-α mRNA的表达 Fig 3 TNF-α mRNA expression in rat brain tissue by RT-PCR MSCs: Mesenchymal stem cells. **P<0.01 vs Sham group; △△P<0.01 vs Vehicle group; n=12,x±s |
|
图 4 ELISA法测定各组不同时间点TNF-α蛋白浓度 Fig 4 TNF-α protein concentration by ELISA in 3 groups at different time points MSCs: Mesenchymal stem cells. **P<0.01 vs Sham group; △△P<0.01 vs Vehicle group; n=12,x±s |
结果表明:免疫组织化学染色Caspase-3、Caspase-8阳性细胞胞质着色,呈棕黄色或棕褐色,部分核内可见(图 5)。假手术组各时间点大鼠脑组织中 偶见Caspase-3 和Caspase-8阳性细 胞表达;溶剂对照组各时间点 Caspase-8、Caspase-3 阳性细胞表达均较假手术组增多(P<0.01),溶剂对照组Caspase-8阳性细胞表达高峰出现在移植后1 d,而Caspase-3表达高峰为移植后3 d。MSCs治疗组组各时间点Caspase-8和Caspase-3阳性细胞均较溶剂对照组减少(P<0.05,P<0.01)。具体数据见表 2。

|
图 5 大鼠脑组织海马区皮质Caspase-8(A)和Caspase-3(B)阳性表达细胞 Fig 5 Caspase-8 (A) and Caspase-3 (B) positive cells in hippocampus of rat brain MSCs: Mesenchymal stem cells. Original magnification: ×400 |
|
|
表 2 大鼠各时间点脑组织Caspase-8、Caspase-3阳性细胞数 Tab 2 Caspase-8 and Caspase-3 positive cells in rat brain tissue at each time point |
MSCs可作为理想细胞应用于临床治疗脑缺血损伤并且在神经功能恢复方面已取得一定疗效[12]。本研究结果显示:移植后1、3、7 d在缺血侧海马区可见存活标记3-D球体MSCs,MSCs治疗组大鼠移植后7 d神经运动功能评分较溶剂对照组降低,从行为学角度证实了球体MSCs可通过血脑屏障迁移至缺血受损区并发挥神经保护作用。但传统方法扩增培养的MSCs仍具有一定缺陷,移植后首过效应明显,易发生血管栓塞,难以达到理想的疗效。本研究所采用的MSCs是应用改良方法培养获得的3-D球体细胞,细胞体积明显小于传统培养细胞,经静脉途径移植后一般不发生微血管栓塞现象[9],并且移植后归巢效应及多潜能分化能力强,明显加强神经特异性基因(MAP-2)、胶质纤维酸性蛋白(GFAP)等神经发生基因的表达,细胞调节分泌能力增强,可上调抗炎性因子如肿瘤坏死因子诱导蛋白6(TSG-6)等,显著减小损伤后缺血面积[9, 13],具有明确的临床应用优势。
脑缺血再灌注损伤的病理生理过程复杂,存在多种因素、多环节间相互作用,炎症反应是介导脑缺血再灌注损伤的重要机制之一。TNF-α是损伤信号诱导下被激活的巨噬细胞所释放的一种前炎性因子,具有广泛的生物学功能。已有研究报道,脑缺血再灌注损伤后大脑缺血侧较健侧有明显的高水平TNF-α表达[14, 15],TNF-α的快速大量表达可以加剧血管炎症反应,促进缺血及脑水肿发生;增加缺血后兴奋性神经递质的释放,诱导细胞坏死并加重早期脑梗死[16]。上述结果提示TNF-α过度表达参与了缺血损伤过程。TNF-α在诱导细胞凋亡过程中起重要作用[17]。TNF-α可通过多条途经诱导细胞凋亡,主要包括死亡受体通路和线粒体通路[18]。Caspase-8是介导死亡受体和线粒体通路的关键性酶,其活化可引起致死性蛋白分解级联效应。而Caspase-3是最主要的凋亡效应因子,被认为是凋亡的最终执行蛋白,与缺血后神经元损伤的病理过程密切相关,是引起缺血再灌注损伤的重要因素[19],其激活与Caspase-8诱导密切相关[20]。
MSCs的抗炎机制与移植MSCs后微环境改变有关[21]。MSCs参与调控微环境[22],可直接或间接分泌多种抗炎因子如TSG-6、IL-10等[23, 24, 25],可通过抑制NF-κB 信号通路和受体等方式减少TNF-α、IL-6等促炎因子表达[24]。本研究结果也证实再灌注损伤后,溶剂对照组移植治疗后1、3、7 d脑组织中TNF-α含量较假手术组升高,第1天表达最高,随时间延长逐渐下降。免疫组化结果显示溶剂对照组海马区皮质Caspase-8、Caspase-3阳性细胞数各时间点较假手术组增多,其中Caspase-8阳性细胞表达与TNF-α表达规律相近。而Caspase-3阳性细胞表达于第3天最高,其原因不排除与Caspase-9的延迟性表达有关。移植3-D球体MSCs后能显著降低缺血大鼠脑组织炎性因子TNF-α和凋亡效应因子Caspase-8和Caspase-3的表达,证实MSCs具有抗炎抗凋亡作用,同时也说明炎性因子TNF-α与凋亡存在级联相关性,但不能排除其他抗凋亡机制。确切的抗炎及抗凋亡机制仍需进一步实验研究证实。
综上所述,移植3-D球体MSCs能明显改善脑缺血大鼠神经功能,对促炎性因子TNF-α、凋亡相关蛋白Caspase-8和Caspase-3有抑制作用。结果提示早期干预缺血后炎症因子或通路中间过程,对临床脑缺血损伤的治疗具有重要意义。
| [1] | Soltys Z, Orzylowska-Sliwinska O, Zaremba M, Orlowski D, Piechota M, Fiedorowicz A,et al. Quantitative morphological study of microglial cells in the ischemic rat brain using principal component analysis[J].J Neurosci Methods,2005,146:50-60. |
| [2] | Friedlander R M.Apoptosis and caspases in neurodegenerative diseases[J].N Engl J Med,2003,348:1365-1375. |
| [3] | Li Y, Chen J, Chen X G, Wang L, Gautam S C, Xu Y X, et al. Human marrow stromal cell therapy for stroke in rat: neurotrophins and functional recovery[J].Neurology, 2002,59:514-523. |
| [4] | Gutiérrez-Fernández M, Rodríguez-Frutos B, Alvarez-Grech J, Vallejo-Cremades M T, Expósito-Alcaide M, Merino J, et al. Functional recovery after hematic administration of allogenic mesenchymal stem cells in acute ischemic stroke in rats[J]. Neuroscience,2011,175:394-405. |
| [5] | Scheibe F, Ladhoff J, Huck J, Grohmann M, Blazej K, Oersal A, et al. Immune effects of mesenchymal stromal cells in experimental stroke[J].J Cereb Blood Flow Metab,2012,32:1578-1588. |
| [6] | Kim S J, Moon G J, Cho Y H, Kang H Y, Hyung N K, Kim D, et al. Circulating mesenchymal stem cells microparticles in patients with cerebrovascular disease[J].PLoS One,2012,7:e37036. |
| [7] | Zhao W, Li J J, Cao D Y, Li X, Zhang L Y, He Y, et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis[J].World J Gastroenterol,2012,18:1048-1058. |
| [8] | Hou H Y, Liang H L, Wang Y S, Zhang Z X, Wang B R, Shi Y Y, et al. A therapeutic strategy for choroidal neovascularization based on recruitment of mesenchymal stem cells to the sites of lesions[J].Mol Ther,2010,18:1837-1845. |
| [9] | Guo L, Ge J, Zhou Y, Wang S, Zhao R C, Wu Y. Three-dimensional spheroid-cultured mesenchymal stem cells devoid of embolism attenuate brain stroke injury after intra-arterial injection[J].Stem Cells Dev,2014,23:978-989. |
| [10] | Li Z, Liu C, Xie Z, Song P, Zhao R C, Guo L, et al. Epigenetic dysregulation in mesenchymal stem cell aging and spontaneous differentiation[J].PLoS One,2011,6:e20526. |
| [11] | Longa E Z, Weinstein P R, Carlson S, Cummins R.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91. |
| [12] | Shen L H, Li Y, Chen J, Zacharek A, Gao Q, Kapke A, et al. Therapeutic benefit of bone marrow stromal cells administered 1 month after stroke[J].J Cereb Blood Flow Metab, 2007,27:6-13. |
| [13] | Bartosh T J, Ylöstalo J H, Mohammadipoor A, Bazhanov N, Coble K, Claypool K, et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties[J].Proc Natl Acad Sci U S A,2010,107:13724-13729. |
| [14] | Berti R, Williams A J, Moffett J R, Hale S L, Velarde L C, Elliott P J, et al. Quantitative real-time RT-PCR analysis of inflammatory gene expression associated with ischemia-reperfusion brain injury[J].J Cereb Blood Flow Metab, 2002,22:1068-1079. |
| [15] | Liu N, Chen R, Du H, Wang J, Zhang Y, Wen J. Expression of IL-10 and TNF-alpha in rats with cerebral infarction after transplantation with mesenchymal stem cells[J].Cell Mol Immunol,2009,6:207-213. |
| [16] | Khan M, Sekhon B, Jatana M, Giri S, Gilg A G, Sekhon C, et al. Administration of N-acetylcysteine after focal cerebral ischemia protects brain and reduces inflammation in a rat model of experimental stroke[J].J Neurosci Res,2004,76:519-527. |
| [17] | Song Z, Zhou Z, Uriarte S, Wang L, Kang Y J, Chen T, et al. S-adenosylhomocysteine sensitizes to TNF-alpha hepatotoxicity in mice and liver cells: a possible etiological factor in alcoholic liver disease[J].Hepatology, 2004, 40:989-997. |
| [18] | 古翠萍,张沂平.TNF-α抗肿瘤作用机制新进展[J].中国肿瘤,2007,16:102-105. |
| [19] | Solaroglu I, Tsubokawa T, Cahill J, Zhang J H. Anti-apoptotic effect of granulocyte-colony stimulating factor after focal cerebral ischemia in the rat[J].Neuroscience,2006,143:965-974. |
| [20] | Alikhani M, Alikhani Z, Raptis M, Graves D T. TNF-alpha in vivo stimulates apoptosis in fibroblasts through caspase-8 activation and modulates the expression of pro-apoptotic genes[J].J Cell Physiol,2004,201:341-348. |
| [21] | Scuteri A, Miloso M, Foudah D, Orciani M, Cavaletti G, Tredici G.Mesenchymal stem cells neuronal differentiation ability: a real perspective for nervous system repair[J].Curr Stem Cell Res Ther,2011,6:82-92. |
| [22] | 王巧玲, 王 越,冀凯宏,刘厚奇.间充质干细胞中相关的miRNA研究进展[J].解剖学杂志,2015,38:354-357. |
| [23] | Liu L, Yu Y, Hou Y, Chai J, Duan H, Chu W, et al. Human umbilical cord mesenchymal stem cells transplantation promotes cutaneous wound healing of severe burned rats[J].PLoS One,2014,9:e88348. |
| [24] | Shi Y, Su J, Roberts A I, Shou P, Rabson A B, Ren G. How mesenchymal stem cells interact with tissue immune responses[J].Trends Immunol,2012,33:136-143. |
| [25] | Prockop D J, Oh J Y. Mesenchymal stem/stromal cells (MSCs): role as guardians of inflammation[J].Mol Ther,2012,20:14-20. |
 2015, Vol. 36
2015, Vol. 36


