2. 宜春学院化学与生物工程学院, 宜春 336000
2. Bioengineering Research Institute of Yichun University, Yichun 336000, Jiangxi, China
金龙蛇口服液为第二军医大学长征医院院内制剂,是由天南星(制)、凌霄花、枳实(炒)、茯苓、天龙、鸡内金(炒)、地龙、全蝎、蜈蚣、沉香、蛇莓、甘草(炙)和五倍子等13味药材加工而制成的复方制剂,主要用于痰浊积聚、瘀毒内阻、热度内温而致的胃癌、肝癌、肠癌、食管癌等的治疗。现有质量标准仅为方剂中天南星、凌霄花和枳实对照药材的薄层色谱鉴别方法,缺少有效成分的质量控制指标[1, 2, 3, 4]。研究表明柚皮苷、橙皮苷和新橙皮苷是枳实的主要活性成分,具有破气消积、化痰散痞的作用,在一定程度上抑制多种肿瘤细胞的增殖[5, 6, 7];凌霄花中的麦角甾苷具有调节免疫功能,可增强患者抵抗疾病的能力[8];方剂佐以甘草调和诸药,甘草苷能减轻全方的毒副作用[9, 10]。文献已报道分别对单味药材枳实的柚皮苷、橙皮苷、新橙皮苷[10, 11, 12],凌霄花的麦角甾苷[13]和甘草的甘草苷[14]等进行单独的含量测定。目前,尚未有报道研究金龙蛇口服液中这5种成分的含量测定,而单独测定某一味药材中的成分作为质量标准,则太过于单一,不能体现复方制剂检测的特点。为了综合反映金龙蛇口服液的内在质量,本实验建立起同时测定柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷等5种有效成分的HPLC法。
1 仪器和试药 1.1 仪器Agilent 1200系列高效液相色谱仪器(美国Agilent公司),包括四元泵系统、自动进样器、柱温箱、可变波长检测器(VWD);Sartorius电光分析天平[赛多利斯科学仪器(北京)有限公司];SK200H超声波清洗器(上海科导超声仪器有限公司);HYQ-2121A涡旋混匀器(Silent Shake);Eppendorf离心机(德国艾本德股份公司)。
1.2 试药金龙蛇口服液(第二军医大学长征医院,规格10 mL/支,生产批号分别为130828、130912、141104);甲醇和乙腈为色谱纯[赛默飞世尔科技(中国)有限公司],娃哈哈纯净水(杭州娃哈哈集团有限公司),甲酸[Aladdin-阿拉丁试剂(上海)有限公司];橙皮苷和新橙皮苷对照品(纯度>98.0%)购自大连美仑生物有限公司,麦角甾苷(批号:111530-201309)、甘草苷(批号:111610-201106)和柚皮苷(批号:110722-201312)对照品购自中国食品药品检定研究院。
2 方法和结果 2.1 色谱条件色谱柱:Sun FireTM C18柱(4.6 mm×250 mm,5 μm,Waters);流动相:以0.2%甲酸(FA)为A相,乙腈为B相,梯度洗脱(0~10 min,10%~19% B;10~32 min,19% B);流速1.0 mL/min;柱温40℃;检测波长285 nm;进样量10 μL。进样前以流动相梯度初始条件平衡6 min。
2.2 溶液的制备 2.2.1 对照品溶液分别精密称取柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷对照品12.00、12.72、10.08、12.50和12.50 mg,分别置于10 mL量瓶中,以纯甲醇溶解并定容至刻度,摇匀,即得对照品母液,置于-20℃冰箱保存。用移液管分别精密量取柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷的单一对照品母液0.50、0.50、0.50、0.48、0.48 mL置于同一10 mL量瓶中,用80%甲醇定容至刻度,摇匀,即得对照品混合储备液,置于-20℃冰箱保存。其中柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷浓度分别为60.00、63.60、50.40、60.00和60.00 μg/mL。
2.2.2 供试品溶液精密吸取供试品金龙蛇口服液1 mL,置于量瓶中,直接加入80%甲醇溶液7 mL稀释,并涡旋60 s,超声45 min,放冷,用80%甲醇溶液补足减少的质量,以4 000×g离心15 min,再经过0.45 μm微孔滤膜过滤,取续滤液,作为供试品溶液进样。
2.2.3 阴性供试品以相同处方比例,按金龙蛇口服液制备工艺制备不含枳实、凌霄花和甘草的阴性样品。
2.3 方法学考察 2.3.1 系统适应性分别对含5种标准品的混合溶液(柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷浓度分别为30.00、31.80、25.20、30.00和30.00 μg/mL,由2.2.1项下对照品混合储备液稀释而得)空白溶剂(甲醇)、供试品溶液和阴性供试品溶液,按照上述2.1项的色谱条件进样分析,结果见图 1。理论塔板数按甘草苷计算不低于43 000,按麦角甾苷计算不低于56 000,按柚皮苷计算不低于37 000,按橙皮苷计算不低于27 000,按新橙皮苷计算不低于29 000;相邻色谱峰分离度分别为2.22、1.99、5.94、4.18、6.04;对称因子分别为0.954、0.996、1.005、0.965、1.021。以上表明供试品的杂质和基质对甘草苷、麦角甾苷、柚皮苷、橙皮苷和新橙皮苷的色谱峰不构成干扰,本方法专属性良好,杂质及其基质对金龙蛇口服液的含量测定无影响,符合定量分析要求。
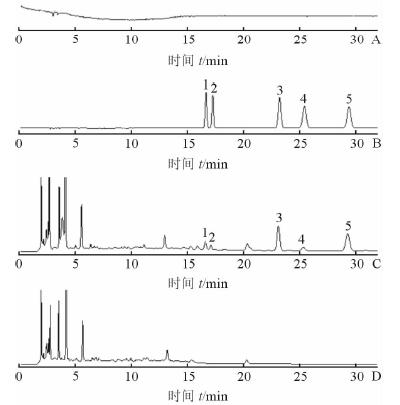
|
图 1 金龙蛇口服液空白对照(A)、对照品溶液(B)、供试品溶液(C)及阴性供试品溶液(D)的HPLC色谱图谱 1:甘草苷;2:麦角甾苷;3:柚皮苷;4:橙皮苷;5:新橙皮苷 |
精密吸取2.2.1项下对照品混合储备液0.20、0.50、1.00、2.00、3.00、4.00和6.00 mL分别置于量瓶中,再用45%甲醇溶液逐级稀释,得出7个浓度梯度的对照品混合溶液(柚皮苷:2.00、5.00、10.00、20.00、30.00、40.00和60.00 μg/mL;橙皮苷: 2.12、5.30、10.60、21.20、 31.80、42.40和63.60 μg/mL;新橙皮苷:1.68、4.20、8.40、16.80、25.20、33.60和50.40 μg/mL;麦角甾苷:2.00、5.00、10.00、20.00、30.00、40.00和60.00 μg/mL;甘草苷:2.00、5.00、10.00、20.00、30.00、40.00和60.00 μg/mL)。 按2.1项的色谱条件进样测定,以峰面积Y为纵坐标,对照品浓度(μg/mL)X为横坐标,绘制标准曲线,求得柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷的回归方程见表 1。结果表明在测定的浓度范围内呈良好的线性关系。
|
|
表 1 金龙蛇口服液中5种成分的回归方程、相关系数和线性范围 |
将柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷分别进行逐级稀释,以信噪比(S/N)为10∶1和3∶1时,分别确定其定量限和最低检测限。各自对照品的定量下限分别为0.50、0.71、0.28、0.50和0.51 μg/mL;检测限分别为0.14、0.22、0.08、0.15和0.13 μg/mL。
2.3.4 精密度考察精密吸取2.2.1项下对照品混合储备液0.50、3.00和4.00 mL,分别用45%甲醇溶液5.50、3.00和 2.00 mL进行稀释,即得5.00、30.00和40.00 μg/mL的柚皮苷、麦角甾苷和甘草苷对照品溶液,5.30、31.80和42.40 μg/mL的橙皮苷对照品溶液,4.20、25.20和33.60 μg/mL的新橙皮苷对照品溶液。按2.1项液相色谱条件,分别在同1 d内重复连续进样6次测定,以及连续3 d分别进样,计算其峰面积的相对标准偏差(RSD),进行日内精密度和日间精密度考察。结果见表 2,表明该方法精密度良好,符合含量测定要求。
|
|
表 2 金龙蛇口服液中5种成分的日内、日间精密度 |
精密吸取供试品金龙蛇口服液,照2.2.2项下的方法制备样品溶液。分别于0、3、6、9、12、24 h 测定5 种成分的峰面积,并计算其RSD,结果分别为3.41%、1.02%、0.53%、0.41%和4.47%,表明该制剂溶液在24 h内放置稳定。
2.3.6 重复性考察精密吸取批号为130912的金龙蛇口服液6份(支)各1 mL,按照2.2.2项下的方法制备样品溶液,分别测定5种成分的含量,计算其RSD。结果本批次柚皮苷、橙皮苷、新橙皮、麦角甾苷和甘草苷的平均含量分别为0.038 2、0.224 7、0.048 2、0.050 2、0.064 6 mg/mL,RSD分别为1.13%、0.70%、3.70%、4.99%和1.79%,符合含量测定要求,表明该方法重复性良好。
2.3.7 加样回收率精密吸取已知柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷含量的金龙蛇口服液6份各1 mL,每份分别精密加入适量的对照品,按照2.2.2项下的方法制备样品溶液,进样,测定分析,加样回收率(n=6)分别为95.11%、93.73%、96.39%、98.02%、95.12%,RSD分别为2.08%、4.05%、4.02%、6.01%、4.56%。结果表明,采用本方法测定金龙蛇口服液中柚皮苷、橙皮苷、新橙皮苷、麦角甾苷和甘草苷的含量,其加样回收率良好。
2.3.8 样品含量测定分别取3个批次的金龙蛇口服液样品,按2.2.2项下方法制成样品溶液,再按2.1项下色谱条件测定峰面积,根据回归方程计算金龙蛇口服液中柚皮苷、麦角甾苷、甘草苷、橙皮苷和新橙皮苷的含量。测定结果见表 3。
|
|
表 3 金龙蛇口服液样品中5种成分的含量测定结果 |
金龙蛇口服液药味含量达到13种药材,成分复杂,干扰多。本制剂为传统的水煎制剂,直接进样用HPLC检测,很难达到有效的分离和良好的峰形效果,另外在同一波长条件下能同时检测的已知成分不多。曾尝试将天南星中芹菜素成分纳入含量测定标准,但是由于芹菜素在口服液中含量太低,同等条件下的响应低于柚皮苷等5种成分;考虑采用浓缩方案(浓缩5倍、10倍和20倍)或者不同有机溶剂(正丁醇、乙酸乙酯等)萃取以及除去不必要的杂质,色谱图上柚皮苷等5个化合物分离效果不佳,且口服液中其他成分峰面积过高出现平头峰现象,造成色谱柱过载。与文献报道类似,五倍子药材中没食子酸在口服液中含量相当高[15],若纳入检测范围,则需要将口服液进行稀释,结果会造成柚皮苷等5个成分在色谱图上响应非常低,甚至检测不到。综合分析确定柚皮苷、麦角甾苷、甘草苷、橙皮苷和新橙皮苷5种有效成分在同一色谱条件下检测。
3.2 样品前处理方法优化实验发现,橙皮苷、新橙皮苷在甲醇和水中的溶解度较小,甘草苷易溶于甲醇但不溶于水,与文献[16, 17, 18, 19]报道一致。考虑到超声提取和液液萃取为实验室常用简单快捷的前处理方法,实验设计以上两种方法进行比较分析。采用95%乙醇、100%甲醇、80%甲醇、60%甲醇、40%甲醇、20%甲醇和水稀释样品后再超声不同时间(15、30、45和60 min),结果发现80%甲醇稀释样品后再超声45 min处理后进样分析,色谱图分离度良好,杂质含量较少,并且重现性较好。采用乙酸乙酯、氯仿、二氯甲烷和正丁醇萃取口服液,再将萃取液用80%甲醇稀释进样分析,色谱图响应不如80%甲醇稀释后再超声45 min的处理效果。综合上述结果,实验最终采取样品80%甲醇稀释后再超声45 min后直接进样分析的前处理方法。该法操作简便,利于制剂的生产及快速检测,又消除了多重分析环节的误差因素。
3.3 检测波长的选择在190~400 nm内进行全波长扫描,柚皮苷、橙皮苷、新橙皮苷、甘草苷和麦角甾苷的最大吸收波长分别为280、285、285、278和334 nm。麦角甾苷在220~362 nm波段都有吸收,为了同时检测5种成分,选择波长285 nm作为检测波长。在此波长下5种成分均具有较好的色谱响应,且在样品中与相邻的色谱峰可以达到良好基线分离,符合含量检测的要求。
3.4 色谱条件优化 3.4.1 色谱柱的选择实验分别考察ZORBAX SB-C18(4.6 mm×250 mm,5 μm)、Diamonsil C18(4.6 mm×250 mm,5 μm)和SunFireTM C18(4.6 mm×250 mm,5 μm),在2.1项的色谱条件下,后两种色谱柱分离效果明显优于前者,但是Diamonsil柱所用的分离时间比SunFireTM柱要长6 min,所以选择了SunFireTM柱。
3.4.2 流动相的选择实验中考察了甲醇/乙腈-水系统的等度和梯度洗脱,发现乙腈-水系统的等度和梯度均可以有效分离待测物质,但是甘草苷的峰形拖尾,橙皮苷和新橙皮苷的峰形宽度比较宽。参照2010版《中国药典》[15]和文献[10, 11, 12, 13, 14],在流动相水相系统中添加不同浓度的磷酸、醋酸和甲酸进行pH值调节,发现加入0.2%甲酸能够使待测物质和杂峰均达到良好分离,且峰形良好。因此,最终选择乙腈-0.2%甲酸作为流动相。
复方中药制剂发挥药效作用是通过君、臣、佐、使各味药材中的多种成分共同作用、相辅相成的结果,彼此之间成分的含量以及比例不同都会影响到制剂的质量。为了能够有效、准确控制复方中药制剂质量,质量评价指标也应该是多种指标的综合。随着现代分析技术的不断发展,以及各种色谱技术的普及,单纯的薄层色谱已经不能满足中药及其制剂的质量控制需求,2010版《中国药典》中对收载的中药大部分采用其主要或有效成分作为指标成分予以检测,而多成分的含量测定有助于对中药制剂进行质量控制。本实验建立的HPLC含量测定方法操作简便、快捷,有机溶剂消耗少、灵敏度高、重现性好,能同时测定3种药材中5种成分的含量,作为现有薄层检测方法对金龙蛇口服液进行质量控制的补充技术,共同为金龙蛇口服液在制备生产的质量控制和评价提供了参考依据。
| [1] | 秦志丰,魏品康,李相勇. 金龙蛇口服液合参麦注射液对中晚期胃癌患者肿瘤标志物和免疫功能的影响[J]. 中医杂志,2001,42:605- 606. |
| [2] | 余志红,魏品康,许 玲,胡仙珍,邵志华,施 俊,等. 金龙蛇颗粒对原位移植人MKN-45胃癌组织基因表达谱的影响[J].中华中医药学刊, 2007,25:1934-1937. |
| [3] | 叶 敏,孙大志,魏品康. 消痰散结方对MKN-45人胃癌裸鼠原位移植瘤微卫星不稳定的影响[J]. 中国中医药信息杂志,2013,20:32-34. |
| [4] | 许 玲,陈亚琳,刘咏英,秦志丰,李 峻,施 俊. 金龙蛇口服液合华蟾素注射液、黄芪注射液治疗Ⅳ期胃癌的临床观察[J]. 成都中医药大学学报,2005,28:7-9. |
| [5] | Kawaguchi K, Kikuchi S, Hasegawa H, Maruyama H, Morita H, Kumazawa Y. Suppression of lipopolysaccharide-induced tumor necrosis factor-release and liver injury in mice bynaringin[J].Eur J Pharmacol, 1999, 368: 245-250. |
| [6] | Al-Ashaal H A, El-Sheltawy S T. Antioxidant capacity of hesperidin from citrus peel using electron spin resonance and cytotoxic activity against human carcinoma cell lines [J]. Pharm Biol, 2011, 49: 276-282. |
| [7] | Lee J H, Lee S H, Kim Y S, Jeong C S. Protective effects of neohesperidin and poncirin isolated from the fruits of Poncirus trifoliata on potential gastric disease [J]. Phytother Res, 2009, 23: 1748-1753. |
| [8] | 张洪泉,翁晓静,陈莉莉,李 心. 管花肉苁蓉麦角甾苷对衰老小鼠端粒酶活性和免疫功能的影响[J]. 中国药理学与毒理学杂志,2008,22:270-273. |
| [9] | 丁选胜,戴德哉. 甘草苷对CC14 肝脏毒性的保护作用[J]. 中药药理与临床,2002,18: 12-13. |
| [10] | 王其华,徐云辉,濮存海,李红琴. HPLC法测定枳术颗粒中枳实的5种黄酮类物质[J]. 药学与临床研究,2013,21:232-234. |
| [11] | 李晓婷,李 纯,龚旭昊,朱乃亮,姜艳艳,禚执琴,等. 基于有效物质基础的枳实药材的质量控制体系研究[J]. 北京中医药大学学报,2013,36:696-700. |
| [12] | 黄雪丽,陈玉宇,尧爱珉,冯 芳. HPLC法测定枳实不同炮制品中有效成分的含量[J]. 广州化工,2013,41:141-143. |
| [13] | 张 桥,沈 娟,柳于介,毕宇安,王振中,萧 伟. 高效液相色谱法测定中药凌霄花中麦角甾苷、齐墩果酸和熊果酸含量[J]. 中国中药杂志,2011,36:1043-1045. |
| [14] | 鲁瑞芹. HPLC法测定劳木布阿瓦中甘草苷含量[J]. 中国实用医药,2013,8:255-256. |
| [15] | 国家药典委员会. 中华人民共和国药典一部[S]. 北京:中国医药科技出版社,2010:62,80-81. |
| [16] | Xu F, Liu Y, Zhang Z, Song H, Cheng Y, Tian Y. Simultaneous SPE-LC determination of three flavonoid glycosides of naringin, neohesperidin and hesperidin in Da-Cheng-Qi Decoction[J]. Chromatographia, 2007, 66: 763-766. |
| [17] | Li X, Xiao H, Liang X, Shi D, Liu J. LC-MS/MS determination of naringin, hesperidin and neohesperidin in rat serum after orally administrating the decoction of Bulpleurum falcatum L. and Fractus aurantii[J]. J Pharm Biomed Anal, 2004, 34: 159-166. |
| [18] | Yan Y, Chai C Z, Wang D W, Wu J, Xiao H H, Huo L X, et al. Simultaneous determination of puerarin, daidzin, daidzein, paeoniflorin, albiflorin, liquiritin and liquiritigenin in rat plasma and its application to a pharmacokinetic study of Ge-Gen Decoction by a liquid chromatography-electrospray ionization-tandem mass spectrometry[J]. J Pharm Biomed Anal, 2014, 95:76-84. |
| [19] | Seo C S, Lee M Y, Lim H S, Kim S J, Ha H, Lee J A, et al. Determination of 5-hydroxymethyl-2-furfural, albiflorin, paeoniflorin, liquiritin, ferulic acid, nodakenin, and glycyrrhizin by HPLC-PDA, and evaluation of the cytotoxicity of Palmul-tang, a traditional Korean Herbal Medicine[J]. Arch Pharm Res, 2012, 35: 101-108. |
 2015, Vol. 36
2015, Vol. 36


