2. 广州中医药大学脾胃研究所, 广州 510405;
3. 广州市海珠区妇幼保健院中医科, 广州 510240;
4. 广东药学院附属第一医院检验科, 广州 510080
2. Pi-Wei Institute, Guangzhou University of Chinese Medicine, Guangzhou 510405, Guangdong, China;
3. Department of Traditional Chinese Medicine, Maternal and Child Health Hospital of Haizhu District, Guangzhou 510240, Guangdong, China;
4. Department of Clinical Laboratory, the First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, Guangdong, China
唾液不仅在保持口腔健康、起始淀粉的消化等方面具有重要作用,而且对临床唾液分泌功能的检测和腮腺炎、中医脾虚证等疾病的诊断具有重要的意义[1, 2]。唾液的分泌主要受交感神经和副交感神经的调控,唾液淀粉酶(salivary α-amylase,sAA)、唾液流率和唾液pH值是反映唾液分泌的常用指标。sAA是唾液蛋白的重要成分,占唾液总蛋白的40%~50%,是反映唾液蛋白分泌的主要指标,并且sAA作为一种消化酶和交感神经活跃状态的标记物已经被广泛用于营养代谢和心理生理方面的研究[3, 4, 5]。唾液流率是反映唾液总量,尤其是唾液液体部分分泌的指标,已经被用于口腔健康方面的研究[6]。唾液pH会影响唾液中蛋白酶的活性,也可一定程度地反映唾液中离子分泌的情况,因此,pH值也是唾液分泌研究的常用观测指标。唾液包括基础和刺激唾液,由于基础和应激状态下唾液分泌方式有所不同,因此两种唾液的成分也存在差异。研究显示,生理或心理压力刺激能增加sAA活性和流率[4, 7]。此外,研究发现影响唾液分泌的下丘脑-垂体-肾上腺轴(HPA)和交感神经系统(SNS)都存在明显的性别差异[8]。因此,基础和刺激唾液可能存在性别差异。目前国外大量心理压力刺激的结果显示,基础或刺激的sAA活性不存在性别差异[4, 9, 10]。然而,味觉刺激下的sAA、流率和pH的性别差异,尤其是对刺激的急性反应(刺激前后的差值或比值)的性别差异还未见报道。并且目前已报道的样本量偏小,且受试者年龄层单一,以成年人为主。为此,本研究收集了包括儿童和成年人在内的105名健康志愿者酸刺激前后的唾液标本,对其sAA活性、流率和pH值以及sAA活性和流率的相关性在不同状态下的性别差异进行了分析,以期为唾液分泌和唾液指标的研究和临床应用提供参考。
1 材料和方法 1.1 受试对象本研究由广东药学院和广州市海珠区妇幼保健院伦理委员会授权。105名健康志愿者(男52名,女53名)分别来自于广东药学院和广州市海珠区妇幼保健院,年龄范围为6~25岁,平均为(16±2)岁。受试者纳入标准:(1)无明显的疾病,尤其是口腔、唾液腺及精神性疾病;(2)1个月内没有服用任何形式的药物,尤其是可能影响唾液分泌的药物,如抗哮喘药、安眠药、镇痛药、避孕药等[11];(3)无抽烟、喝酒或喝咖啡等习惯[4];(4)所有参与者包括儿童监护人都签署知情同意书。
1.2 唾液标本的采集和处理唾液采集按照课题组之前建立的方法[12]进行,具体如下。(1)唾液采集时间为上午10:00~11:00;(2)唾液采集前禁食1 h以上(除水之外);(3)酸刺激前(unstimulated)唾液采集:静坐10 min后,通过吞咽的方法将口腔唾液排净,然后将口腔内3 min分泌的唾液自然流出到1个5 mL的EP管,记录唾液量(mL);(4)酸刺激后(stimulated) 唾液采集:用0.4 mol/L 1 cm×1 cm的柠檬酸试纸刺激舌尖1 min,将刺激后唾液自然流出到另1个5 mL的EP管,记录唾液量(mL)。酸刺激舌尖时,注意将舌尖上翘,避免影响唾液pH值。采集的唾液标本-20℃保存过夜,次日4℃解冻,11 000×g离心10 min,上清用于sAA活性测定。
1.3 sAA活性测定sAA活性测定采用IFCC(International Federation of Clinical Chemistry and Laboratory Medicine) 推荐的EPS-G7速率法[4],由广东药学院附属第一医院检验科在日立7180全自动生化分析仪上进行。简单介绍如下:唾液标本200倍稀释后,以α淀粉酶测定试剂盒(广州科方生物技术有限公司) 中的对硝基苯麦芽庚糖苷(亚乙基-G7-pNP)作为底物,葡萄糖苷酶作为指示酶进行反应。底物被sAA和糖苷酶水解后产生对硝基苯酚(pNP)。通过测定单位时间内pNP在405 nm处的光密度值的差值计算标本中sAA的活性(U/mL)。
1.4 唾液流率和pH测定根据一定时间内(酸刺激前3 min,酸刺激后1 min)分泌的唾液量(mL),计算酸刺激前后的唾液流率(flow rate,mL/min)。唾液pH值利用pH 6.0~8.0和1.0~14.0精密试纸进行测定。
1.5 统计学处理统计分析前,Kolmogorov-Smirnov检验结果显示部分sAA活性和流率不符合正态分布。因此,对sAA活性和流率进行对数转换,转换后数据都符合正态分布。酸刺激前后sAA活性和流率的比较采用配对t检验,全部参与者、男性和女性参与者之间的比较采用非配对t检验。酸刺激前后sAA活性和流率之间的相关性采用Pearson相关系数分析。检验水准(α)为0.05。统计分析和作图分别利用SPSS 19.0(IBM software,USA)和GraphPad Prism 5.0 (GraphPad Software,Inc.,USA)完成。
2 结 果 2.1 酸刺激前后sAA活性、流率和pH值的性别差异基础状态下,sAA活性(图 1A)、流率(图 1B)和pH值(图 1C)都不存在性别差异;柠檬酸刺激后,男性和女性参与者的sAA活性(P<0.01)、流率(P<0.01)和pH值(P<0.01)都增加,但是刺激后的sAA活性、流率和pH值都不存在性别差异(图 1A~1C)。此外,酸刺激前后唾液流率的差值和sAA活性的差值不存在性别差异(图 1D)。
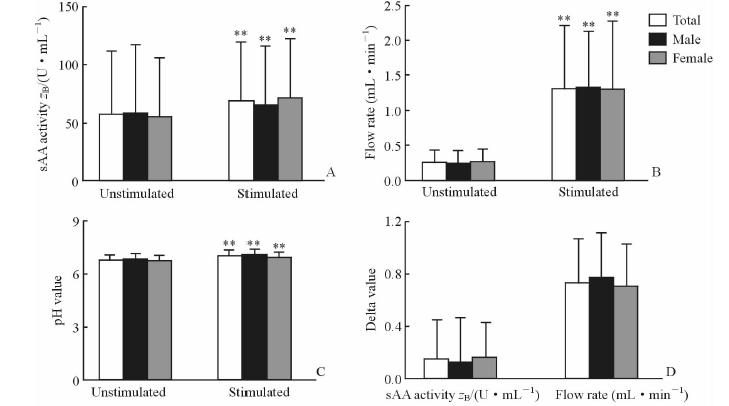
|
图 1 柠檬酸刺激前后sAA活性、流率、pH值及其差值比较 Fig 1 Comparison of sAA activity,flow rate,pH value and their delta value before and after citric acid stimulation sAA: Salivary α-amylase. A: sAA activity; B: Salivary flow rate; C: pH value; D: Delta value of sAA activity and that of flow rate. **P<0.01 vs unstimulated saliva |
结果如表 1,对于女性,酸刺激前后sAA活性与流率之间以及sAA活性差值与流率差值之间都存在正相关(P<0.05),并且相关系数没有明显的变化。对于男性,酸刺激后的sAA活性和流率之间存在正相关(P=0.007),而酸刺激前的sAA活性和流率之间以及两者酸刺激前后的差值之间都没有相关性。
|
|
表 1 酸刺激前后sAA活性与流率之间的相关性 Tab 1 Correlation between sAA activity and flow rate before and after citric acid stimulation |
sAA作为交感神经活跃状态的生物标记物,在心理压力测试的研究已经有大量的报道[4, 5],但是味觉刺激的研究较少。柠檬酸刺激对sAA活性、流率、pH值的研究在中医脾虚证的研究中虽然有一定的报道[2],但是有关sAA活性、流率和pH值以及sAA活性和流率之间相关性的性别差异尚未见报道。本研究通过性别分析,发现sAA活性、流率和pH值在酸刺激前和刺激后以及对刺激的急性反应(前后差值)都不存在性别差异,但是sAA活性和流率的相关性在不同的状态下存在一定的性别差异。
唾液的分泌主要受自主神经系统支配,其中交感神经通过去甲肾上腺素与腺泡细胞膜上的α和β受体(α-AR、β-AR)结合,适量增加唾液中液体分泌,并促进大量唾液蛋白的分泌;副交感神经通过乙酰胆碱与腺泡细胞膜上的胆碱受体M3(mAChRs)结合,引起大量电解质、水分和少量唾液蛋白的分泌。因此,唾液蛋白主要是由交感神经调控,而唾液流率主要是受到副交感神经的调控[13, 14]。此外,唾液主要由腮腺、颌下腺和舌下腺3个唾液腺分泌,但是这3个腺体对唾液成分和唾液量的贡献存在明显差异,其中腮腺分泌80%的sAA,并且在刺激状态下其分泌的唾液量占总唾液量的比例由20%增加到50%以上[4]。 因此,在各种外界刺激的情况下,机体sAA 会随腮腺分泌增强而增加[4, 12]。本研究发现,柠檬酸刺激后sAA活性和流率增加,并且唾液流率比sAA活性增加更为明显。该结果揭示,柠檬酸刺激主要是通过促进副交感神经活性来调控唾液的分泌。
人类对压力和刺激物的反应主要由HPA轴和交感神经系统调控。研究显示,HPA轴和交感神经系统存在显著的性别差异。Kirschbaum 等[15]发现男性HPA轴对心理压力的反应性比女性更强。Gustafson等[16]也发现,在等长运动中男性血浆去甲肾上腺素的含量比女性更高,提示男性对压力或运动的反应比女性更大。本研究结果显示,男性酸刺激前后的唾液流率差值与女性相比呈现增加的趋势(图 1D)。该结果提示男性对作用于副交感神经的柠檬酸刺激的反应同样比女性大。此外,sAA作为反映交感神经活性的生物标记物,已被广泛用于心理压力的研究[4, 5]。由于交感神经活性的性别差异,通常认为sAA活性也存在性别差异。然而大量的心理压力测试结果显示,测试前后的sAA活性及其对压力的反应都不存在性别差异[4, 9, 10]。本研究以柠檬酸作为味觉刺激物探讨其对唾液分泌的性别差异,结果显示酸刺激前后的sAA活性和流率以及它们对酸刺激的急性反应(前后的差值)都不存在显著的性别差异。由此可见,分别作用于副交感神经和交感神经的味觉刺激和心理压力测试虽然在获得的唾液量和唾液组成上可能存在差异,但是两者都不存在性别差异,即男性和女性在味觉和心理刺激下的唾液流率和sAA活性没有差异。
唾液流率和sAA活性分别由副交感和交感神经调控,两者的相关性分析不仅能直接反映酸刺激前后唾液流率和sAA活性的关系,而且还能一定程度地反映交感神经和副交感神经的相互作用关系。交感神经和副交感神经对唾液分泌的调控是此长彼消的协调交互影响模式。本研究结果显示,女性在酸刺激前后的sAA活性和流率之间以及sAA活性差值和流率差值之间都存在正相关性,并且相关系数相对稳定。然而男性在酸刺激前后sAA活性和流率之间的相关性变化较大,即在酸刺激前和对刺激的急性反应上(前后差值)两者都没有相关性,只在酸刺激后的唾液中两者呈正相关。该结果揭示,男性和女性基础状态的唾液分泌主要受副交感神经的调控,但男性基础状态的唾液分泌受情绪等心理因素影响较大,然而柠檬酸刺激后两者副交感神经活性都增加。Ng等[17]研究发现,静息状态下,男性交感神经活性比女性更高,并且交感神经活性与血浆去甲肾上腺素的含量呈正相关。此外,Gerlo等[18]发现,男性24 h尿液中去甲肾上腺素的排泄量比女性更高。 这些结果提示男性基础状态下交感神经的活性比女性更高。sAA作为反映交感神经活性的标记物,易受情绪等心理因素的影响[4, 5]。本研究也显示基础状态下男性sAA活性的平均值和标准差都比女性大[(57.98±59.17)U/mL vs(55.29± 50.35) U/mL]。因此,男性基础状态下唾液流率和sAA活性没有显著的相关性(P=0.085)可能与此有关。然而,柠檬酸刺激后,男性和女性副交感神经对唾液分泌的调控进一步加强,因此两者sAA活性和流率都表现为显著的正相关。同时,由于女性酸刺激前后的唾液分泌受交感神经影响较少,因此其sAA活性差值和流率差值之间也呈现正相关。相反,男性由于基础状态的唾液分泌受交感神经的影响,其sAA活性差值和流率差值之间没有相关性。
另外,柠檬酸刺激在促进唾液液体和蛋白部分分泌的同时,还会促进氯离子、钠离子、钾离子、碳酸氢根离子等分泌,这些离子不仅会改变唾液pH值,而且还会激活或抑制唾液中如sAA等蛋白酶的活性[19]。正常人唾液pH值为6.8~7.1,受刺激后唾液pH可升高2个单位。本研究发现所有健康志愿者在柠檬酸刺激后,唾液pH值都显著增加,但是酸刺激前后的唾液pH值不存在性别差异。这也进一步证实了唾液的分泌方式不存在性别差异。
综上所述,柠檬酸刺激能增加sAA活性、流率和pH值,其中以流率增加最大。然而sAA活性、流率和pH值在酸刺激前、刺激后以及对刺激的急性反应(前后差值)都没有性别差异。但是男性和女性参与者 sAA活性和流率的相关性在不同的状态下存在一定的差异。这一结果提示男性和女性在激素水平和对刺激的激素反应上可能存在一定的差异,这种差异对sAA活性和流率的相关性有一定的影响,对sAA活性、流率和pH值的影响则不大。
| [1] | 张小飘,董明驹. 血清淀粉酶同工酶在流行性腮腺炎诊断中的意义[J]. 重庆医学,2010,39:1129-1130. |
| [2] | 杨泽民,陈龙辉,林 静,张 敏,杨小蓉,陈蔚文. 柠檬酸刺激对脾虚患儿唾液淀粉酶、总蛋白、唾液流率及pH值的影响[J]. 中国中西医结合杂志,2015,35:188-192. |
| [3] | Mandel A L, Peyrot des Gachons C, Plank K L, Alarcon S, Breslin P A. Individual differences in AMY1 gene copy number, salivary α-amylase levels, and the perception of oral starch [J]. PLoS One, 2010, 5: e13352. |
| [4] | Rohleder N, Nater U M. Determinants of salivary alpha-amylase in humans and methodological considerations [J]. Psychoneuroendocrinology, 2009, 34: 469-485. |
| [5] | Schumacher S, Kirschbaum C, Fydrich T, Ströhle A. Is salivary alpha-amylase an indicator of autonomic nervous system dysregulations in mental disorders?--a review of preliminary findings and the interactions with cortisol [J]. Psychoneuroendocrinology, 2013, 38:729-743. |
| [6] | Shaila M, Pai G P, Shetty P. Salivary protein concentration, flow rate, buffer capacity and pH estimation: a comparative study among young and elderly subjects, both normal and with gingivitis and periodontitis [J]. J Indian Soc Periodontol, 2013, 17:42-46. |
| [7] | Arhakis A, Karagiannis V, Kalfas S. Salivary alpha-amylase activity and salivary flow rate in young adults [J]. Open Dent J, 2013, 7:7-15. |
| [8] | Kirschbaum C, Kudielka B M, Gaab J, Schommer N C, Hellhammer D H. Impact of gender, menstrual cycle phase, and oral contraceptives on the activity of the hypothalamus-pituitary-adrenal axis[J].Psychosom Med, 1999, 61:154-162. |
| [9] | Nater U M, Rohleder N, Schlotz W, Ehlert U, Kirschbaum C. Determinants of the diurnal course of salivary alpha-amylase [J]. Psychoneuroendocrinology, 2007, 32:392-401. |
| [10] | Kivlighan K T, Granger D A. Salivary alpha-amylase response to competition: relation to gender, previous experience, and attitudes[J]. Psychoneuroen-docrinology, 2006, 31: 703-714. |
| [11] | Strahler J, Mueller A, Rosenloecher F, Kirschbaum C, Rohleder N. Salivary alpha-amylase stress reactivity across different age groups [J]. Psychophysiology, 2010, 47: 587-595. |
| [12] | 陈龙辉,杨泽民,李茹柳,林传权,张 杰,陈蔚文. 柠檬酸滤纸面积及浓度对刺激健康人唾液分泌和唾液淀粉酶活性改变的影响[J]. 广州中医药大学学报,2013,30:186-190. |
| [13] | Proctor G B, Carpenter G H. Regulation of salivary gland function by autonomic nerves [J]. Auton Neurosci, 2007, 133:3-18. |
| [14] | Ishikawa Y, Cho G, Yuan Z, Skowronski M T, Pan Y, Ishida H. Water channels and zymogen granules in salivary glands[J]. J Pharmacol Sci, 2006, 100:495-512. |
| [15] | Kirschbaum C, Kudielka B M, Gaab J, Schommer N C, Hellhammer D H. Impact of gender, menstrual cycle phase, and oral contraceptives on the activity of the hypothalamus-pituitary-adrenal axis[J]. Psychosom Med, 1999, 61:154-162. |
| [16] | Gustafson A B, Kalkhoff R K. Influence of sex and obesity on plasma catecholamine response to isometric exercise [J]. J Clin Endocrinol Metab, 1982, 55: 703-708. |
| [17] | Ng A V, Callister R, Johnson D G, Seals D R. Age and gender influence muscle sympathetic nerve activity at rest in healthy humans [J].Hypertension,1993, 21:498-503. |
| [18] | Gerlo E A, Schoors D F, Dupont A G. Age- and sex-related differences for the urinary excretion of norepinephrine, epinephrine, and dopamine in adults [J]. Clin Chem, 1991, 37:875-878. |
| [19] | Catalán M A, Nakamoto T, Melvin J E. The salivary gland fluid secretion mechanism [J]. J Med Invest, 2009, 56 (Suppl): 192-196. |
 2015, Vol. 36
2015, Vol. 36


