原发性支气管肺癌是最常见的恶性肿瘤之一,是导致人类癌性死亡的首位疾病,其中80%~90%的患者为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。外科手术是非小细胞肺癌最有效的治疗手段,但多数患者首诊时病变已属晚期,失去根治性手术的机会。肿瘤细胞高度增殖和侵袭是肺癌患者高死亡率的主要原因,与患者的预后密切相关[2]。针对肺癌细胞的增殖和侵袭性,开发更为经济、安全有效的化疗药物或发展联合化疗,对于延长肺癌患者生存极有必要。
芹菜素(4’,5,7-三羟基黄酮,分子式C15H10O5)是一种广泛存在于蔬菜和水果植物中的食物源性黄酮类化合物。近年来国内外学者研究发现,芹菜素对多种肿瘤细胞有明显的诱导凋亡作用,包括前列腺癌、结肠癌、乳腺癌、宫颈癌等[3, 4, 5, 6]。在肺癌方面,已有研究表明芹菜素可以抑制肺癌细胞A549的增殖[7],但芹菜素对肺癌细胞迁移、侵袭方面的抑制作用及相关的机制目前尚不清楚。
本实验拟采用不同剂量的芹菜素溶液与肺癌A549细胞共培养后,测定A549细胞迁移、侵袭能力,检测细胞上清液中基质金属蛋白酶2 (matrix-metalloproteinase-2,MMP-2)、MMP-9、血管内皮生长因子(vascular endothelial growth factor,VEGF)的分泌以及MMP-2、MMP-9、VEGF蛋白的表达情况,探讨芹菜素对肺癌侵袭和转移的抑制作用及相关机制。
1 材料和方法 1.1 主要材料和试剂DMEM培养基、胎牛血清购于美国Gibco公司; 二甲亚砜 (dimethyl sulfoxide,DMSO)、细胞裂解液购于美国Sigma公司。CCK8试剂盒购自上海碧云天生物技术有限公司。MMP-2、MMP-9、VEGF抗体购自Sino Biological Inc.公司;人工重组基底膜(Matrigel)、Transwell 小室购自美国BD公司。芹菜素(质量分数≥98%,批号520-36-5)购自南京广润生物公司。279 mg 芹菜素用1 mL DMSO溶解成浓度为1 mmol/L 作为储存液,实验前用适量的培养液稀释到实验所需浓度。在所有实验组中DMSO终浓度均<0.1%(这一浓度被证实对细胞培养没有影响)。
1.2 人肺癌A549细胞系培养肺癌A549细胞购自中国科学院上海生命科学院,并保存于福建医科大学附属第二医院中心实验室。细胞培养于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养液中,在饱和湿度、37℃、5% CO2细胞培养箱内常规传代,取对数生长期细胞用于实验。
1.3 CCK8实验将对数增长的细胞接种入96孔培养板,每孔4 000个细胞。培养箱内培养24 h后,将培养基换成含有不同浓度芹菜素的培养液(0、5、10、20、40、80、160 μmol/L),每组设6个复孔,同时设6个DMSO空白孔为对照,继续培养24 h。吸除原培养液,加入比例配制的CCK8溶液,每孔100 μL,培养4 h后在酶标仪450 nm波长处测定光密度(D)值。结果取6个复孔的平均值。按照下式计算生存率:生存率=(实验孔D值-空白孔D值)/(对照孔D值-空白孔D值)。
1.4 细胞迁移实验分别取200 μL经不同浓度芹菜素培养24 h的各组细胞悬液 (细胞密度均调整为2×105/mL)加入Transwell小室上室,下室中加入600 μL含10%血清的DMEM培养液,于培养箱内继续培养24 h。培养结束后,取出小室,弃上室内培养液,4%多聚甲醛固定10 min,PBS冲洗后应用1%结晶紫染色液染色约 3 min,医用棉棒轻轻擦去小室膜上表面尚未穿过的细胞,PBS冲洗小室。倒置显微镜下观察。随机选取5个高倍镜视野,对穿过底膜的细胞进行计数。
1.5 细胞侵袭实验Matrigel胶在4℃冰箱内融化后,用无血清DMEM按1∶8比例进行稀释。取50 μL加入Transwell小室上室,轻轻晃动使其均匀铺满小室底,置入培养箱内干燥30 min;待Matrigel胶凝固后轻轻吸去析出的水分,每孔再加入50 μL无血清DMEM培养液水化。余下步骤同1.4项下细胞迁移实验。
1.6 ELISA测定上清液中MMP-2、MMP-9、VEGF的分泌量含有不同浓度芹菜素的无血清培养液处理肺癌A549细胞24 h后,收集细胞培养上清液,离心除去上清液中的细胞碎片后备用。按照ELISA试剂盒操作步骤进行实验,同时利用所提供的标准蛋白绘制标准曲线,用检测仪490 nm下记录各组读数对照标准曲线计算出MMP-2、MMP-9、VEGF相对含量。上述实验重复3次,取均数。
1.7 蛋白质印迹法检测MMP-2、MMP-9、VEGF蛋白的表达将处理后的各组细胞加入裂解液后收集,进行蛋白定量,总上样蛋白量为25 μg ,煮沸8 min使蛋白变性。按照10%分离胶和5%浓缩胶配制十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳 (sodium dodecyl sulfonate-polyacrylamide gel electrophoresis,SDS-PAGE),电泳直至溴酚蓝到达分离胶底部上方约0.5 cm;采用湿法转膜将蛋白印迹到硝酸纤维素膜上,于含10% 脱脂奶粉的封闭液中室温封闭90 min。加入一抗 MMP-2(1∶100)、MMP-9(1∶500)、VEGF(1∶500),4℃ 孵育过夜。洗膜后,加入相应的二抗,室温孵育 60 min后,ECL发光试剂对硝酸纤维素膜进行显色反应,胶片曝光,拍照。凝胶成像系统在白光下对胶片扫描后,进行光密度分析,以肌动蛋白β-actin作为内参照。实验重复3次。
1.8 统计学处理采用SPSS 16.0统计软件进行数据分析。计量资料以 x±s 表示,采用t检验(两组间比较)或方差分析(3组或3组以上比较);计数资料以绝对值表示,采用χ2检验。检验水准(α)为0.05。
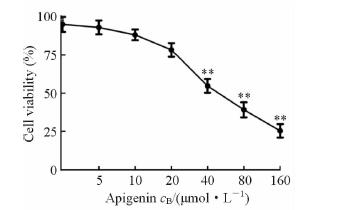
2 结 果 2.1 芹菜素抑制肺癌A549细胞的增殖实验表明,随着芹菜素浓度的增加,A549细胞的生存率呈渐进性降低,并且在芹菜素浓度为40、80、160 μmol/L时,细胞出现皱缩、气泡,呈椭圆型,增殖受到抑制(P<0.05),24 h的半抑制浓度IC50为(46.5±3.7)μmol/L(图 1)。A549细胞在0~20 μmol/L芹菜素作用24 h后活力大于75%,抑制效应不明显。为防止细胞活力过低导致实验的假阳性出现,我们选用20 μmol/L(抑制细胞增殖不明显)和40 μmol/L(显著抑制细胞增殖)作为Transwell迁移和侵袭实验的药物干预浓度。
|
图 1 不同浓度芹菜素对A549细胞的增殖抑制作用 Fig 1 Apigenin of different concentrations inhibiting proliferation of A549 cells **P<0.01 vs 0 μmol/L group |
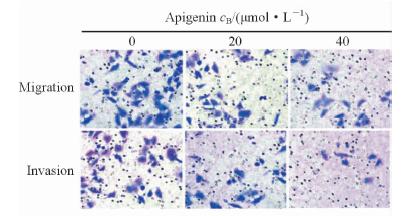
实验表明20 μmol/L和40 μmol/L芹菜素均能有效抑制A549细胞的迁移和侵袭能力,且40 μmol/L芹菜素对细胞的侵袭抑制作用更加明显(图 2)。相对于DMSO对照组,20 μmol/L 芹菜素组抑制A549细胞迁移的有效率为25.7% (36.0±3.7 vs 47.0±5.0,P<0.01),40 μmol/L组为62.5%(19.0±4.3 vs 47.0±5.0,P<0.01)。同样,浓度为20 μmol/L和40 μmol/L的芹菜素都能有效抑制A549细胞侵袭能力(24.0±3.2 vs 32.0±5.6,P<0.05; 12.0±4.0 vs 32.0±5.6,P<0.01)。
|
图 2 芹菜素抑制A549细胞迁移和侵袭 Fig 2 Apigenin inhibits A549 cell migration and invasion Original magnification:×400 |
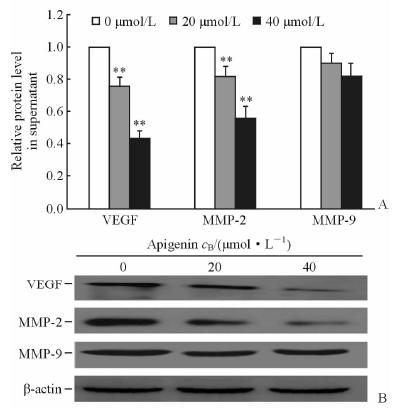
ELISA检测显示,与对照组相比,20 μmol/L、40 μmol/L芹菜素作用24 h后能降低A549细胞VEGF、MMP-2的分泌(P<0.05),而对于MMP-9分泌的影响差异没有统计学意义(图 3A)。蛋白质印迹法检测相应蛋白表达,同样提示芹菜素对A549细胞VEGF、MMP-2蛋白表达有抑制作用,特别是在40 μmol/L浓度下抑制作用更为明显(图 3B)。
|
图 3 芹菜素对A549细胞MMP-2、MMP-9、VEGF蛋白分泌(A)和表达(B)的影响 Fig 3 Effect of apigenin on protein secretion(A) and expression(B)of MMP-2,MMP-9 and VEGF in A549 cells MMP-2: Matrix-metalloproteinase-2; MMP-9: Matrix-metalloproteinase-9; VEGF: Vascular endothelial growth factor. **P<0.01 vs 0 μmol/L group. n=3,x±s |
近年来,原发性肺癌的发病率和死亡率仍位居恶性肿瘤首位,我国肺癌发病率为0.497‰,且逐年上升,年平均增长1.63%[8]。肺癌的手术切除率仅为30%左右,化疗对于肺癌患者生存和预后至关重要,但化疗药物费用贵、不良反应大,制约着临床应用,寻找廉价、高效、低毒天然植物成分已成为抗肿瘤的希望[9, 10, 11]。芹菜素作为一种天然植物中存在的黄酮类化合物,因具有抗肿瘤的作用而受到广泛关注[12]。
现有研究表明芹菜素具有抑制人肺癌A549细胞增殖、诱导其凋亡的作用,其机制可能与上调 Bax 蛋白表达和下调 Bcl-2蛋白表达有关[13],并通过半胱天冬酶和线粒体依赖通路来实现[14]。本实验显示,一定浓度的芹菜素可抑制A549细胞增殖,并呈浓度依赖性,这一结果与文献[7, 13]报道结果一致。
肺癌细胞的高度侵袭性是患者预后差、高死亡率的主要原因,有效抑制肺癌细胞侵袭性,对于控制肺癌发生、发展进程具有重要意义[15]。文献报道芹菜素对结肠癌、肝癌、胰腺癌等的体外迁移具有抑制作用[16, 17, 18]。在本研究中,利用Transwell迁移和侵袭实验表明芹菜素能有效抑制A549细胞的迁移和侵袭能力,这就为芹菜素应用于防治肺癌提供了实验依据。
肺癌的侵袭转移是一个极其复杂的多基因调控的多步骤多阶段发展过程,包括侵袭、循环扩散、远处克隆和血管生成。从目前的研究来看,细胞外基质(extracellular matrix,ECM)的降解是肿瘤侵袭关键步骤之一,其机制主要为肿瘤细胞诱导效应细胞分泌蛋白水解酶降解、破坏由细胞间基质和基底膜组成的细胞质[19, 20]。MMPs是参与这一过程中最重要的蛋白酶,其中MMP-2和MMP-9能够特异性地降解ECM的主要成分Ⅳ型胶原酶类,使癌细胞突破基质屏障,促进肿瘤侵袭转移[21]。已有研究证实,包括非小细胞肺癌在内的多种实体瘤中均存在MMP-2、MMP-9高表达,提示其与肿瘤发生及侵袭转移密切相关[22, 23, 24]。新生血管的形成也是肿瘤侵袭转移的必需条件。血管新生需多种细胞因子共同参与,其中VEGF是目前所知作用最强的促血管生成因子。本实验采用ELISA、蛋白质印迹法分析芹菜素对细胞MMP-2、MMP-9和VEGF活性和蛋白表达的改变,结果显示经芹菜素处理后A549细胞迁移和侵袭能力降低,相对应的MMP-2、VEGF蛋白表达和分泌减少。但芹菜素不能抑制MMP-9蛋白表达和分泌,其具体原因仍有待进一步研究。
总之,本研究证实了芹菜素可有效抑制肺癌A549细胞的迁移和侵袭能力,其机制可能与芹菜素降低细胞MMP-2、VEGF的蛋白表达和分泌相关。这为芹菜素在肺癌临床治疗中的应用提供了一定的实验依据,提示芹菜素将在今后的肺癌临床综合治疗体系中发挥作用,有望成为高效低毒的抗肺癌新药。
| [1] | Jemal A,Siegel R,Ward E,Murray T,Xu J, Thun M J.Cancer statistics, 2007[J].CA Cancer J Clin,2007,57:43-66. |
| [2] | Dobashi K, Sugio K, Osaki T, Oka T, Yasumoto K.Micrometastatic P53 positive cells in the lymph nodes of non-small-cell lung cancer:prgnostic significance[J].J Thorac Cardiovasc Surg,1997,114:339-345. |
| [3] | Shukla S, Bhaskaran N, Babcook M A, Fu P, Maclennan G T, Gupta S.Apigenin inhibits prostate cancer progression in TRAMP mice via targeting PI3K/Akt/FoxO pathway[J]. Carcinogenesis,2013,35:42-460. |
| [4] | 孟 勇,马清涌,马 涛,江小琼,付世艳. 芹菜素对人结肠癌细胞SW480增殖抑制作用的实验研究[J].现代肿瘤医学,2008,16:701-703. |
| [5] | Mafuvadze B, Cook M, Xu Z, Besch-Williford C L, Hyder S M.Effects of dietary apigenin on tumor latency,incidence and multiplicity in a medroxyprogesterone acetate-accelerated 7,12-dimethylbenz(a) anthracene-induced breast cancer model[J].Nutr Cancer,2013,65:1184-1191. |
| [6] | 刘 杰,刘 飞,夏 红,曹建国,陈忠东.芹菜素通过组成性激活JNK敏化TRAIL诱导HeLa细胞凋亡[J].中国现代医学杂志,2011,21:3095-3100. |
| [7] | 任环宇,唐修文.芹菜素对肺癌细胞的抗增殖作用和抗肿瘤药物的增敏作用[J].浙江大学学报:医学版,2011,40:508-514. |
| [8] | 陈万青,张思维,邹小农.中国肺癌发病死亡的估计和流行趋势研究[J].中国肺癌杂志,2010,13:488-493. |
| [9] | 田云鹏,耿世佳,崔珈衔,任明姬,赵鹏伟,杨丽敏.诃子水提物对肺癌A549细胞中p53表达的影响[J].解剖学杂志,2015,38:269-271. |
| [10] | Yan K H, Lee L M, Yan S H, Huang H C, Li C C, Lin H T, et al.Tomatidine inhibits invasion of human lung adenocarcinoma cell A549 by reducing matrix metalloproteinases expression[J].Chem Biol Interact,2013,203:580-587. |
| [11] | Lee H,Kim J S,Kim E.Fucoidan from seaweed Fucus vesiculosus inhibits migration and invasion of human lung cancer cell via PI3K-Akt-mTOR pathways[J].PLoS One,2012,7:e50624. |
| [12] | 刘 斌,巴 一.芹菜素防治肿瘤及其机制研究进展[J].实用肿瘤杂志,2013,28:222-226. |
| [13] | 潘雪刁,杨周萍,周四桂,杨志英,臧林泉,王桂香.芹菜素对人肺癌A549细胞凋亡及相关蛋白Bax、Bcl-2表达的影响[J].中国医药生物技术,2013,8:259-263. |
| [14] | Lu H F, Chie Y J, Yang M S, Lee C S, Fu J J, Yang J S,et al.Apigenin induces caspase-dependent apoptosis in human lung cancer A549 cells through Bax- and Bcl-2-triggered mitochondrial pathway[J].Int J Oncol,2010,36:1477-1484. |
| [15] | Ramanujum R, Lin Y L, Liu J K, He S.Regulatory expression of MMP-8/MMP-9 and inhibition of proliferation,migration and invasion in human lung cancer A549 cells in the presence of HGF variants[J].Kaohsiung J Med Sci,2013,29:530-539. |
| [16] | 孟 勇,李 华,马清涌,林增海,吴华涛.芹菜素对人结肠癌细胞株SW480 体外侵袭能力的抑制作用[J].现代肿瘤医学,2011,19:1522-1524. |
| [17] | Kim B R,Jeon Y K,Nam M J.A mechanism of apigenin-induced apoptosis is potentially related to antiangiogenesis and anti-migration in human hepatocellular carcinoma cells[J].Food Chem Toxicol,2011,49:1626-1632. |
| [18] | Pham H, Chen M, Takahashi H, King J, Reber H A, Hines O J, et al. Apigenin inhibits NNK-induced focal adhesion kinase activation in pancreatic cancer cells[J].Pancreas,2012,41:1306-1315. |
| [19] | Weng Y, Cai M, Zhu J, Geng J, Zhu K, Jin X, et al.Matrix metalloproteinase activity in early-stage lung cancer[J].Onkologie,2013,36:256-259. |
| [20] | Husmann K, Arlt M J, Muff R, Langsam B, Bertz J, Born W, et al.Matrix metalloproteinase 1 promotes tumor formation and lung metastasis in an intratibial injection osteosarcoma mouse model[J].Biochim Biophys Acta,2013,1832:347-354. |
| [21] | Bauvois B.New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers:outside-in signaling and relationship to tumor progression[J].Biochim Biophys Acta,2012,1825:29-36. |
| [22] | Tang Z P, Cui Q Z, Dong Q Z, Xu K, Wang E H.Ataxia-telangiectasia group D complementing gene (ATDC) upregulates matrix metalloproteinase 9 (MMP-9) to promote lung cancer cell invasion by activating ERK and JNK pathways[J].Tumour Biol,2013,34:2835-2842. |
| [23] | Daniele A, Zito A F, Giannelli G, Divella R, Asselti M, Mazzocca A, et al.Expression of metalloproteinases MMP-2 and MMP-9 in sentinel lymph node and serum of patients with metastatic and non-metastatic breast cancer[J].Anticancer Res,2010,30: 3521-3527. |
| [24] | 许雪峰,林杰成.基质金属蛋白酶2 和PTEN 在贲门癌中表达及临床意义[J].疑难病杂志,2009,8:289. |
 2015, Vol. 36
2015, Vol. 36


