高血压病是目前全世界范围内发病率最高的慢性疾病之一,据统计,有超过25%的成年人罹患高血压病[1]。尽管大多数高血压患者对药物治疗相对比较敏感,但仍有一些患者即使用3种或3种以上的药物(包含1种利尿剂),且药物剂量均使用至最大值,血压仍无法达标(140/90 mmHg,1 mmHg=0.133 kPa)[2]。这类患者被称为难治性高血压患者,肾动脉交感神经的激活是难治性高血压发生的主要病理特征。经皮肾动脉交感神经消融术(renal sympathetic denervation,RDN)是近年来兴起的一项新型介入治疗手术,临床试验证实RDN术可安全有效地应用于难治性高血压的临床治疗[3]。欧洲高血压协会于2013年将该技术纳入难治性高血压的临床治疗指南中,并将其列为Ⅱb类推荐,认为该手术可成为药物治疗以外的一项有效的补充治疗手段[4]。
肾交感神经分为传出神经和传入神经。有研究表明,使用不同频率刺激激活肾动脉交感神经会产生不同的结果,其中使用较高频率刺激会导致肾动脉血管的收缩[5, 6, 7]。这一现象表明,肾交感神经的激活可一定程度上收缩肾动脉,减少肾动脉血流量。目前,在RDN治疗难治性高血压的患者中,尚缺乏该手术对肾动脉直径影响的研究,而RDN术后肾动脉直径的改变与患者疗效之间的关系也未见报道。本研究使用定量冠状动脉造影技术(QCA)测量患者术前、术后即刻的肾动脉直径,随访患者半年的血压情况,并比较RDN术后即刻肾动脉直径的改变与消融参数及血压变化之间的关系。
1 对象和方法 1.1 研究对象选择上海市普陀区中心医院心内科2013年2月至10月收治的难治性高血压患者共12例。入选标准:年龄18~85岁,收缩压>160 mmHg(合并糖尿病的患者,收缩压>150 mmHg),服用3种或3种以上降压药物(包含1种利尿剂);排除标准:肾小球滤过率(estimated glomerular filtration rate,eGFR,采用MDRD公式计算)低于45 mL/(min·1.73 m2),瓣膜性心脏病患者,怀孕或准备怀孕的患者。所有患者入院后采取5点测血压法(每天测5次血压,时间分别是6:00、10:00、14:00、18:00、22:00)。
1.2 治疗方法所有患者于基本检查完善后行RDN术。患者术前一次嚼服肠溶阿司匹林300 mg,术中静脉注射普通肝素6 000 U。行右侧腹股沟处消毒,于股动脉处进行穿刺,置入7F血管鞘。先以6F JR导管进行左、右肾动脉造影,明确肾动脉走行、数量、有无狭窄。造影结束后,沿鞘管送入7F导引导管(7F RDC mach1,55 cm,波士顿科学公司),于7F导引导管内置入5F射频消融导管(IBI-Therapy,5F,St.jude Medical),分别在双侧肾动脉行RDN术。消融模式为:温控45~50℃,功率5~15 W,进行螺旋式消融,每个点消融30~60 s。术后复查肾动脉造影,检查有无肾动脉狭窄。所有患者在术前、术后即刻使用QCA进行肾动脉直径的测量并记录数值。所有患者术中记录消融参数指标,包括阻抗起始值、阻抗最低值、消融点位、消融功率等。所有患者于RDN术前、术后6个月检测动态血压。患者出院后使用电子血压计自测血压,每天测血压3~5次并记录取平均值。
1.3 观察指标主要观察指标是所有患者术前、术后即刻的肾动脉直径,所有患者从入组开始至术后6个月时的动态血压;次要终点指标是急性期和慢性期安全性(消融术后即刻有无>60%的肾动脉狭窄)。
1.4 统计学处理 使用SPSS 17.0软件进行统计学分析。首先检验所有指标数值是否符合正态分布,若符合正态分布,则采用 x±s 表示,并采用配对样本t检验比较术前与术后6个月时的差异;若不符合正态分布,则采用中位数(最小值,最大值)表示,并采用Wilcoxon配对比较符号秩检验比较术前与术后6个月时的差异。采用多元线性回归分析评价肾动脉直径的改变对血压改变的预测价值。检验水准(α)为0.05。 2 结 果 2.1 患者临床基线资料在2013年2月至10月间,共入选了12例符合标准的难治性高血压患者,入组患者年龄(61±12)岁,入院动态血压(185±15)/(99±9) mmHg,心率(70±8)次/min(动态心电图平均心率),eGFR (78±14) mL/(min·1.73 m2)。所有患者治疗高血压病均5年以上,入院前平均服用降压药物为4.7种(均包含1种利尿剂)。有3例患者合并糖尿病,2例患者合并高脂血症。
2.2 RDN术对动态血压的影响所有入选患者均成功完成RDN术及术后6个月的随访。在RDN术后6个月,所有患者动态血压平均下降31/15 mmHg,动态收缩压由术前的(161±21)mmHg 降至术后6个月的(130±12)mmHg(P<0.001),动态舒张压由术前的(92±14)mmHg下降至术后的(77±9)mmHg(P<0.001),平均分别下降了19.3%和16.3%。术后6个月时,随访患者服用降压药物种类情况,结果显示,患者平均服药种类为3种。
2.3 RDN术对患者术后即刻肾动脉直径的影响我们测量了所有患者术前、术后即刻肾动脉3级分支的直径,结果显示,所有患者的肾动脉直径均出现扩张,平均增加了0.6 mm,肾动脉直径由术前的(2.4±0.2)mm增加到术后即刻的(3.0±0.4)mm(P<0.001),平均增加了25%。
2.4 消融参数与肾动脉直径扩张之间的相关性比较将消融参数(包括消融阻抗起始值、消融阻抗最低值、消融点位、阻抗下降值、消融功率等)与肾动脉直径(术前、术后即刻)进行相关性比较,结果显示,阻抗下降值与肾动脉术后即刻的直径相关(y=1.461+0.086x,r=0.74,P=0.006;图 1)。其余消融参数指标(包括阻抗起始值、消融点位、阻抗最低值、消融功率等)与术后即刻肾动脉直径无明显相关性(P均>0.05)。
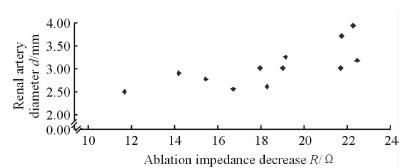
|
图 1 难治性高血压患者消融术后肾动脉直径与阻抗下降值相关 Fig 1 Correlation between renal artery diameter and the ablation impedance decrease in patients with resistant hypertension |
将患者术前、术后6个月的动态血压(包括24 h平均收缩压、24 h平均舒张压、日间收缩压、日间舒张压、夜间收缩压、夜间舒张压以及相应血压数值手术前后的变化值)与患者术后即刻的肾动脉直径、患者的年龄、性别、术前动态血压进行多元线性回归分析,结果显示,所有这些动态血压数值中,仅有24 h平均收缩压下降值以及日间下降值所拟合的多元线性回归方程有统计学意义(P=0.05)。但对这两个回归方程中的参数估计进行回归系数t检验,所有的检测项目,包括患者术后即刻的肾动脉直径、患者的年龄、性别、术前动态血压,差异均无统计学意义(P均>0.05)。这说明患者术后的肾动脉直径扩张程度并不能预测患者术后6个月的血压水平。
2.6 RDN术对患者心率、肝肾功能的影响及相关并发症所有患者均于术前及术后6个月随访时记录动态心电图及肝、肾功能,结果显示,RDN术不会影响患者的心率及肝、肾功能(表 1)。所有患者均未发生任何外周血管并发症。2例患者术后股动脉穿刺处出现淤斑,经热敷后好转;1例患者术中出现一过性心动过缓,使用阿托品后好转;1例患者术中无法耐受疼痛,予静脉麻醉后成功完成手术。
|
|
表 1 难治性高血压患者消融术前及术后6个月肾功能、肝功能和心率的变化 Tab 1 Renal function,liver function and HR before and 6 months after RDN in patients with resistant hypertension |
交感神经系统的过度激活是高血压发生的重要因素,其可通过增加外周血管阻力、提高心脏每搏输出量以及心率等方式来促进高血压的进一步发展,而肾交感神经(交感神经系统的一个重要组成部分)的异常兴奋是诱导普通高血压进展为顽固性高血压的一个极其重要的因素[7, 8, 9, 10]。RDN是近年来兴起的一项新型介入治疗技术。它的主要方法为经皮插入改良的导管,通过射频热损伤肾动脉壁上的交感神经达到去肾交感神经化支配的目的。一项近期公布的全球SYMPLICITY注册研究结果显示,无法控制的高血压患者RDN术后的诊室血压和动态血压均显著降低[11],进一步证实了RDN术在难治性高血压治疗中的疗效。
肾交感神经可分为肾交感传入神经和肾交感传出神经,主要分布于肾动脉的外膜、肾小管以及肾小球旁器,肾交感神经激活可增加肾素的释放、水钠潴留,并可显著降低肾动脉血流量[12, 13, 14, 15]。肾动脉血流量主要由肾交感传出神经控制和影响。肾交感传出神经过度激活、肾动脉阻力显著增加从而导致肾动脉血流量降低被认为是高血压进展以及心肾综合征发生的主要机制之一[16]。通过以上机制我们可以推测,有效阻断肾动脉交感神经后,肾动脉血流量会因为肾动脉阻力的降低而升高,肾动脉直径会相应扩张。本次研究中,我们分别于术前、术后即刻测量肾动脉3级分支直径,结果显示,所有患者的肾动脉3级分支平均直径在RDN术后即刻扩张了25%(由术前的2.4 mm扩张至3.0 mm),与术前相比差异有统计学意义(P<0.001),提示RDN术可有效阻断肾动脉交感神经,并在术后即刻即可观察到肾动脉血流量的改善。
本研究发现,阻抗下降值与肾动脉术后即刻的直径显著相关,说明在消融过程中,阻抗下降越多,下降幅度越大,肾动脉直径扩张也越多。阻抗下降值可以作为一个预测肾动脉直径扩张的因子,并指导我们在消融手术过程中实时监控消融的状态。根据物理学原理,消融阻抗主要和导管的贴壁程度以及消融时周围组织温度有关。导管贴壁越好、消融时周围组织温度越高,则阻抗下降幅度越大(有效消融电流通过越多)。阻抗下降值与肾动脉直径扩张的正相关性也进一步证实,越充分的消融(通过阻抗下降值幅度进行判断),则其有效阻断肾动脉交感神经越确切(通过肾动脉直径进行判断)。
本研究使用动态血压作为评估患者RDN术是否有效的标准。相比于诊室血压,动态血压在预测心脑血管事件方面有一定的优势[17, 18],并且动态血压信息量更大,数据更准确,并可有效避免白大衣高血压等假性高血压[19]。我们于术前、术后6个月对入选的12例难治性高血压患者进行动态血压检测,结果显示,术后6个月所有患者动态血压(无论是收缩压还是舒张压)显著下降。本次研究所显示的动态血压下降幅度明显高于全球SYMPLICITY注册研究最近公布的动态血压下降值[11],可能是因为我们入选的患者数量较少(12例),患者基线血压较高(术前动态血压达到161/92 mmHg)。此外,我们使用的消融导管也与其不同。我们使用了5F射频消融导管,根据我们前期的动物实验研究结果显示,使用5F射频消融导管的RDN术可明显抑制肾素-血管紧张素-醛固酮系统(RAAS)活性和儿茶酚胺的释放[20],并且该导管相较于SYMPLICITY 导管[11]消融功率更高,有效消融范围更深,故其在RDN手术中阻断肾交感神经更完全。
我们也对动态血压下降幅度和肾动脉即刻扩张幅度进行了多元线性回归分析,并未观察到二者之间差异有统计学意义,说明肾动脉直径的小幅度改变,不足以作为一个单独的预测因子来判断患者的远期血压,但从所有患者肾动脉直径均明显扩张(100%)、所有患者动态血压均显著下降(100%)这一结果,我们可以推测,肾动脉直径的改变似乎与RDN术的成功有一定的关联。目前国内外临床试验主要将去甲肾上腺素溢出率作为预测RDN术有效性的一个指标,但该指标临床检测较为烦琐,且不能在RDN术后即刻就进行评价,这一指标显然无法作为判断RDN术的手术终点。而在本研究中,我们观察到肾动脉直径在RDN术后即刻(有效阻断肾交感神经)明显扩张,似乎提示可将肾动脉直径作为判断RDN术手术终点的一个参考指标。
综上,本研究发现RDN术可显著降低顽固性高血压患者的动态血压水平,并可在术后即刻观察到肾动脉直径的显著扩张,肾动脉直径的扩张程度和消融阻抗的下降值呈正相关,但肾动脉直径的扩张程度无法预测患者的远期血压水平。
| [1] | Kearney P M, Whelton M, Reynolds K, Muntner P, Whelton P K, He J. Global burden of hypertension: analysis of worldwide data[J]. Lancet, 2005, 365:217-223. |
| [2] | Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, Germano G, et al; Management of Arterial Hypertension of the European Society of Hypertension; European Society of Cardiology. 2007 Guidelines for the management of arterial hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC)[J]. J Hypertens, 2007, 25:1105-1187. |
| [3] | Schlaich M P, Schmieder R E, Bakris G, Blankestijn P J, Böhm M, Campese V M, et al. International expert consensus statement: percutaneous transluminal renal denervation for the treatment of resistant hypertension[J]. J Am Coll Cardiol, 2013, 62:2031-2045. |
| [4] | Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Böhm M, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC)[J]. Eur Heart J,2013,34:2159-2219. |
| [5] | DiBona G F. Neural control of the kidney: past, present, and future[J]. Hypertension, 2003, 41:621-624. |
| [6] | DiBona G F, Kopp U C. Neural control of renal function[J]. Physiol Rev,1997,77:75-197. |
| [7] | DiBona G F, Esler M. Translational medicine: the antihypertensive effect of renal denervation[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298: R245-R253. |
| [8] | Parati G, Esler M. The human sympathetic nervous system: its relevance in hypertension and heart failure[J]. Eur Heart J, 2012,33:1058-1066. |
| [9] | Grassi G. Sympathetic neural activity in hypertension and related diseases[J]. Am J Hypertens, 2010,23:1052-1060. |
| [10] | Smith P A, Graham L N,Mackintosh A F, Stoker J B, Mary D A. Relationship between central sympathetic activity and stages of human hypertension[J].Am J Hypertens, 2004,17:217-222. |
| [11] | Bohm M, Mahfoud F, Ukena C, Hoppe U C, Narkiewicz K, Negoita M, et al; GSR Investigators. First report of the Global SYMPLICITY Registry on the effect of renal artery denervation in patients with uncontrolled hypertension[J]. Hypertension, 2015, 65: 766-774. |
| [12] | Zanchetti A S. Neural regulation of renin release: experimental evidence and clinical implications in arterial hypertension[J]. Circulation, 1977,56: 691-698. |
| [13] | Bell-Reuss E, Trevino D L, Gottschalk C W. Effect of renal sympathetic nerve stimulation on proximal water and sodium reabsorption[J]. J Clin Invest, 1976,57:1104 -1107. |
| [14] | Kirchheim H, Ehmke H, Persson P. Sympathetic modulation of renal hemodynamics, renin release and sodium excretion[J]. Klin Wochenschr, 1989,67: 858-864. |
| [15] | Kon V. Neural control of renal circulation[J]. Miner Electrolyte Metab, 1989,15(1-2):33-43. |
| [16] | Shlipak M G, Massie B M. The clinical challenge of cardiorenal syndrome[J]. Circulation, 2004,110:1514-1517. |
| [17] | Mancia G, Fagard R, Narkiewicz K, Redón J, Zanchetti A, Böhm M, et al; Task Force Members. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC)[J]. J Hypertens,2013,31:1281-1357. |
| [18] | Clement D L, De Buyzere M L, De Bacquer D A, de Leeuw P W, Duprez D A, Fagard R H, et al; Office versus Ambulatory Pressure Study Investigators. Prognostic value of ambulatory blood-pressure recordings in patients with treated hypertension[J]. N Engl J Med, 2003,348:2407-2415. |
| [19] | Stergiou G S, Baibas N M, Gantzarou A P, Skeva I I, Kalkana C B, Roussias L G, et al. Reproducibility of home, ambulatory, and clinic blood pressure: implications for the design of trials for the assessment if antihypertensive drug efficacy[J]. Am J Hypertens, 2002,15(2 Pt 1):101-104. |
| [20] | 徐佑龙,谢 赟,郜俊清,严鹏勇,张文全,孙剑光,等. 5F射频消融导管在经皮肾动脉交感神经消融术中的安全性和有效性研究[J]. 中国介入心脏病学杂志,2013,21:112-116. |
 2015, Vol. 36
2015, Vol. 36


