心跳骤停后脑组织处于严重的缺血缺氧状态,随着自主循环恢复(ROSC)出现再灌注损伤。目前,临床上心肺复苏后只有不到20%的心跳骤停患者经心肺复苏后能完全恢复,且复苏后存活的患者中约20%~40%为永久性脑损伤[1]。因此,心肺复苏后神经功能是否恢复是衡量心肺复苏是否成功的关键。使用脑保护作用的药物减少心脏骤停时的脑缺氧损伤和随后的再灌注损伤是目前研究的热点。纳洛酮是非竞争性阿片肽受体拮抗剂,可特异性地阻断β内啡肽(β-EP)的毒性作用,另外,还可通过其非阿片受体样作用增加复苏的成功率,如兴奋延髓的呼吸中枢,稳定细胞膜对钙离子的通透性,解除胞内钙离子超载,对脑组织及神经发挥一定的保护作用[2, 3]。
肾上腺素心内注射是传统的心肺复苏术,但由于直接注射药物进入心脏,有可能导致心肌损伤与坏死。小脑延髓池是人体靠近生命中枢的最短路径,通过小脑延髓池注射给药可避免药物受血脑屏障的影响,已有动物实验通过小脑延髓池注射进行细胞移植可获得良好的细胞分布[4],但尚无将小脑延髓池注射药物应用于心肺复苏脑保护的研究。本研究采用窒息法建立大鼠心肺复苏模型,通过检测反映脑损伤程度的早期敏感指标血清S100β蛋白水平[5]的变化及观察脑组织的病理改变,评价小脑延髓池注射纳洛酮的脑保护作用效果。 1 材料和方法 1.1 实验动物及分组
雄性SD大鼠30只,SPF级,体质量180~220 g,由广州中医药大学实验动物中心[动物生产许可证号:SCXK(粤)2013-0020]提供。随机分为3组:假手术组、常规复苏组、纳洛酮处理组,每组10只。各组大鼠在体质量、基线血压和心脏脉搏等生理参数差异均无统计学意义。 1.2 心跳骤停模型的建立
手术前将SD大鼠禁食不禁水12 h,以10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉。常规复苏组及纳洛酮处理组采用夹闭气管窒息法建立大鼠心跳骤停模型[6]并进行心肺复苏,假手术组不予以夹管窒息和心肺复苏。 1.3 心肺复苏方法
心跳骤停2 min后,采用Utstein模式[7]进行心肺复苏,开放夹闭的气管,接动物呼吸机行机械通气,并进行胸外按压复苏(按压频率160次/min,按压深度为大鼠胸廓前后径的1/3)。复苏的同时各组大鼠给药治疗,常规复苏组静脉注射肾上腺素注射液0.2 mg/kg[8](福州海王福药制药有限公司);纳洛酮处理组小脑延髓池穿刺注射纳洛酮注射液2 mg/kg(贵州景峰注射剂有限公司)。假手术组作为对照静脉注射生理盐水。复苏成功标准:出现自主心律、脉搏波且收缩压≥60 mmHg(1 mmHg=0.133 kPa)持续10 min以上判定为ROSC;持续抢救30 min以上自主循环仍不恢复则终止抢救。待自主呼吸完全恢复后,停止按压,缝合伤口,将大鼠放回饲养笼中。 1.4 血清S100β蛋白及NSE含量检测
ROSC后0.5、3、6及24 h,用乙醚麻醉大鼠,经眼眶静脉丛取血。将血液静置1 h后,在4℃下以3 500 r/min离心15 min,取上清液,-80℃超低温冰箱保存备用。采用ELISA法检测血清S100β蛋白及神经元特异性烯醇化酶(NSE)含量。试剂盒由Blue Gene公司提供,操作严格按照试剂盒说明书进行。 1.5 组织病理学检查
ROSC 24 h后,10%水合氯醛麻醉大鼠,迅速取出大鼠的脑组织,置4%多聚甲醛溶液中固定,经乙醇梯度脱水、二甲苯透明、石蜡包埋、切片后进行H-E染色,光学显微镜下观察脑组织病理学改变,并统计单位视野内受损神经元的数量。 1.6 统计学处理
采用SPSS17.0软件进行统计学分析。各组数据以χ ±s表示,多组间比较用方差分析,方差齐性时组间两两比较用LSD法,方差不齐时用Dunnett T3法。检验水准(α)为0.05。 2 结果 2.1 血清S100β蛋白和NSE浓度变化
检测结果(表 1)表明:常规复苏组各时间点大鼠血清S100β蛋白浓度与假手术组比较升高(P <0.01),且随ROSC后时间的增加逐步升高,6 h达到峰值,24 h时有所下降;纳洛酮复苏组大鼠血清S100β蛋白浓度有类似变化趋势,但低于常规复苏组,在ROSC后3 h、6 h及24 h时差异有统计学意义(P <0.05或P <0.01)。常规复苏组各时间点大鼠血清NSE浓度与假手术组比较升高(P <0.05或P <0.01),且24 h内随时间增加逐步升高;纳洛酮复苏组大鼠血清NSE浓度在ROSC后0.5、3 h与假手术组及常规复苏组比较差异无统计学意义,但在ROSC后6 h、24 h与假手术组及常规复苏组比较相比差异均有统计学意义(P <0.05或P <0.01)。
|
|
表 1 各组大鼠血清S100β蛋白及NSE浓度变化 |
ROSC 24 h后,大鼠脑组织H-E染色结果(图 1)显示:假手术组海马区神经胶质细胞排列整齐,结构完整,胞质丰富,核仁清晰,胞质染色较淡;毛细血管形态正常,无明显水肿。常规复苏组海马区神经胶质细胞排列散乱,胞质浓缩、胞核固缩,核仁不清,胶质细胞周围间隙扩大,空泡样改变,胞质嗜伊红;毛细血管明显肿胀变形,微血管体积扩大。纳洛酮复苏组大部分神经细胞胞质丰富,核仁清楚,仅少数神经细胞和毛细血管出现程度不等的水肿样改变及胞核固缩现象。经统计,常规复苏组大鼠受损神经元数量与假手术组比较明显增加(62.4±5.2 vs 3.4±1.1,P <0.01),纳洛酮组受损神经元数量与常规复苏组比较则明显减少(18.8±3.7 vs 62.4±5.2,P <0.01)。
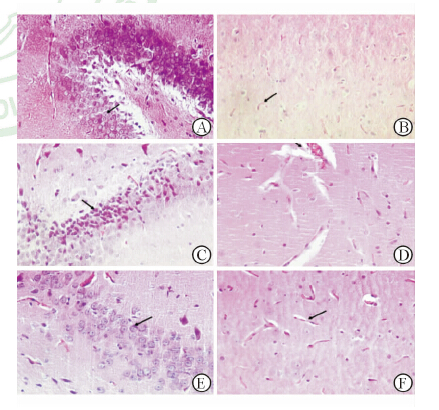
|
图 1 各组大鼠脑组织组织学观察(H-E染色)
A: 假手术组正常的神经元(胞质丰富、细胞核边界及核仁清晰,箭头示);B:假手术组微血管(箭头示)较少,不明显;C:常规复苏组受损神经元(神经元胞质浓缩、染色加深,胞核固缩,核仁不清,箭头示);D:常规复苏组微血管肿胀、变形(箭头示);E:纳洛酮复苏组正常的神经元(箭头示),受损神经元较少;F:纳洛酮复苏组有少量的微血管水肿(箭头示). Original magnification:×400 |
心肺复苏是心肺复苏技术的简称,是针对心跳、呼吸停止所采取的抢救措施,即用胸外心脏按压或其他方法形成暂时的人工循环达到恢复苏醒和挽救生命的目的。传统的心肺复苏术一般采用心室腔内注射肾上腺素等药物,但由于直接注射药物进入心脏,有可能导致心肌损伤与坏死。我院急诊科从1989年开始逐渐取消了心肺复苏时的肾上腺素心内注射,改为静脉注射、皮下注射或气管内滴入的方法给药,但复苏的效果并不理想。心肺复苏的黄金时机是最初的4~8 min,小脑延髓池不但是人体靠近生命中枢的最短路径,而且通过小脑延髓池注射给药方式可避免药物受血脑屏障的影响,使药物通过局部作用或其他的局部渗透方法到达脑组织从而发挥作用。该方法在动物模型上具有一定的可行性及可操作性,对今后急救医疗和临床抢救,特别是心肺脑复苏有一定的指导意义,也为一些患者的脑水肿或脑出血的急危重病的抢救提出了较新的抢救思路。临床上也有报道经小脑延髓池穿刺引流治疗第四脑室出血并获得良好疗效[9]。但由于小脑延髓池靠近生命中枢,小脑延髓池窝穿刺术操作的风险较大,有一定的危险性,进行穿刺操作时必须熟练,进针时要缓慢,避免伤及脑干。
血清S100β蛋白和NSE水平是判断脑损伤程度的早期敏感指标[5]。S100β蛋白是一种钙离子结合酸性蛋白,由星状胶质细胞和少突胶质细胞合成和分泌,并被认为是神经胶质细胞的标志蛋白。其参与调节细胞内外钙离子水平,调节能量代谢,修复神经细胞损伤等,具有多种生物功能[10]。正常情况下S100β蛋白主要存在于星形胶质细胞的胞核和胞质,当神经细胞受损伤后,其由胞液进入到脑脊液中,并透过损伤的血脑屏障进入血液中。Reeves等[11]实验证实高浓度S100β蛋白对神经元具有毒性作用,其可以升高神经元内钙离子浓度,导致胞内钙超载,诱导神经元凋亡或坏死,而神经元死亡又可引发小胶质细胞活化和白细胞的分泌,后者上调星形胶质细胞表达S100β蛋白,形成一个正反馈环路,加重神经元凋亡或坏死[12]。Bttiger等[13]研究表明,脑缺血再灌注损伤后血清S100β浓度处于不断变化的过程。NSE为烯醇化酶的二聚体同工酶,特征性地位于神经元和神经内分泌细胞胞质中,血清与脑脊液中也有少量NSE。神经元损伤和血脑屏障完整性破坏后,NSE由细胞内扩散到神经元间隙,并透过损伤的血脑屏障进入血液中。以往研究认为,S100β是引起脑缺血再灌注损伤的原因,神经元损伤和血脑屏障完整性破坏后,导致NSE的增加[14]。因此,检测血液中S100β及NSE蛋白浓度可反映神经细胞损伤程度。
纳洛酮为羟二氢吗啡酮衍生物,是特异的吗啡受体拮抗剂,能竞争性抑制或取代吗啡样物质(如β-EP)与受体结合[2],阻断和逆转内源性阿片肽的毒性作用。人体在缺氧及颅脑损伤等严重应激状态下,腺垂体释放ACTH和β-EP引起心脑等脏器功能障碍,同时加重脑组织水肿,使大脑神经元突触传递障碍。由于纳洛酮的亲和力大于阿片肽,一方面可以反馈抑制内源性阿片肽物质,另一方面由于纳洛酮对特异性阿片肽受体的有效拮抗而加速了外周血β-EP的分解,使β-EP失活,从而逆转β-EP对循环和呼吸的抑制减轻脑水肿,促进损伤神经功能恢复[3]。除此之外,纳洛酮还可通过其非阿片受体样作用增加复苏的成功率,减少神经损伤,如恢复膜泵Na+-K+-ATP酶功能,稳定细胞膜对钙离子的通透性,抑制钙离子内流,解除胞内钙离子超载,减少或避免细胞死亡等[15]。
本研究发现,大鼠恢复自主循环0.5 h后,血清S100β及NSE蛋白均显著增加,说明神经元及星形胶质细胞被破坏,血脑屏障受损。S100β在6 h达到峰值,而NSE浓度在24 h内持续升高,说明存在着进行性的星形胶质细胞和神经元缺氧性损伤。两者血清浓度的不同变化趋势可能是由于NSE相对分子质量比S100β蛋白大,透过细胞膜的能力较弱,且其半衰期较S100β蛋白长,能长时间存在于血液中。与常规复苏组比较,纳洛酮复苏组3 h后血清S100β显著降低,6 h后血清NSE浓度显著降低,且大脑病理损伤明显改善,说明纳洛酮对血清S100β蛋白、NSE浓度的升高具有明显的抑制作用,能有效保护心肺复苏后大鼠脑组织,预防脑损伤。生命中枢位于延脑,而小脑延髓池注射复苏药物是进入生命中枢的最短路径,这就意味着小脑延髓池注射纳洛酮可以快速而有效地使药物进入脑组织,在心肺复苏及保护脑缺血再灌注损伤方面较传统肾上腺素心内注射具有明显优势。本研究有望提出新方法用于脑缺氧和脑复苏的研究,对促进小脑延髓池穿刺注射复苏药物在急救医学领域中的应用具有重要意义。
| [1] | 刁梦元,林兆奋.心肺复苏后脑损伤生化标志物研究进展[J].中华急诊医学杂志,2013,22:938-940. |
| [2] | 贺晓雅,凌宗秀. 纳洛酮的药理作用和临床应用[J]. 现代医药卫生, 2004, 20:2665-2666. |
| [3] | 吴伟中. 纳洛酮作用机制及临床应用探讨[J].海南医学, 2010,10:112-114. |
| [4] | Janowski M,KuzmaKozakiewicz M,Binder D,Habisch H J,Habich A,Lukomska B, et al. Neurotransplantation in mice: the concordelike position ensures minimal cell leakage and widespread distribution of cells transplanted into the cisterna magna[J]. Neurosci Lett,2008,430:169-174. |
| [5] | Einav S,Kaufman N,Algur N,Kark J D. Modeling serum biomarkers S100 beta and neuronspecific enolase as predictors of outcome after outofhospital cardiac arrest: an aid to clinical decision making[J].J Am Coll Cardiol,2012,60: 304-311. |
| [6] | 陈寿权,李章平,王姗姗,黄唯佳,程俊彦,王万铁,等.窒息法致大鼠心脏骤停模型复苏的影响因素[J].中华急诊医学杂志,2005,14: 814-817. |
| [7] | Idris A H, Becker L B, Ornato J P, Hedges J R, Bircher N G, Chandra N C, et al.Utsteinstyle guidelines for uniform reporting of laboratory CPR research. A statement for healthcare professionals from a task force of the American Heart Association, the American College of Emergency Physicians, the American College of Cardiology, the European Resuscitation Council, the Heart and Stroke Foundation of Canada, the Institute of Critical Care Medicine, the Safar Center for Resuscitation Research, and the Society for Academic Emergency Medicine. Writing Group[J].Circulation, 1996, 94: 2324-2336. |
| [8] | 靖颖霞.三种心脏骤停大鼠模型心肺复苏效果及脑损伤程度的研究[D].长沙:中南大学, 2012. |
| [9] | 吴世新,孙丽萍,崔绍华,付丰言.小脑延髓池穿刺治疗第四脑室出血临床观察[J]. 实用心脑肺血管病杂志,2002,10:199-201. |
| [10] | Donato R. S100: a multigenic family of calciummodulated proteins of the EFhand type with intracellular and extracellular functional roles[J]. Int J Biochem Cell Biol, 2001, 33: 637-668. |
| [11] | Reeves R H, Yao J, Crowley M R, Buck S, Zhang X, Yarowsky P, et al. Astrocytosis and axonal proliferation in the hippocampus of S100β transgenic mice[J]. Proc Natl Acad Sci U S A,1994, 91:5359-5363. |
| [12] | 许松青,田朝伟,刘 芳,林 仪,陈晓辉,陈敏生.纳洛酮对心肺复苏犬脑组织病理及S100蛋白表达的影响[J]. 广州医学院学报,2006, 34:16-20. |
| [13] | B?ttiger B W, M?bes S, G?ltzer R, Bauer H, Gries A, B?rtsch P, et al. Astroglial protein S-100 is an early and sensitive marker of hypoxic brain damage and outcome after cardiac arrest in humans[J].Circulation,2001,103:2694-2698. |
| [14] | Shinozaki K, Oda S, Sadahiro T, Nakamura M, Abe R, Nakada T A, et al. Serum S-100B is superior to neuronspecific enolase as an early prognostic biomarker for neurological outcome following cardiopulmonary resuscitation[J].Resuscitation,2009, 80:870-875. |
| [15] | 刘永琴,高永良.纳洛酮的研究进展[J].中国新药杂志, 2005,14:403-407. |
 2015, Vol. 36
2015, Vol. 36


