2. 湖南医药学院基础医学部, 怀化 418000;
3. 南华大学医学院心血管疾病研究所, 衡阳 412000;
4. 南华大学实验动物学部, 衡阳 412000;
5. Neurim Pharmaceuticals Ltd., Tel-Aviv 69710, Israel
2. Division of Basic Medical Sciences, Hunan University of Medicine, Huaihua 418000, Hunan, China;
3. Institute of Cardiovascular Disease, University of South China Medical School, Hengyang 412000, Hunan, China;
4. Division of Experimental Animal, University of South China, Hengyang 412000, Hunan, China;
5. Neurim Pharmaceuticals Ltd., Tel-Aviv 69710, Israel
糖尿病(diabetes mellitus,DM)特征性病理生理改变是高血糖、碳水化合物和脂肪代谢紊乱导致的胰岛素抵抗或胰岛素分泌的绝对或相对不足[1, 2],以2型糖尿病(type 2 diabetes mellitus,T2DM)为主。T2DM发病原因主要是胰岛素信号转导通路破坏,产生胰岛素抵抗(insulin resistance,IR)[3, 4]。蛋白激酶B (protein kinase B,PKB)又称Akt,是胰岛素信号转导过程中的关键分子之一[5],磷酸化PKB(p-PKB)是其活性形式[6]。
褪黑素 (melatonin,Mel) 是一种循环激素,主要由松果体释放,可影响糖尿病和有关代谢紊乱[7]。褪黑素生物学效用广泛,但代谢快,半衰期短,直接药用效果不明显,提取与合成也相对较难。Neu-P11是由Neurim Pharmaceuticals公司合成开发的一种新型褪黑素非选择性受体激动剂,具有半衰期长、不良反应小、体外合成易等优点,可与褪黑素受体作用,发挥一系列的生物学作用[8]。但目前关于Neu-P11对T2DM的确切作用机制仍不清楚。因此,本研究首先建立胰岛素抵抗脂肪细胞模型,然后采用Neu-P11、褪黑素、Luzindole(褪黑素受体2非选择性拮抗剂[9])分别处理胰岛素抵抗脂肪细胞,观察PKB、p-PKB蛋白表达变化,探讨Neu-P11对胰岛素抵抗的可能作用及机制。 1 材料和方法 1.1 主要材料及试剂
地塞米松(DEX)、牛胰岛素、Luzindole、IBMX购自Sigma公司;3T3-L1小鼠成纤维细胞株购自中国医学科学院基础医学研究所;DMEM低糖/高糖培养基、胰蛋白酶、胎牛血清购自美国Gibco公司;PKB、p-PKB一抗购自Santa Cruz公司;褪黑素、Neu-P11由以色列Neurim Pharmaceuticals Ltd.公司提供。 1.2 3T3-L1细胞的培养和分化
将3T3-L1小鼠成纤维细胞置于37℃、5% CO2的培养箱中用含10%新生牛低糖DMEM培养基进行培养,细胞长至培养瓶的80%~90%时进行传代,每48 h换液1次,等细胞长满2 d后用“鸡尾酒”法进行诱导分化,48 h后用10%胎牛血清( FBS)、5 mg/L牛胰岛素低糖DMEM培养基继续培养4 d;再用10%FBS低糖DMEM培养基继续培养,诱导分化10~12 d,90%以上细胞呈脂肪细胞表型;再用油红O染色,鉴定脂肪细胞的形态和分化情况[10]。 1.3 胰岛素抵抗模型的建立和鉴定
参照文献[10, 11]在低糖DMEM培养基中加入1% FBS,1%牛血清白蛋白(BSA),作用于已经分化成熟的脂肪细胞24 h为敏感组(IS组,对照组);在高糖DMEM培养基中加入1% FBS,1% BSA,1 μmol/L的胰岛素作用于已经分化成熟的脂肪细胞24 h为胰岛素抵抗组(IR组,建模组),建立胰岛素抵抗模型。作用24 h后,鉴定建模是否成功:用 50、100、 200 nmol/L胰岛素分别作用于胰岛素抵抗细胞,6 h后收集培养液上清,用葡萄糖氧化酶法测定培养液中葡萄糖浓度,计算糖消耗量,根据细胞糖消耗变化来鉴定模型是否成功[12]。实验重复3次。 1.4 实验分组及处理
将胰岛素抵抗组细胞分为5组:(1)未加药组(IR组);(2)Mel组 (10 nmol/L Mel处理细胞6 h) ;(3)Neu-P11组 (10 nmol/L Neu-P11处理细胞6 h) ;(4)Mel+Luzindole组 (10 nmol/L Mel+100 nmol/L Luzindole联合处理细胞6 h) ;(5)Neu-P11+Luzindole组(10 nmol/L Neu-P11+100 nmol/L Luzindole联合处理细胞6 h)。收集各组脂肪细胞,用蛋白质印迹法[13]检测PKB及p-PKB蛋白的表达。实验重复3次。 1.5 统计学处理
采用 SPSS 19.0软件进行统计学处理,结果以χ±s表示,检验水准(α)为0.05。 2 结果 2.1 Neu-P11对胰岛素抵抗脂肪细胞PKB表达的影响
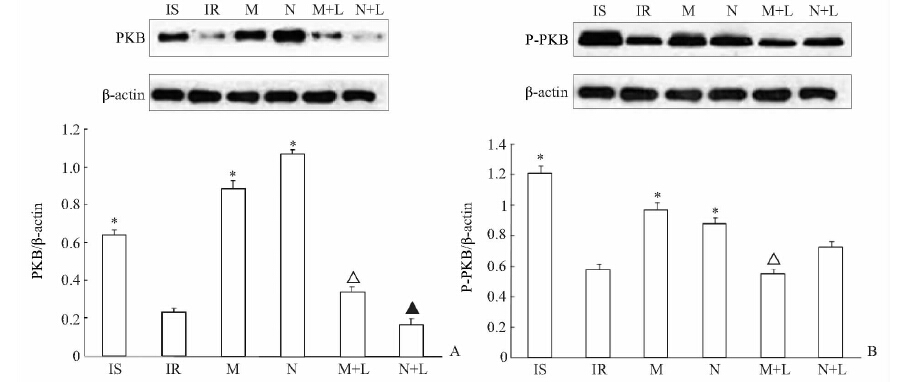
结果(图 1A)表明:Mel、Neu-P11组PKB蛋白表达高于IR组(P <0.05);Mel+Luzindole组、Neu-P11+Luzindole组PKB蛋白表达低于Mel组、Neu-P11组,差异有统计学意义 (P <0.05)。
|
图 1 Neu-P11对3T3-L1脂肪细胞PKB(A)及p-PKB蛋白(B)蛋白表达的影响
IS:胰岛素敏感组;IR:未加药组;M: 10 nmol/L褪黑素组;N: 10 nmol/L Neu-P11组;M+L: 10 nmol/L褪黑素+100 nmol/L Luzindole组;N+L:10 nmol/L Neu-P11+100 nmol/L Luzindole组.*P <0.05 vs IR组;ΔP <0.05 vs M组;▲P <0.05 vs N组;n=3,χ±s |
结果(图 1B)表明:Mel组、Neu-P11组p-PKB蛋白表达水平高于IR组 (P <0.05);Mel+Luzindole组p-PKB蛋白表达低于Mel组,差异有统计学意义 (P<0.05);Neu-P11+Luzindole组p-PKB蛋白表达与Neu-P11组差异无统计学意义。 3 讨论
Mel也被称为“黑暗激素”,其与褪黑素类似物及褪黑素受体结合,可在糖尿病发生过程中发挥重要作用[14, 15]。已有研究证实,Mel能阻止因AKT磷酸化减少引起的胰岛素介导的葡萄糖摄取减少[16]。PKB是一种丝氨酸/苏氨酸蛋白激酶,在胰岛素刺激磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)信号转导中起着重要作用[5, 17]。高血糖会影响糖尿病大鼠Akt的活动[18]。本研究结果发现胰岛素抵抗组的脂肪细胞PKB、p-PKB 表达明显低于敏感组 (P <0.05),提示胰岛素受体后信号通路中的PKB、p-PKB与糖尿病可能有相关性。研究结果表明:Mel、Neu-P11均能增加PKB、p-PKB蛋白表达(P <0.05);Luzindole能够阻断Mel、Neu-P11增加PKB的作用(P <0.05),也能够阻断Mel增加p-PKB的作用(P <0.05),但不能阻断Neu-P11增加p-PKB的作用。
综上所述,本研究结果表明:褪黑素、Neu-P11可提高胰岛素抵抗细胞PKB、p-PKB蛋白表达,褪黑素和Neu-P11可能是通过与褪黑素受体2结合发挥增加PKB蛋白表达的作用;褪黑素可能通过与褪黑素受体2结合来增加p-PKB蛋白的表达;但是Neu-P11提高p-PKB蛋白表达可能是通过其他途径,仍有待进一步研究。
| [1] | Othman E M, Hintzsche H, Stopper H. Signaling steps in the induction of genomic damage by insulin in colon and kidney cells[J].Free Radic Biol Med,2014,68:247-257. |
| [2] | 任春久,张 瑶,崔为正,牟志美.氧化应激在2型糖尿病发病机制中的作用研究进展[J].生理学报, 2013,65:664-673. |
| [3] | Chakraborty C,Doss C G,Bandyopadhyay S,Agoramoorthy G.Influence of miRNA in insulin signaling pathway and insulin resistance: micro-molecules with a major role in type-2 diabetes[J].Wiley Interdiscip Rev RNA,2014,5:697-712. |
| [4] | 何 明. 胰岛素受体后信号通路与妊娠期糖尿病发病机制的研究[D]. 华中科技大学, 2009. |
| [5] | 郑晓珂,王玮玮,冯卫生.胰岛素PI3K/PKB信号转导通路研究进展[J].中国新药杂志, 2012,21:2765-2770. |
| [6] | He L,Simmen F A,Mehendale H M, Ronis M J,Badger T M.Chronic ethanol intake impairs insulin signaling in rats by disrupting Akt association with the cell membrane. Role of TRB3 in inhibition of Akt/protein kinase B activation[J].J Biol Chem,2006, 281:11126-11134. |
| [7] | Espino J,Pariente J A,Rodriguez A B.Role of melatonin on diabetes-related metabolic disorders[J].World J Diabetes,2011,2:82-91. |
| [8] | She M, Deng X, Guo Z, Laudon M, Hu Z, Liao D, et al. NEU-P11, a novel melatonin agonist, inhibits weight gain and improves insulin sensitivity in high-fat/high-sucrose-fed rats[J].Pharmacol Res,2009, 59: 248-253. |
| [9] | Reppert S M, Weaver D R, Ebisawa T.Cloning and characterization of a mammalian melatonin receptor that mediates reproductive and circadian responses[J].Neuron,1994, 13:1177-1185. |
| [10] | 李秀平,尹卫东,胡晓波,佘美华,王平平,张素君,等.褪黑素受体激动剂Neu-P11对胰岛素抵抗3T3-L1脂肪细胞IRS-1和GLUT-4表达的影响[J].第二军医大学学报,2013,34:561-564.Li X P, Yin W D, Hu X B, She M H, Wang P P, Zhang S J, et al. Effect of melatonin receptor agonist Neu-P11 on expression of IRS-1 and GLUT-4 in insulin-resistant adipocytes[J]. Acad J Sec Mil Med Univ, 2013,34:561-564. |
| [11] | 张汝学,贾正平,李茂星,郭丽民,张小华. 体外胰岛素抵抗细胞模型的建立及在药物筛选中的应用[J].中国药理学通报,2008, 24:971-976. |
| [12] | 李 迪,王冠梁,山梦雅,刘甲寒,王 琳,朱德增.熊果酸对3T3-L1脂肪细胞胰岛素抵抗模型CAP表达的影响[J].中西医结合学报,2012,10:886-893. |
| [13] | 李秀平,蔡世昌,尹卫东,胡晓波,Moshe Laundon.Neu-p11/Luzindolez在胰岛素抵抗脂肪细胞模型中对脂联素/内脏脂肪素的影响[J].生物物理学报,2013,29:422-432. |
| [14] | Singh M, Jadhav H R. Melatonin: functions and ligands[J].Drug Discov Today,2014,19:1410-1418. |
| [15] | Teodoro B G, Baraldi F G, Sampaio I H, Bomfim L H, Queiroz A L, Passos M A, et al. Melatonin prevents mitochondrial dysfunction and insulin resistance in rat skeletal muscle[J].J Pineal Res,2014,57:155-167. |
| [16] | Tosini G,Owino S,Guillaume J L,Jockers R .Understandingmelatoninreceptor pharmacology: Latest insights from mouse models, and their relevance to human disease[J].Bioessays,2014,36:778-787. |
| [17] | Viglietto G, Amodio N, Malanga D, Scrima M, De Marco C. Contribution of PKB/AKT signaling to thyroid cancer[J].Front Biosci (Landmark Ed), 2011,16:1461-1487. |
| [18] | Qu Z S,Li L,Sun X J,Zhao Y W,Zhang J,Geng Z,et al.Glycogen synthase kinase-3 regulates production of amyloid-β peptides and tau phosphorylation in diabetic rat brain[J].ScientificWorldJournal,2014,2014:878123. |
 2015, Vol. 36
2015, Vol. 36


