下端食管括约肌(lower esophageal sphincter,LES)松弛是胃食管反流病(gastroesophageal reflux disease,GERD)发病的重要机制之一[1]。针对该病因的治疗一直是国内外学者关注和研究的热点。合适的GERD动物模型对于LES松弛发病的机制探索以及治疗评价具有重要价值。目前较为公认的构建LES松弛动物模型的方法主要是贲门括约肌切开术[2, 3]和贲门括约肌部分切除术[4],但上述两种术式人为破坏了LES,不能完全解释反流性食管炎的发病。理想的GERD动物模型应既具有典型的临床指标及病理特征,又要尽可能地保持正常生理解剖结构。因此,本研究采用小儿10 Fr双腔导尿管(巴德 Forley Catheter)行LES球囊扩张术,尽可能保持浆膜层及黏膜层的完整,并对比分析其与贲门括约肌切开术和贲门括约肌部分切除术的建模效果,寻求更安全有效且符合生理解剖的反流性食管炎模型的建立方法。 1 材料和方法 1.1 实验动物与分组
健康5个月龄新西兰大白兔45只(第二军医大学实验动物中心),雌雄不拘,体质量2.5~3 kg,随机分为3组:贲门括约肌切开术组(A组),贲门括约肌部分切除术组(B组),Forley导尿管球囊扩张术组(C组),每组各15只。 1.2 手术方法
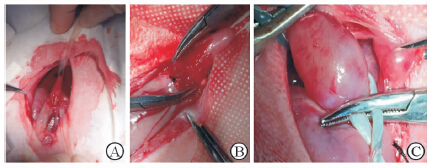
术前24 h禁食,6 h禁水,10%水合氯醛(3 mL/kg)腹腔内注射,麻醉后仰卧固定于木板上,常规备皮及消毒。A组选取剑突下正中切口,长约7 cm,逐层切开进入腹腔,充分暴露并游离食管下端及胃食管交界区,自制2条橡皮筋(从无菌手套取材),从食管后方提起食管,并向上下两端拉伸LES,使LES保持张力,于胃食管交界区前壁做一长约3 cm的纵行切口(食管侧2 cm,胃侧1 cm),完全切开胃食管交界区平滑肌,使胃黏膜及食管黏膜外露(图 1A)。B组术前经口插入胃管,在胃管支撑下,切开并游离胃食管交界区的平滑肌,将胃食管交界区前1/2周径的平滑肌完整切除,使胃黏膜及食管黏膜充分外露(图 1B)。C组:撑开并固定兔上颚,经口插入10 Fr双腔导尿管。取剑突下正中切口,长约7 cm,逐层切开进入腹腔,充分暴露并游离食管下端及胃食管交界区,在食管后方放置2条橡皮筋,标记LES的近端及远端(图 1C),向导尿管气囊内注入8 mL气体后,向外拉出气囊直至拉不出为止,此时气囊位于胃食管交界处。抽出气囊气体后,向食管内拉入2~3 cm,使气囊位于LES处,注入8 mL气体,见下端食管括约肌充分扩张,并以橡皮筋从食管后方牵拉食管以固定扩张的球囊(图 1C),维持5 min,重复2次,每次间隔3 min。术后处理:3组兔术后24 h禁食(术后当天下午可进水),术后1~2 d少量进食,术后3~4 d恢复正常饮食。
|
图 1 3组兔反流性食管炎建模手术 Fig 1 Surgeries for establishing gastroesophageal reflux disease model in rabbits of 3 groups A:Cardia sphincter incision; B:Cardia sphincter partially resection; C: Balloon dilatation of Forley catheter |
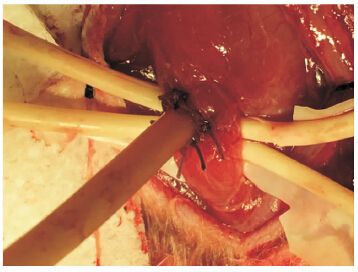
建模前行食管造瘘术,以10%水合氯醛麻醉,取颈正中切口为手术入路,常规消毒、铺单后,切开皮肤、肌肉组织,探及食管,荷包缝合食管侧壁,直径约0.5 cm,切开食管侧壁,置入内径0.8 cm橡皮管0.5 cm后,荷包缝合固定(图 2),注意保持橡皮管内径通畅,将橡皮管缝合固定于食管壁及肌肉组织。在深浅筋膜间建立皮下隧道并开口至颈后中线,将橡皮管沿皮下隧道引出并固定在颈后正中线皮肤开口处,缝合皮肤,封闭橡皮管开口,术毕。pH值测定采用荷兰MMS公司Orion便携式pH监测仪,将导管电极在pH分别为7.0及1.07的缓冲液中校正。开放橡皮管,置入pH值监测电极10 cm左右(位于LES上方5 cm)。将pH值监测仪用自制腹带固定于兔背部。术前及术后第9天监测24 h下端食管pH值,观察24 h内pH值<4的时间所占百分比、反流次数、持续时间超过5 min的反流次数及最长反流时间。
|
图 2 食道造瘘术 Fig 2 Esophageal fistulation |
术后4周处死动物后,取下食管下段及部分贲门组织,纵行切开食管壁,以生理盐水轻冲洗食管腔,肉眼观察食管黏膜并按照食管炎指数评分标准[5]进行评分,具体评分标准为0级:正常;Ⅰa:点状或条状发红、糜烂<2处;Ⅰb:点状或条状发红、糜烂≥2处;Ⅱ级:有条状发红、糜烂,并有融合,但并非全周性,融合<75%;Ⅲ级:病变广泛,发红、糜烂融合呈全周性,融合≥75%。将食管标本置于10%甲醛中固定12~24 h,再将标本脱水、石蜡包埋,进行H-E染色,并于光镜下评估食管炎指数,评价标准为:轻度(鳞状上皮增生、黏膜固有层乳头延伸、上皮细胞层内炎细胞浸润);中度(黏膜糜烂);重度(溃疡形成,Barrett食管改变)[5]。术后4周存活且组织学有食管炎表现的可视为造模成功。 1.5 统计学处理
采用SPSS 19.0软件进行统计学处理,多组计量资料根据数据是否正态分布分别采用方差分析(正态分布)和非参数检验(非正态分布),本研究多组计量资料均符合正态分布,故均采用方差分析。多组计数资料采用χ2检验比较。检验水准(α)为0.05。 2 结 果 2.1 一般情况
A组死亡2只(2/15),死亡原因分别为食管穿孔和腹腔感染。B组死亡6只(6/15),其中2只因食管缺损过大修补后导致食管狭窄而厌食,1只因严重的反流导致窒息,2只出现食管穿孔,1只死于术后1周腹部伤口感染。C组死亡1只(1/15),死于腹腔内出血。B组死亡率较其余两组增高(P=0.057)。 2.2 pH值检测
术后2周,A、B、C各组分别有13、9、14只兔进行食管下段pH值测定。3组兔术后pH<4的时间百分比、反流次数及pH<4持续时间超过5 min的反流次数均高于术前(P<0.05,表 1);而B组兔上述指标均高于其余两组,C组略高于A组,但差异均无统计学意义。
|
|
表 1 各组兔术前及术后2周24 h pH值监测结果比较 Tab 1 Comparison of 24 h pH monitoring results preoperatively and 2 weeks postoperatively in the 3 groups |
A组存活兔中6只食管黏膜光滑,未见明显炎症反应,2只出现条状红斑,4只出现条状红斑伴融合,另外1只黏膜白色溃疡及瘢痕。B组造模成功8只,1只出现数个细小红点,5只出现片状红斑及糜烂,2只呈全周性糜烂伴融合;C组中5只食管黏膜正常,3只出现了黏膜数个充血点及条带,4只出现局部黏膜糜烂,但未扩散食管全周,且无明显缺损,2只为全周性红肿,3组造模成功率几近相同(表 2),排除死亡兔后,B组中重度食管炎的发生率较高,但差异无统计学意义。
|
|
表 2 术后2周3组兔食管大体观察 Tab 2 Esophageal findings of rabbits under direct vision 2 weeks postoperatively in the 3 groups |
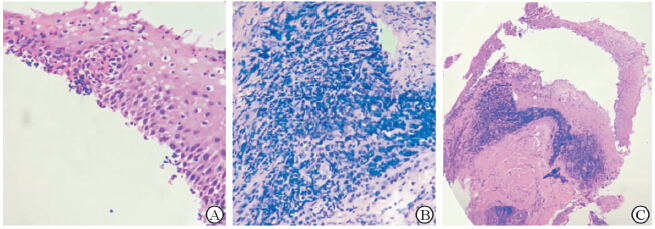
按照食管炎指数分级,A组存活兔中6只无明显食管炎表现,2只轻度损伤,3只中度损伤,2只重度损伤,重度损伤主要表现为部分鳞状上皮固缩、脱落,肌层纤维断裂;B组中仅1只食管黏膜正常,6只中度损伤,2只重度损伤,重度损伤主要表现为鳞状上皮广泛糜烂及融合,肌层纤维缺失;C组中5只食管黏膜无明显溃疡,2只轻度损伤,4只中度损伤,另外3只重度损伤,重度损伤主要表现为黏膜组织大量炎症细胞浸润(图 3),肌纤维细胞增厚及细胞膨胀,部分肌纤维断裂。光镜下,3组兔整体及存活兔食管炎指数差异无统计学意义(表 3)。
|
图 3 兔建模后光镜下的食管黏膜组织 Fig 3 Esophageal mucosa tissue of rabbit gastroesophageal reflux model under microscope A:Mucous membrane layer under high magnification view; B:Muscularis mucosa layer under high magnification view; C:Mucous membrane layer and muscularis mucosa layer under low magnification view. Original magnification: ×200 (A,B),×80 (C) |
胃食管反流病的发病机制可概括地分为两种:(1)胃食管括约肌松弛引起的抗反流屏障薄弱;(2)胃排空障碍引起的胃内压增高。根据两种发病机制,目前已建立多种反流性食管炎的动物模型。其中以前者为理论依据建立动物模型的方法主要有贲门括约肌切开术[2, 3]、贲门括约肌部分切除术[4]。从本研究结果看,贲门括约肌部分切除术造模成功率较高,但其安全性较差。该术式切除胃食管交界区前1/2的平滑肌,不仅消除了下端食管抗胃酸反流的高压带,还切断了括约肌与胃的悬带纤维,钝化His角,最大限度破坏了胃食管交界区的抗反流解剖结构。但括约肌缺损部分组织张力较大,强度减弱且血供较差,术中及术后增加胃食管穿孔及感染的风险。贲门括约肌切开术是最常用的建模手术之一,其将括约肌纵行切开,对括约肌损伤较小,虽安全性高,但造模成功率较低,目前国内外单纯使用贲门括约肌切开方法建立模型的研究相对较少,多采用贲门括约肌切开联合幽门缩窄法建立模型[6, 7]。
|
|
表 3 术后2周3组兔食管光镜下观察 Tab 3 Esophageal findings of rabbits under microscope 2 weeks postoperatively in the 3 groups |
球囊扩张法理论来源于贲门失弛缓的治疗原理,通过球囊机械扩张,使部分括约肌肌纤维拉长甚至断裂,造成LES松弛。其优势在于不必锐性切开贲门括约肌,降低了手术操作失误引起的食管穿孔及狭窄的风险,安全性较高,同时球囊扩张使食管壁全周受力均匀,若扩张强度适度,H-E染色后可见食管壁肌层四周多处肌纤维损伤,建模效果较好。但扩张强度较难把握,强度不够建模效果不理想,若强度过高则导致穿孔。前期有研究[8]采用专用气囊(Cre Wireguided,美国Boston Scientific公司)制备GERD动物模型,而本研究利用临床更常用的Forley导尿管,实验取材更方便,建模效果也较理想。
由于本研究首次提出使用Forley导尿管行球囊扩张术,操作经验不足,故采用直视下观察和评估食管扩张程度,以寻找最合适的扩张强度。通过实验中的观察和体会,总结以下经验,(1)扩张强度:扩张球囊的注射速度需缓慢均匀,扩张至食管呈半透明状即可,扩张的球囊通过变薄的浆膜层、黏膜下层及黏膜层隐约可见,此时部分肌纤维已被扩张断裂。由于不同兔食管壁厚度不同,因此承受的张力也不尽相同,管壁较薄的只需注入5 mL即可呈半透明状,而管壁较厚的则需10 mL,因此扩张强度应根据食管粗细而定。直视肉眼观察可降低因扩张过度导致食管穿孔的风险。(2)固定球囊:球囊扩张LES时需维持数分钟,但在维持过程中光滑的球囊常会随食管及胃的蠕动波滑入胃腔,使扩张效果大打折扣。因此可采用无菌手套取材自制的橡皮筋固定在LES上下两端,球囊扩张时以橡皮筋固定球囊位置,保证球囊不会下滑。(3)持续时间:有时单次扩张效果不佳,最好每次持续3~5 min,重复2~3次,确保肌纤维断裂。简而言之,球囊扩张需定位准确、缓慢加压及反复扩张。
胃食管反流病的内镜治疗主要是胃底折叠术,目的是纠正LES松弛、提高LES压力,目前在临床广泛开展,但胃底折叠术手术方式很多,且不同术式的安全性及疗效评价尚存有争议[9, 10]。此外,新型治疗方式如食管括约肌电刺激疗法[11]及磁场感应疗法[12]正处于研究中。因此,需要探讨一些既不改变解剖结构,又符合LES松弛发病机制的动物模型。通过对比目前较为常见的3种LES松弛动物模型制备方法,球囊扩张术更符合生理解剖结构及发病机制,保留了完整的胃食管交界区,且安全性及有效性均较高,适合作为内镜治疗及其他新型治疗方法的基础研究。
| [1] | El-Serag H B, Sweet S, Winchester C C, Dent J. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review[J]. Gut, 2014, 63:871-880. |
| [2] | McMahon R L, Ali A, Chenkan E G, Clary E M, Garcia-Oria M J, Fina M C, et al. A canine model of gastroesophageal reflux disease (GERD)[J]. Surg Endosc, 2002, 16: 67-74. |
| [3] | Elton C, Uppal R, Moore D, Goldspink G, Winslet M. Partial cardiomyectomy-an animal model of gastroesophageal reflux[J]. Int J Surg Investig, 1999, 1: 81-85. |
| [4] | Terzioglu T,Yalti T,Tezelman S,Unal S. Gastroesophageal reflux and a comparison of the different antireflux procedures following esophagomyotomy: an experimental study in rabbits[J]. Surg Today, 1998, 28:816-821. |
| [5] | 中华医学会消化内镜学分会. 反流性食管炎诊断及治疗指南[J].中华消化内镜杂志, 2004, 21:221-222. |
| [6] | Hu Y, Xu X, Xu L, Lai C, Zhang T. Dilated intercellular space in the larynx and esophagus of a rabbit reflux model[J].Auris Nasus Larynx,2013,40:379-382. |
| [7] | 许树长,戴 军,胡运彪, 莫剑忠,施 尧,陈锡美,等.实验性酸性反流性食管炎动物模型制备的研究[J].中华消化杂志, 1999, 19:208-209. |
| [8] | 廖 旭,宋 洋,朱惠明.应用食管气囊扩张法建立胃食管反流病动物模型研究[J].胃肠病学和肝病学杂志, 2009, 18:257-260. |
| [9] | Booth M I, Stratford J, Jones L, Dehn T C. Randomized clinical trial of laparoscopic total (Nissen) versus posterior partial (Toupet) fundoplication for gastro-oesophageal reflux disease based on preoperative oesophageal manometry[J]. Br J Surg,2008,95:57-63. |
| [10] | Rantanen T K, Salo J A, Salminen J T, Kellokumpu I H. Functional outcome after laparoscopic or open Nissen fundoplication: a follow-up study[J]. Arch Surg, 1999, 134: 240-244. |
| [11] | Rinsma N F, Bouvy N D, Masclee A A, Conchillo J M. Electrical stimulation therapy for gastroesophageal reflux disease[J].J Neurogastroenterol Motil, 2014, 20: 287-293. |
| [12] | Harnsberger C R, Broderick R C, Fuchs H F, Berducci M, Beck C, Gallo A, et al. Magnetic lower esophageal sphincter augmentation device removal[J].Surg Endosc,2015,29:984-986. |
 2015, Vol. 36
2015, Vol. 36


