2. 第二军医大学基础医学部生理学教研室, 上海 200433;
3. 第二军医大学长海医院脑血管病中心, 上海 200433
2. Department of Physiology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China;
3. Stroke Center, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
血管性认知障碍(vascular cognitive impairment,VCI)[1]是指由高血压病、糖尿病等各种脑血管危险因素或脑血管病本身导致的认知功能损害,包括轻度认知功能损害(mild cognitive impairment,MCI)到痴呆的一组临床综合征[2]。VCI病因多样,发病机制各异,但是皮质下梗死、脑白质变性或二者同时存在引起的VCI最为常见,占全部VCI患者的50%~76%[3]。
以往病因研究多重视VCI的小血管病病因[4],较少关注颅内大动脉损害,然而针对小血管病变的预防缺乏有效的手段,VCI的发病率居高不下。随着神经影像学的发展,颅内大动脉病变的评估手段有了很大的进步,但目前尚未见VCI与颅内大动脉病变相关性的报道。本研究拟通过皮质下梗死伴与不伴认知障碍的两组患者,分析比较皮质下梗死伴VCI患者的颅内血管病变情况,为VCI的预防和早期诊断提供依据。 1 资料和方法 1.1 研究对象
连续入组2012年12月至2014年2月第二军医大学长海医院脑血管病中心皮质下脑梗死患者。根据中华医学会神经病学分会痴呆与认知障碍学组写作组2011年制定的《血管性认知障碍诊治指南》[5]标准,经过入组标准与排除标准,将患者分为VCI组(49例)与不伴认知障碍的皮质下梗死组(NVCI组,42例)。
VCI组入组标准:符合《血管性认知障碍诊治指南》推荐标准;患者或家属知情同意。NVCI组入组标准:患者无认知障碍主诉或知情者报告无认知损害;客观检查不存在认知损害的证据;采用北京版蒙特利尔认知评估(Montreal Cognitive Assessment,MoCA)量表评估为无认知损害;患者或家属知情同意。
排除标准:有其他可能影响认知或意识状态的脑部疾病(如出血性脑血管疾病、炎性脑病、脑积水、阿尔茨海默病或其他类型的痴呆、颅脑创伤、神经脱髓鞘疾病等其他神经系统疾病);有妨碍评估正常进行的严重神经功能障碍(如意识障碍、严重视听障碍、失语、 失用、严重肢体功能障碍等);有可能影响认知的全身性疾病或异常(如恶性肿瘤、精神疾病、自身免疫性疾病、物质依赖或中毒史、长期使用精神活性物质等);体内有金属、电子或磁性植入物等不能行MRI检查者。 1.2 资料采集 1.2.1 一般资料
收集病史以及体格检查、神经系统体检、实验室检查结果。 1.2.2 认知评估
认知障碍采用MoCA进行评估,截断值采用Guo等[6]对上海市神经内科记忆门诊调查结果划定认知损害的临界值:受教育时间5~8年者,21分;受教育时间9~12年,22分;受教育时间大于12年,23分。高于相应分组的患者认为无认知损害。以上任务均由两位具有心理测量师资格的神经内科医生以及1名精神医学专业研究生同时测评。 1.2.3 神经影像学评估
头颅血管狭窄主要采用头颅CT血管造影(computed tomography angiography,CTA)或磁共振血管造影(magnetic resonance angiography,MRA)检查。头颅MRA为3.0 T GE HDxt MR仪检测。头颅CTA采用东芝Aquillion One 320排容积CT机检查。根据头颅MRA或CTA结果,动脉血管狭窄程度测量方法参照华法林-阿司匹林治疗症状性颅内动脉狭窄研究WASID(Warfarin-Aspirin Symptomatic Intracranial Disease)方法[7]的标准测量:测量血管狭窄远端正常动脉、狭窄段、狭窄近端直径及狭窄血管的长度。狭窄处远端正常动脉狭窄率(%)=(1-狭窄处直径/狭窄远端正常直径)×100%。血管狭窄程度分为:狭窄率小于50%,轻度;50%~70%,中度;狭窄率70%~99%,重度;100%,闭塞[8]。
高分辨率MRI对颅内血管管壁成像评估:全部评估选择3.0 T GE HDxt MR机,采用GE 8通道头部线圈,扫描范围包括颅底到胼胝体层面。具体步骤如下:首先对患者进行DWI评估,以评估缺血性病灶大小及梗死程度;然后对责任血管进行MRA检查,评估血管狭窄程度。根据3D-TOF MRA的结果对狭窄血管进行定位,对患者目标血管(即大脑中动脉M1段)由内至外依次采用12层(层厚2 mm,层间距0.5 mm)垂直于血管长轴评估血管壁。扫描序列包括:STIR、T1WI、T2WI及T1WI+C,具体扫描参数见表 1。整个成像过程时间约为30~40 min。
|
|
表 1 MRI各序列的扫描参数 Tab 1 Imaging parameters for multi-sequence 3.0 Tesla HR-MRI scan |
采用SPSS 18.0进行数据处理。计量资料采用x±s表示,两样本比较采用t检验,三样本比较用单因素方差分析;计数资料采用百分率表示,组间比较采用χ2检验。血管狭窄程度或数目与MoCA评分如符合正态分布,则应用直线相关分析,如不符合正态分布,则应用Spearman秩相关分析。检验水准(α)为0.05。 2 结 果 2.1 两组患者一般情况比较
根据前述VCI诊断标准和排除标准,共49例VCI患者纳入研究(VCI组),其中男性33例,女性16例,年龄44~85岁,平均年龄(68.43±10.56)岁,教育程度(10.02±3.33)年。NVCI患者42例,其中女性17例,男性25例,年龄(63.90±10.56)岁,平均教育时间(10.51±3.39)年。两组在受教育程度、年龄、性别分布差异均无统计学意义。 2.2 两组患者的病因TOAST分型
VCI组患者TOAST分型如下:大动脉粥样硬化型24例(48.98%),小血管闭塞型19例(38.78%),心源性1例(2.04%),其他原因2例(4.08%),原因不明3例(6.12%);NVCI相应分型分别为:22例(52.38%)、14例(33.33%)、0例(0%)、2例(4.76%)、4例(9.52%)。两组患者均多见大动脉粥样硬化型(LAA),病因学分布差异无统计学意义。 2.3 VCI与NVCI患者脑血管评估结果
VCI患者检测发现血管狭窄患者37例,不同程度狭窄血管共101支,狭窄血管涉及到双侧锁骨下、颈总动脉、颈内动脉、大脑前、大脑中、大脑后动脉、椎动脉以及基底动脉等血管。按颅内外不同部位可知,颅内和颅外狭窄血管分别为76支和25支,分别占75.25%和24.75%。根据不同狭窄程度可知,轻、中、重和闭塞血管分别为59、26、8、8支,分别占58.42%、25.74%、7.92%、7.92%。前循环和后循环狭窄血管分别为56支和45支。单一血管病患者9例,占18.37%;多血管病变患者28例,占57.14%(表 2)。
NVCI组患者血管狭窄34例(80.95%),涉及75支血管狭窄,颅内血管病变45支,占60%,其中大脑中动脉23支(30.67%);单一血管病患者19例,占26.19%,多血管病变患者15例,占54.76%(表 3)。与NVCI组相比,VCI患者多发颅内动脉狭窄者更多见,且两组差异具有统计学意义(χ2=4.166,P<0.05)。
|
|
表 2 VCI患者脑血管狭窄分布情况 Tab 2 Distribution of stenosis vessels in vascular cognitive impairment patients |
|
|
表 3 NVCI患者脑血管狭窄分布情况 Tab 3 Distribution of stenosis vessels in non-vascular cognitive impairment patients |
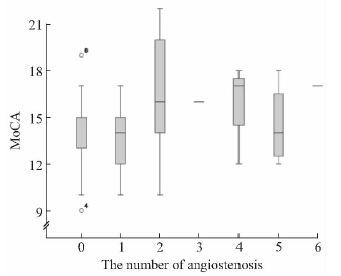
统计每例患者颅内血管狭窄数目,分别为0~6支,平均(1.51±1.67)支。因血管狭窄数目不符合正态分布,故采用Spearman秩相关(r=-0.283,P<0.05;图 1)。结果说明:VCI患者认知损害程度与颅内血管狭窄数目有关。
|
图 1 血管性认知障碍组认知损害(MoCA评分)与脑供血动脉狭窄数目的相关性分析 Fig 1 Correlation analysis of MoCA score of VCI patients with the number of stenosis cerebral vessels MoCA: Montreal cognitive assessment; VCI: Vascular cognitive impairment |
VCI患者认知障碍与颅内动脉狭窄程度的相关性。根据血管狭窄程度对45例患者颅内血管进行分级,0:无狭窄;1:轻度狭窄;2:中度狭窄;3:重度狭窄;4:闭塞。相关分析显示,患者认知损害与VCI患者血管狭窄程度无统计学意义(r=-0.046,P>0.05)。
为进一步评估狭窄处斑块性质与稳定性,随机选择脑血管不同狭窄程度的患者进行了管壁成像检查,包括1例基底动脉管壁成像检查,4例大脑中动脉管壁成像检查。共完成7支大脑中动脉、2支椎动脉和1支基底动脉检测,其中轻度狭窄血管4支,中度狭窄血管2支,闭塞3支。在这9支狭窄的血管中,发现斑块6处,其中4处斑块存在T1+C相强化,提示斑块不稳定,占狭窄血管斑块的66.67%。具体结果如表 4。
|
|
表 4 颅内血管管壁成像结果 Tab 4 Intracranial vascular wall imaging results at 3.0 T high-resolution magnetic resonance imaging |
VCI是一组存在不同程度认知功能损害的临床综合征,皮质梗死以相应的脑区功能受损引起的认知缺损为主要表现,皮质下梗死和脑白质变性以额叶-皮质下环路损害为主要特征,主要损害患者的执行功能,表现为抽象思维、概念形成和转换、信息处理速度等认知领域的损害,为最常见的VCI类型[9, 10]。
在VCI的发病机制方面,国外有研究认为颅内小血管病变为VCI最主要的发病机制,约为50%,而大血管病变约占21.4%[11]。在本研究中,VCI患者TOAST分型中大动脉粥样硬化型占48.98%,为最主要的病因分型。关于脑供血大动脉粥样硬化,不同人种具有不同的好发部位,白种人常见颅外颈总动脉段(33%)[12],而Wang等[13]最近报道,华人最常见的脑供血动脉硬化为颅内大动脉(46.6%),因此,与欧美白色人种不同,中国等亚洲人群主要的卒中亚型是颅内动脉狭窄[14]。近年来,韩国的一项研究表明,颅内大动脉硬化是导致脑白质变性的最重要的因素[15]。 2014年Park等[16]对679例韩国卒中患者的研究发现,颅内动脉硬化是韩国卒中患者白质变性进展的独立危险因素。造成东西方VCI病因不同的原因也可能与入组筛选方式、有无颅内血管检测评估等有关。一些相关研究如SPS3等往往采用腔隙性脑梗死的标准,将患者神经影像学入组标准定义为磁共振卒中病灶直径小于2 cm作为入选标准,这样一方面VCI研究结果会产生选择偏倚,造成小血管闭塞型所占VCI比例被夸大;另一方面缺少血管狭窄程度和斑块评估,一部分患者病灶小于2 cm,但并非是小动脉闭塞引起,也可能是大动脉斑块延展导致[17, 18, 19]。
在我们的研究中,VCI患者半数以上具有颅内动脉狭窄的影像学表现,其中,大脑中动脉系统病变是最主要的血管病变类型。经过抽样行管壁成像检测,发现大脑中动脉斑块以不稳定斑块为主。因此,颅内大血管(如MCA)斑块延展或动脉到动脉栓塞引起的小动脉闭塞可能是VCI真正多见的病因。小血管事件可能只是继发于颅内大动脉狭窄的一个现象。
本研究提示,造成大动脉粥样硬化的危险因素在国人仍然是VCI的重要原因,而颅内大动脉斑块稳定性可能是VCI发生和发展的重要环节。因此,早期干预颅内大动脉狭窄,并研究颅内大动脉斑块的特征及利于斑块稳定性的治疗,对国人VCI的防治非常重要。下一步我们将通过脑灌注与大样本的管壁成像检测,来阐明大动脉硬化对VCI的影响。
| [1] | Jellinger K A. Pathology and pathogenesis of vascular cognitive impairmenta critical update[J]. Front Aging Neurosci, 2013,5:17. |
| [2] | Johnston S C,Mendis S,Mathers C D.Global variation in stroke burden and mortality: estimates from monitoring, surveillance, and modeling[J].Lancet Neurol, 2009,8:345-354. |
| [3] | Moorhouse P,Rockwood K.Vascular cognitive impairment: current concepts and clinical developments[J].Lancet Neurol,2008,7:246-255. |
| [4] | Iadecola C.The pathobiology of vascular dementia[J].Neuron, 2013, 80:844-866. |
| [5] | 陈晓春,丁新生,高 晶,郭启浩,韩 璎,黄 丽,等. 血管性认知障碍诊治指南[J].中华神经科杂志,2011,44:142-147. |
| [6] | Guo Q H,Cao X Y,Zhou Y, Zhao Q H, Ding D, Hong Z. Application study of quick cognitive screening test in identifying mild cognitive impairment[J].Neurosci Bull,2010,26:47-54. |
| [7] | North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J].N Engl J Med, 1991,325:445-453. |
| [8] | Huang J, Degnan A J, Liu Q, Teng Z, Yue C S, Gillard J H, et al. Comparison of NASCET and WASID criteria for the measurement of intracranial stenosis using digital subtraction and computed tomography angiography of the middle cerebral artery[J].J Neuroradiol, 2012,39:342-345. |
| [9] | O’Brien J T, Erkinjuntti T, Reisberg B, Roman G, Sawada T, Pantoni L, et al.Vascular cognitive impairment[J].Lancet Neurol, 2003,2:89-98. |
| [10] | Sachdev P S, Brodaty H, Valenzuela M J, Lorentz L, Looi J C, Wen W, et al.The neuropsychological profile of vascular cognitive impairment in stroke and TIA patients[J].Neurology,2004,62:912-919. |
| [11] | Dong Y,Sharma V K, Chan B P, Venketasubramanian N, Teoh H L, Seet R C, et al.The Montreal Cognitive Assessment (MoCA) is superior to the Mini-Mental State Examination (MMSE) for the detection of vascular cognitive impairment after acute stroke[J].J Neurol Sci, 2010, 299(1-2):15-18. |
| [12] | Wityk R J, Lehman D, Klag M, Coresh J, Ahn H, Litt B. Race and sex differences in the distribution of cerebral atherosclerosis[J].Stroke, 1996,27:1974-1980. |
| [13] | Wang Y, Zhao X, Liu L, Soo Y O, Pu Y, Pan Y, et al.Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China: the Chinese Intracranial Atherosclerosis (CICAS) Study[J]. Stroke, 2014,45:663-669. |
| [14] | De Silva D A, Woon F P, Chen C P, Chang H M, Wong M C. South Asian patients with ischemic stroke: intracranial large arteries are the predominant site of disease[J].Stroke, 2007,38:2592-2594. |
| [15] | Lee S J, Kim J S, Chung S W, Kim B S, Ahn K J, Lee K S. White matter hyperintensities (WMH) are associated with intracranial atherosclerosis rather than extracranial atherosclerosis[J].Arch Gerontol Geriatr,2011,53:e129-e132. |
| [16] | Park J H, Kwon H M, Lee J, Kim D S, Ovbiagele B. Association of intracranial atherosclerotic stenosis with severity of white matter hyperintensities[J]. Eur J Neurol, 2015,22:44-52, e2-e3. |
| [17] | SPS3 Investigators, Benavente O R, Hart R G, McClure L A, Szychowski J M, Coffey C S, et al. Effects of clopidogrel added to aspirin in patients with recent lacunar stroke[J].N Engl J Med, 2012,367:817-825. |
| [18] | Jacova C, Pearce L A, Costello R, McClure L A, Holliday S L, Hart R G, et al. Cognitive impairment in lacunar strokes: the SPS3 trial[J].Ann Neurol, 2012,72:351-362. |
| [19] | Nah H W, Kang D W, Kwon S U, Kim J S. Diversity of single small subcortical infarctions according to infarct location and parent artery disease: analysis of indicators for small vessel disease and atherosclerosis[J].Stroke, 2010,41:2822-2827. |
 2015, Vol. 36
2015, Vol. 36


