2. 西安医学院第一附属医院药剂科, 西安 710077;
3. 陕西省人民医院药剂科, 西安 710068
2. Department of Pharmacy, The First Affiliated Hospital of Xi'an Medical University, Xi'an 710077, Shaanxi, China;
3. Department of Pharmacy, The People's Hospital of Shaanxi Province, Xi'an 710068, Shaanxi, China
丹红注射液由丹参和红花组成,是拥有自主知识产权的中药复方制剂[1, 2],具有活血化瘀、通脉舒络功效,用于瘀血闭阻所致的冠心病、心绞痛、心肌梗死等疾病[3, 4, 5, 6]。丹参素(DSS)、原儿茶酸(PA)是丹参的主要酚酸类成分,具有保护缺血心肌、改善缺血再灌注损伤、抗炎等作用[7, 8],红花的主要有效成分羟基红花黄色素A(HSYA)可抑制血小板激活因子诱发的血小板聚集与释放,竞争性抑制血小板激活因子与血小板受体的结合[9, 10]。它们都是丹红注射液中的主要药效成分。
由于复方制剂组成复杂、成分多样等特点,近年来关于DSS、PA和HSYA的单一成分或配伍在不同方剂中的含量测定[11, 12]以及在大鼠体内的药代动力学已有报道[13, 14, 15, 16, 17],但同时对丹红注射液中这3种成分在寒凝血瘀证中的药代动力学研究未见报道。本研究采用HPLC法探讨丹红注射液中这3种主要成分在正常大鼠和寒凝血瘀大鼠中的药代动力学特征,为临床合理用药提供实验依据。 1 材料 1.1 仪器
Agilent 1100 series高效液相色谱-DAD检测器系统(安捷伦科技有限公司,美国);Agilent TC-C18色谱柱(安捷伦科技有限公司,美国);TGL-16G高速离心机(上海安亭科学仪器公司);KQ5200DE型数控超声波清洗仪(昆山市超声仪器有限公司);XS105 Dual Range 十万分之一天平(瑞士METTLER-TOLEDO公司)。 1.2 药品及试剂
丹红注射液(菏泽步长制药有限公司,批号:100627);丹参素、原儿茶酸及羟基红花黄色素A标准品(中国食品药品检定研究院,批号分别为:110855-200506,101800-200205,111637-200905);色谱纯甲醇(美国Fisher公司);肝素钠注射液(河北常山生化药业有限公司,批号:100109);自制超纯蒸馏水;其他试剂均为分析纯。 1.3 实验动物
SPF级雄性SD大鼠,购自西安交通大学实验动物中心,合格证号:陕医动证字2006105,5个月龄,体质量200~230 g。 2 方法和结果 2.1 标准品的配制
分别精密称取DSS、PA、HSYA标准品各15.00 mg,用甲醇在5 mL避光容量瓶中定容,配成质量浓度为3.00 mg/mL的混合对照品母液,-20℃冷冻备用。 2.2 模型的建立
大鼠放入0℃的冰水中刺激5 min,每天2次,持续20 d,建立寒凝血瘀证模型[18],并检测血液流变学相关指标,如表 1所示,与正常组对比各指标差异均有统计学意义,表明模型制作成功。
|
|
表 1 寒凝血瘀大鼠血液流变学指标 Tab 1 Blood rheology indices of cold-coagulation and blood-stasis rats |
取正常和造模成功的SD大鼠各6只,分别为正常组和模型组。禁食12 h,自由饮水,各组均按10 mL/kg的剂量单次尾静脉注射丹红注射液,给药后分别于2、5、10、15、20、25、30、40、50、60、90 min眼底静脉丛取血0.3 mL,置于肝素化离心管中,4 568×g离心10 min,分离血浆,于-20℃冻存。每次取血后补充等量的生理盐水。 2.4 血样处理方法
取2.3项下血浆100 μL,加入3倍量乙腈沉淀蛋白,涡旋1 min后,8 121 ×g离心10 min,取出上清液,沉淀反复处理3次,合并上清液,氮气吹干,残渣用100 μL甲醇水(甲醇∶0.2%甲酸水=20∶80)超声溶解,用0.45 μm有机滤膜过滤,于24 h内进样分析。 2.5 色谱条件
Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm);流动相:0.2 %甲酸水(A)-甲醇(B)组成,梯度洗脱(0~18 min,8%B→13%B;18~38 min,13% B→22%B;38~60 min,22%B→60%B);检测波长:280 nm(0~40 min),402 nm(40~60 min);柱温:25℃;流速:0.6 mL/min;进样量:20 μL。 2.6 数据处理
运用SPSS 2.0软件和t检验对实验结果进行统计分析,所得数据均以x±s表示,药代动力学参数用DAS 3.0 软件处理分析。 2.7 方法学考察
分别将空白血浆、空白血浆加对照品以及给药后血浆样品进样20 μL,在2.5项色谱条件下检测,色谱图如图 1所示。结果显示,血浆中的内源性物质与DSS、PA和HSYA分离良好,无干扰,且基线较平稳,噪音小。
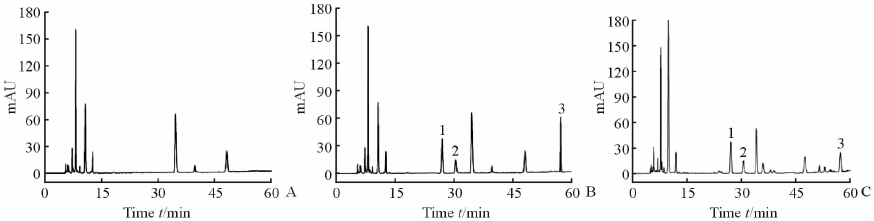
|
图 1 血浆样品的色谱图 Fig 1 HPLC chromatograms of plasma samples A:Blank plasma; B:Blank plasma spiked with standard; C: Plasma sample after injection of Danhong Injection. 1: Danshensu (DSS); 2: Protocatechuic acid (PA); 3: Hydroxysafflor yellow A (HSYA) |
DSS、PA及HSYA的检测限分别为0.07、0.35、0.10 mg/L(S/N=3),定量限分别为0.17、0.89、0.19 mg/L(S/N=10)。 2.7.2 线性关系
用一定量的空白血浆将DSS、PA和HSYA的混合对照品溶液稀释成浓度分别为1.00、2.00、5.00、25.00、125.00、375.00、750.00 mg/L的系列空白血浆加对照品溶液,在2.5项色谱条件下进样分析,分别以浓度(X,mg/L)为横坐标,以峰面积(Y)为纵坐标,采取加权(W=1/X2)最小二乘法计算回归曲线[19],得到DSS、PA和HSYA的线性方程(n=6)分别为:Y=2.38X+20.40,r=0.999 2;Y=17.46X+37.87,r=0.999 8;Y=10.32X+35.91,r=0.999 0。这表明3种成分在1.00~750.00 mg/L范围内具有良好的线性关系。 2.7.3 回收率和精密度
在标准曲线范围内选择高、中、低 3 个浓度,以空白血浆配制成混合对照品的相应血浆样品,每个浓度5份;同时配制相同浓度以流动相为基质的对照品溶液。标准血浆样品在经考察的样品稳定期内,按照2.4项下方法处理后进样测定,对照品溶液直接进样分析。对照品血浆测定值和对照品溶液测定值之比为提取回收率,结果见表 2。将上述 3 个浓度的样品在 1 d 内不同时间重复测定5次和 5 d 内每天测定1次,分别计算日内、日间精密度,结果见表 2。
|
|
表 2 DSS、PA及HSYA回收率和精密度结果 Tab 2 Recoveries and precisions of DSS,PA and HSYA in plasma |
精密吸取100 μL空白血浆,加入DSS、PA及HSYA混合标准品适量,将样品置于室温0、4、8、12、18、24 h后分别进样分析,观察温度对样品的影响。结果表明,DSS、PA及HSYA的短期稳定性RSD分别为1.90%、2.67%和2.43%,表明在血样中这3种物质在24 h内基本稳定。 2.8.2 长期稳定性
给空白血浆添加适量DSS、PA及HSYA混合标准品,置于-20℃冷冻保存,分别于冻存1、2、4、8周后取出,置于室温下解冻,按2.4项血样制备方法处理后,在2.5项色谱条件下进样分析。结果表明,DSS、PA及HSYA的长期稳定性RSD分别为5.39%、4.13%和6.01%,表明在血样中这3种物质长期稳定性良好。 2.8.3 冻融稳定性
将-20℃条件下冷冻24 h的空白血浆加混合标准品取出,于室温下解冻,在2.5项色谱条件下进样分析。完全解冻后样品再次冷冻24 h,重复6次。结果表明,DSS、PA及HSYA的冻融稳定性RSD分别为2.19%、2.94%、3.40%,表明在血样中这3种物质的冻融稳定性良好。 2.9 药代动力学结果
处理后的血浆样品在拟定色谱条件下,进样20 μL,记录峰面积,计算其中DSS、PA及HSYA的含量。药-时曲线见图 2,药代动力学参数见表 3~表 5。
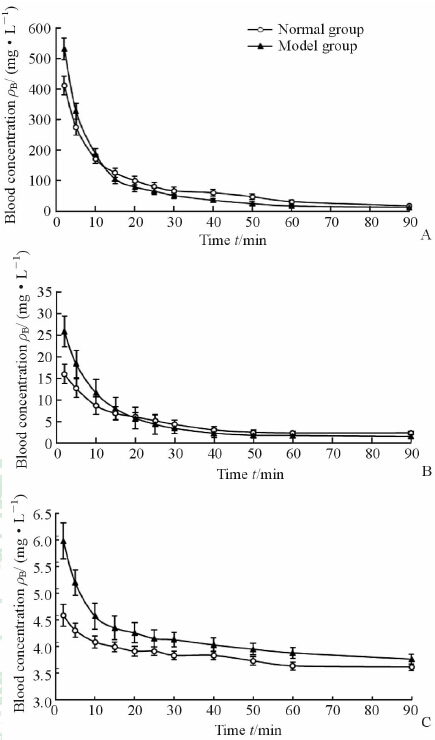
|
图 2 DSS、PA和HSYA在正常和模型大鼠体内的药-时曲线 Fig 2 Concentration-time curves of DSS,PA,and HSYA in normal and cold-coagulation and blood-stasis model rats A:Danshensu (DSS); B: Protocatechuic acid (PA); C: Hydroxysafflor yellow A (HSYA). n=6,x±s |
药代动力学参数显示,与正常组相比,在寒凝血瘀大鼠体内DSS的分布半衰期t1/2α(P<0.05)、总清除率CL(P<0.05)和达峰浓度Cmax(P<0.01)均增大,而药时曲线下面积AUC降低(P<0.01);PA的分布半衰期t1/2α降低(P<0.01),而消除半衰期t1/2β(P<0.05)、总表观分布容积V(P<0.01)、中央室分布容积V1(P<0.01)、药时曲线下面积AUC(P<0.01)和达峰浓度Cmax(P<0.01)均增大;HSYA的分布半衰期t1/2α和t1/2β降低(P<0.01),而消除半衰期t1/2γ(P<0.05)、药时曲线下面积AUC (P<0.01)、总表观分布容积V(P<0.01)、中央室分布容积V1(P<0.05)和达峰浓度Cmax(P<0.05)均增大,其他相关参数差异无统计学意义。
|
|
表 3 DSS在正常和模型大鼠体内的药代动力学参数拟合结果 Tab 3 Pharmacokinetic parameters of DSS in normal and cold-coagulation and blood-stasis model rats |
|
|
表 4 PA在正常和模型大鼠体内的药代动力学参数拟合结果 Tab 4 Pharmacokinetic parameters of PA in normal and cold-coagulation and blood-stasis model rats |
|
|
表 5 HSYA在正常和模型大鼠体内的药代动力学参数拟合结果 Tab 5 Pharmacokinetic parameters of HSYA in normal and cold-coagulation and blood-stasis model rats |
本研究对DSS、PA及HSYA的色谱条件进行了优化。考察了等度和梯度洗脱两种方式以及不同配比乙腈-水、甲醇-水、乙腈-0.2%甲酸水、甲醇-0.2%甲酸水等系统,由于DSS和PA的结构相似,且极性相近,等度洗脱很难将两者分开且无法排除内源性物质的干扰,故最终采用甲醇-0.2%甲酸水作为梯度洗脱系统。又因经全波长扫描后发现DSS和PA与HSYA的最大紫外吸收差别很大,最终DSS和PA选择最大吸收波长280 nm,HSYA选择402 nm,保证了检测灵敏度。在此条件下,该3种成分与血浆中的内源性物质和代谢产物实现良好的分离,基线平稳,目标色谱峰对称性良好。
药动学结果显示,DSS和PA在大鼠体内药动学过程均符合二室开放模型,这与文献报道结果一致[15]。而HSYA呈三室模型,与文献[20]报道的二室模型不一致,这可能是由于丹红注射液中其他成分的影响所致。DSS具有抗血栓形成、抗血小板聚集、降低血液黏稠度等活血化瘀作用[21]。寒凝血瘀模型大鼠DSS的t1/2α、Cmax和CL均增大,而AUC降低。这说明在寒凝血瘀病理模型下DSS在大鼠体内分布减慢,生物利用度降低,可能是由于在该血瘀模型下血液黏度增加,DSS主要作用于血液,影响了向其他组织的分布;又因清除速度加快,因而降低了生物利用度。PA具有降低心肌耗氧量、提高心肌耐氧能力、减慢心率等药理作用[22]。HSYA作为丹红注射液中主要指标性成分,具有活血化瘀作用,在寒凝血瘀模型大鼠中,PA和HSYA的分布半衰期t1/2α(t1/2α,t1/2β)降低,而t1/2β(t1/2γ)、V、V1和AUC均增大,提示可能由于寒凝血瘀病理环境的影响,使这2种成分在体内分布加快,消除减慢,表观分布容积增加,药物在体内分布广泛,所以生物利用度增加,能更有效地发挥药理作用。
与正常组相比,模型组血液中3种酚酸成分的达峰浓度Cmax都增加,说明在寒凝血瘀病理模型下,由于血液流动变慢,在静脉给药后首个取血点时药物进入其他组织的浓度降低。此外,发现不管在正常还是模型大鼠中,DSS的清除率都大于PA和HSYA,说明DSS的排出速率大于PA和HSYA,这可能与DSS的化学性质有关。
| [1] | 王小平,刘 峰,张 勤,韩 翠.正交试验法优化丹参总酮提取工艺[J]. 辽宁中医药大学学报,2010,12:133-134. |
| [2] | 易少凌,陈伶俐. 丹红注射液治疗血管性痴呆的系统性评价[J].中成药,2014,36:1164-1168. |
| [3] | 智晓文,苏显明,封卫毅,张红梅. 丹红注射液对大鼠离体肠系膜动脉血管环作用及机制[J].中国中药杂志,2012,37:2607-2609. |
| [4] | 杨丽君. 丹红注射液对急性冠脉综合征患者血浆内皮素的影响[J].现代中西医结合杂志,2010,19:51-52. |
| [5] | He Y, Wan H, Du Y, Bie X, Zhao T, Fu W, et al. Protective effect of Danhong injection on cerebral ischemia ischemia-reperfusion injury in rats[J]. J Ethnopharmacol, 2012, 144:387-394. |
| [6] | 韩永鹏,安 芸.丹红注射液对大鼠脑缺血再灌注损伤的保护作用[J]. 药物评价研究,2010,33:388-390. |
| [7] | 李美娇,郭 虹,刘青青,景浩然,王少峡,柴丽娟. 丹红注射液对脑缺血缺氧损伤的保护作用[J].中国实验方剂学杂志,2013,19:206-208. |
| [8] | 赵艳威,杨 宣,董璨瑾,谢文利. 丹参素及原儿茶醛研究进展[J]. 武警医学院学报,2009,18:260-264. |
| [9] | 金 鸣,董宁宁,吴 伟,李金荣,臧宝霞,童 静. 羟基红花黄色素A缓解大鼠心肌细胞凋亡作用的研究[J]. 中草药,2009,40:924-930. |
| [10] | Wang C, Wang C, Ma Ci, Huang Q, Sun H, Zhang X,et al. Hydroxysafflor yellow A of Carthamus tinctorius attenuates lung injury of aged rats exposed to gasoline engine exhaust by down-regulating platelet activation[J].Phytomedicine,2014,21:199-206. |
| [11] | 马彬峡,陈恒冲,吴春高,赵怀清.RP-HPLC法同时测定乐脉颗粒中丹参素、原儿茶醛、芍药苷和阿魏酸的含量[J].药物分析杂志,2009,29:1122-1125. |
| [12] | 邹婕凡,周 萍,鲁翠香.HPLC法测定丹红注射液中羟基红花黄色素A的含量[J].现代医药卫生,2013,29:658-659. |
| [13] | 王 娟,马张庆,汪五三,洪宗元,宋建国.丹参素钠及丹参注射液在大鼠体内的药代动力学比较[J].中国中药杂志,2009,34:2943-2945. |
| [14] | 陈向梅,王晓雯,骆 晶,贾 璞,王雪艳,肖超妮,等.血必净注射液大鼠体内的药动学研究[J].药物分析杂志,2012,32:744-748. |
| [15] | 高志娟,桑 柏,梁杨静,王世祥,于 洁,郑晓晖. 香丹注射液中3种酚酸类成分在大鼠体内的药动学研究[J].中国中药杂志,2011,36:922-924. |
| [16] |
徐 宁,董娟妮,吴一振,陈向梅,夏 丽,彭莉蓉,等.苏木对羟基红花黄色素A在寒凝血瘀大鼠体内药代动力学的影响[J].第二军医大学学报,2013,34:458-461. Xu N, Dong J N, Wu Y Z, Chen X M, Xia L, Peng L R, et al. Effects of Sappan lignum on pharmacokinetics of hydroxysafflor yellow A from Carthami flos in rats with cold coagulation and blood stasis[J]. Acad J Sec Mil Med Univ,2013,34:458-461. |
| [17] | 王佩瑶,陈 曦,孟宪生,王 勇,梁琼麟,王义明,等.基于UPLC/TOF-MS的双龙方大鼠体内药代动力学研究[J].中成药,2011,33:1889-1894. |
| [18] | 曹振华,尹军祥,田金洲,李乐军,时 晶,王文洁,等. 源于冷刺激的血液与血管病理变化研究[J].北京中医药, 2009,28:308-311. |
| [19] | 商庆节,吴 玲,罗涟荣,胡海勋,姚景春.SPSS在生物分析测定过程中计算加权标准曲线的应用[J].数理医药学杂志,2013,26:356-357. |
| [20] | 骆 晶,王晓雯,杨凌鉴,陈向梅,王世祥,彭 宁,等. 甘草对红花中羟基红花黄色素 A 药代动力学的影响[J].中国药业,2012,21:12-14. |
| [21] | 付 婵,罗娟敏,王义明,梁琼麟,罗国安.多波长高效液相色谱法同时测定丹红注射液中7种成分含量[J].中国新药杂志,2012,21:2817-2820. |
| [22] | 蔡文涛,柳 力,陈 勇,韩凤梅.原儿茶酸在大鼠血浆中的药代动力学研究[J].湖北大学学报:自然科学版,2010,32:98-100. |
 2015, Vol. 36
2015, Vol. 36


