经典的颈椎前路减压椎间植骨融合术(anterior cervical discectomy and fusion,ACDF)中,包含三面皮质的自体髂骨是椎间植骨融合的金标准,但由于来源有限以及不可避免的供骨区并发症限制了其广泛应用[1]。现常用植骨替代物如聚醚乙酮(polyetheretherketone,PEEK)椎间融合器和钛网,存在弹性模量过大、容易沉降等缺点,且术后影像学检查存在伪影,干扰了术后影像诊断。理想的可吸收材料可以规避弹性模量差异和影像学伪影等缺陷,有学者尝试利用可吸收材料制作椎间融合器,并报道了良好的力学及动物实验结果[2, 3, 4]。部分产品应用于临床也取得了较好的融合率[5]。
随着三维(3D)打印技术的不断发展,其在医疗领域的应用方兴未艾,使患者在术前接受快速的评估并个体化制备植入物成为可能[6]。因此,本研究拟基于Mimics软件,利用3D打印成型技术,个体化设计颈椎间融合器,同时通过尸体标本研究,对该方法制作的融合器匹配性进行探讨。 1 材料和方法 1.1 标本制备及其排除标准
选用10具经甲醛浸泡的成人新鲜尸体标本,男性5具,女性5具,均为汉族,死亡年龄45~70岁,平均(52.4±6.8)岁,均由第二军医大学基础部解剖学教研室提供。完整截取标本的C1至C7节段作为实验对象,保留椎体骨性及周围软组织结构,所有标本均排除骨折、畸形或占位性病变。 1.2 个性化颈椎间融合器的设计和制作 1.2.1 设计数据的获取
由放射科医生协助获得全部10具尸体标本的全颈椎CT(Siemens 64排螺旋CT),连续扫描Dicom格式原始图像(层厚和扫描厚度均为0.5 mm)。 1.2.2 数据处理
所得CT数据直接导入Mimics 15版软件(Materialise,Leuven,Belgium),以180~3 071为分割值,用Thresholding工具将骨组织提取出来,利用Region growing工具行区域性增长,并保存为新蒙板;使用Edit Masks工具对蒙板图像进行操作,逐层分离出C5和C6的完整结构;使用Calculate 3D工具基于蒙板对C5椎体、C5/6间隙和C6椎体进行三维重建;使用Morphology operations工具对细小空洞进行填补,并平滑骨性结构表面。 1.2.3 参考椎体分离出椎间盘结构
由于椎间盘结构直接调节阈值比较难以观察和分割,以1.2.2 项下已建立的骨阈值和骨三维模型作为参考,并重复1.2.2项下相关步骤来分离椎间盘结构。 1.2.4 优化设计椎间盘结构
将1.2.2 项下椎体模型和1.2.3项下椎间盘模型一起以STL格式导出保存。在Solidworks(Solidworks公司)软件中设计1组穿孔用棒状阵列文件,以STL文件保存。将以上2组STL文件导入到Magics 13.0(Materialise)软件中,调整相互关系,让棒状阵列结构正好通过椎间盘垂直中央结构,使用Boolean功能中的减法运算,使椎间盘生成多孔结构。以STL格式保存以备3D打印机使用。 1.2.5 3D打印多孔结构人工椎间盘
将设计出的模型以STL格式传输至3D打印机(FDM-3000,Stratasys),使用聚乳酸为材料打印出个体化椎间融合器(图 1),打印精度为0.1 mm。

|
图 1 个体化3D打印椎间融合器 A:正面观;B:俯视图 |
定位C5/6椎间隙后,以尖刀切开前纵韧带和纤维环,刮勺刮出髓核组织直至后纵韧带,处理上下终板软骨至硬化骨,术中注意保留完整骨性结构。将个体化3D打印融合器植入C5/6椎间隙(图 2)。

|
图 2 个体化3D打印椎间融合器植入相应尸体椎间隙后的大体观 |
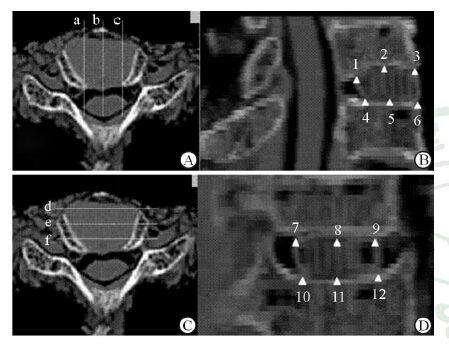
将接受ACDF手术后的尸体标本再次行CT平扫,并进行矢状位、冠状位和三维重建。矢状位上扫描融合器正中矢状位、左1/3和右1/3矢状位,然后在测量3个矢状位上扫描图上融合器上、下2个面前后两末端和中点与上下对应软骨终板表面的间距,测量18个点(图 3A、3B)。之后同法在冠状位上扫描融合器正中冠状面、前1/3和后1/3冠状面,并用相同方法测量融合器与上下对应软骨终板间的距离,同样测量18个点(图 3C、3D);冠状位和矢状位共计36个点。由于间距测量数据过小,不便于数据处理,因此记录时只按照优、良、差3个标准定义各观察点的匹配性:间距<1 mm,优; 1 mm≤间距<2 mm,良;间距≥2 mm,差。由2名脊柱外科医师各自独立完成数据测量,取平均值后进行优、良、差分组。
|
图 3 融合器植入尸体标本椎间隙后矢状位(A、B)及冠状面(C、D) CT扫描 a,b,c:右1/3矢状位、正中矢状位、左1/3矢状位的扫描位置;d,e,f:前1/3冠状面、正中冠状面和后1/3冠状面.1~3、4~6分别表示在3个矢状位CT图像上融合器上、下两个面前后两端和中点3个位置,是测量融合器与相应椎板距离的选取点;7~9、10~12表示在3个冠状位CT图像上融合器上、下两个面左右两端和中点3个位置 |
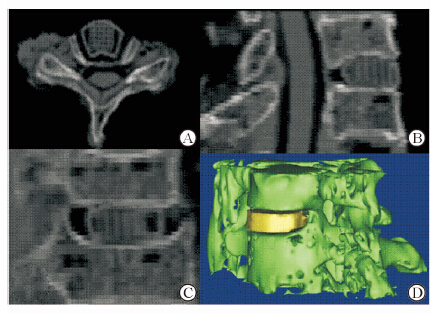
大体观察发现椎间融合器与椎间隙嵌合度较好,融合器植入后稳定,无融合器过大不能置入发生(图 2)。CT重建像在横截位、矢状位、冠状位及三维重建上与宿主椎间隙嵌合度良好(图 4)。融合器上下面在CT矢状位和冠状位上与对应椎间隙上下软骨终板间的匹配度测量结果示:6例标本(6/10)所有测量点匹配性均为优;3例标本(3/10)中14个点(3.89%,14/360)匹配性良,其中1例6个点、另2例各4个点匹配性良;1例标本(1/10)中共3个点(0.83%,3/360)匹配性差;共计343个点(95.28%,343/360)匹配性优。
|
图 4 3D打印的个性化椎间融合器植入尸体标本后CT扫描图 A: CT横截面重建像;B:CT矢状面重建像;C:CT冠状面重建像;D:CT三维重建像 |
植骨接触界面大小一直是影响骨愈合的重要因素,受限于设计和制造工艺,现临床使用的Cage均为楔形笼装结构。而颈椎终板为曲面装,Cage植入后依靠齿状边缘与终板形成嵌合,并不能与终板形成良好的贴服,影响了植骨接触界面,且点状接触使受力分散不均匀,术后容易出现Cage沉降[7]。3D打印是快速成型技术的一种,它是一种以数字模型文件为基础,运用粉末状金属或塑料等可粘合材料,通过逐层打印的方式来构造物体的技术,其数字化和快速成型的特点使其能根据宿主个体化要求定制相应形状和大小体内植入物。该技术的发展使得个体化制备与宿主终板匹配的Cage成为一种可能。
可吸收材料的发展为新的内植物研究提供了一种选择。理想的可吸收椎间融合器在刚植入时需有足够的硬度,随降解过程强度逐渐降低,载荷逐渐转移到宿主骨,这有利于新骨形成并导致确实的骨融合。最后,植入物完全吸收意味最终的生物学融合以及高质量术后MRI影像结果[8]。Debusscher等[5]将β-磷酸三钙(β-TCP)和聚左旋乳酸[poly(L-lactic acid),PLLA]制成的可吸收椎间融合器用于20例颈椎病患者中,结果疗效满意,融合率达到96%。然而,更多报道的可吸收椎间融合器在临床应用中结果并不满意。Frost等[9]发现PLDLLA(poly-L-lactide-co-D,L-lactide)融合器在人体内会出现明显骨溶解。Brenke等[10]同样将β-TCP和PLLA椎间融合器用于33例病患中,结果4例融合器脱出需要再次翻修,植入物脱出率超过10%。作者认为融合器外形设计以及力学强度欠佳是导致植入失败的主要原因。从报道文献来看,临床疗效不佳除了材料性能不能完全满足要求外,Cage外形设计也是失败的一大因素。因为临床实际中患者的椎体大小、椎间隙高度等均不相同,而现有的融合器设计都是制式制造,与实际临床中颈椎终板并不相匹配,不能满足患者个性化需要。总而言之,可吸收融合器有望解决许多金属及PEEK-Cage的弊端,但在临床应用中还有很多待改进之处。本研究主要探讨3D打印制备个体化颈椎间融合器的可行性并验证其终板匹配性及其优点。
利用Mimics软件对颈椎标本的CT平扫图像进行处理,进行个体化C5/6椎间融合器模型制作,通过3D打印机打印出椎间融合器。在对10具标本植入个体化Cage后,大体观察发现椎间融合器与椎间隙嵌合度较好,融合器植入后稳定性较好,无融合器过大不能置入发生,无融合器松动脱落。用18个点来描述每个植骨接触界面,其中12个位于边缘,6个点位于穹顶处,通过CT测量发现95.28%的观察点匹配性能优。1例标本出现3个点界面间隙大于2 mm,通过对比发现该具尸体标本骨质疏松明显,处理上终板时对后方终板有少许破坏。此外,尚有接近4%的点匹配性中等。该方法设计打印的Cage精度还有待进一步提高。
本研究不足之处包括:(1)标本数量相对较小。因为尸体标本来源有限,且价格昂贵,故本研究仅选取10例进行研究,必要时可进一步扩大样本量。(2)Cage与终板界面之间间隙都比较小,测量误差相对偏大,可能对结果造成干扰,这可通过重复测量和扩大样本量解决。
综上所述,通过Mimics软件可很好呈现颈椎椎体和椎间隙解剖结构,并可据此进行颈椎Cage的个体化设计;3D打印可实现颈椎Cage产品快速成型,且打印产品与宿主终板匹配满意,这为下一步术前产品设计提供了研究基础。
| [1] | Silber J S, Anderson D G, Daffner S D, Brislin B T, Leland J M, Hilibrand A S, et al.Donor site morbidity after anterior iliac crest bone harvest for single-level anterior cervical discectomy and fusion[J]. Spine, 2003, 28:134-139. |
| [2] | Slivka M A, Spenciner D B, Seim H B 3rd, Welch W C, Serhan H A, Turner A S. High rate of fusion in sheep cervical spines following anterior interbody surgery with absorbable and nonabsorbable implant devices[J]. Spine (Phila Pa 1976), 2006, 31:2772-2777. |
| [3] | Hojo Y, Kotani Y, Ito M, Abumi K, Kadosawa T, Shikinami Y, et al. A biomechanical and histological evaluation of a bioresorbable lumbar interbody fusion cage[J]. Biomaterials, 2005, 26:2643-2651. |
| [4] | Kandziora F, Pflugmacher R, Scholz M, Eindorf T, Schnake K J, Haas N P. Bioabsorbable interbody cages in a sheep cervical spine fusion model[J]. Spine (Phila Pa 1976), 2004, 29:1845-1855. |
| [5] | Debusscher F, Aunoble S, Alsawad Y, Clement D, Le Huec J C. Anterior cervical fusion with a bio-resorbable composite cage (beta TCP-PLLA): clinical and radiological results from a prospective study on 20 patients[J]. Eur Spine J, 2009, 18:1314-1320. |
| [6] | Schmauss D, Gerber N, Sodian R. Three-dimensional printing of models for surgical planning in patients with primary cardiac tumors[J]. J Thorac Cardiovasc Surg, 2013, 145:1407-1408. |
| [7] | Lee Y S, Kim Y B, Park S W. Risk factors for postoperative subsidence of single-level anterior cervical discectomy and fusion: the significance of the preoperative cervical alignment[J]. Spine (Phila Pa 1976), 2014, 39:1280-1287. |
| [8] | Robbins M M, Vaccaro A R, Madigan L. The use of bioabsorbable implants in spine surgery[J]. Neurosurg Focus, 2004, 16:E1. |
| [9] | Frost A, Bagouri E, Brown M, Jasani V. Osteolysis following resorbable poly-L-lactide-co-D, L-lactide PLIF cage use: a review of cases[J]. Eur Spine J, 2012, 21:449-454. |
| [10] | Brenke C, Kindling S, Scharf J, Schmieder K, Barth M. Short-term experience with a new absorbable composite cage (β-tricalcium phosphate-polylactic acid) in patients after stand-alone anterior cervical discectomy and fusion[J]. Spine (Phila Pa 1976), 2013, 38:E635-E640. |
 2015, Vol. 36
2015, Vol. 36


