2. 复旦大学附属华山医院北院临床药学室, 上海 201907;
3. 徐汇区中心医院药械科, 上海 200031
2. Clinical Pharmacy Laboratory, Huashan Hospital (North branch), Fudan University, Shanghai 201907, China;
3. Department of Pharmacy and Instrument, Central Hospital of Xuhui District, Shanghai 200031, China
△Co-first authors.
哮喘是以气道炎性细胞浸润、气道高反应性及气道重塑为主要特征的一种慢性炎症性疾病[1]。嗜酸粒细胞和T淋巴细胞在气道黏膜的浸润是哮喘最重要的组织病理学特征。调节活化正常T 细胞表达和分泌的趋化因子(regulated upon activation normal T cell expressed and secreted factor,RANTES)是趋化性细胞因子CC亚家族成员(CCL5)[2]。在炎性因子IL-1β或TNF-α的刺激下,气道组织可释放RANTES,对嗜酸性粒细胞和T淋巴细胞具有正向趋化作用,因而RANTES在哮喘中的作用引起了越来越多的关注[3]。近来研究表明,RANTES基因多态性是临床哮喘发生的危险因子之一[4]。
目前临床上治疗哮喘的药物主要包括β2受体激动剂和糖皮质激素。β2受体激动剂容易引发心血管不良反应,长期应用糖皮质激素可导致糖尿病、继发感染及骨质疏松等[5]。临床上迫切需要疗效确定、不良反应小的抗哮喘药物。人参(Panax ginseng C.A.Meyer)是五加科多年生草本植物,最近的研究证实,人参及其提取物能有效改善哮喘实验动物模型的症状,抑制炎症反应[6, 7, 8, 9, 10]。人参皂苷作为人参主要的药效成分,是其治疗哮喘的活性物质基础[9, 10]。其中,人参皂苷Compound K(CK)对炎症及免疫应答的调控作用成为研究热点[11]。CK属二醇型皂苷,它在天然的人参中几乎并不存在,主要来自其他二醇型人参皂苷在人肠道内的代谢产物[11]。Yang等[12, 13]运用糖皮质激素受体(GR)-配体竞争性结合实验以及GR转录激活实验发现,CK具有较强的GR结合活性和转录激活活性,可调节多种炎症因子的表达。因此,我们推测CK可能是人参治疗哮喘的主要活性成分之一。
本研究着重考察CK对炎症因子诱导人支气管上皮细胞BEAS-2B表达和分泌RANTES的影响,然后检测其对活化蛋白转录因子1(AP-1)和GR信号通路的影响,最后验证CK是否通过GR发挥其抑制RANTES分泌的效应,为后续研究奠定基础。 1 材料和方法 1.1 材料
人支气管上皮细胞株BEAS-2B购自ATCC。人参皂苷CK(纯度>97%)购自上海同田生物技术股份有限公司;DMEM、F12及胎牛血清(FBS)购自Gibco公司;Lipofectamine 2000、TNF-α及TRIzol试剂购自Invitrogen公司;Human RANTES ELISA Kit购自R&D Systems公司;pAP-1-Luc质粒及pGRE-Luc质粒来自Stratagene公司;RANTES抗体及β-actin抗体购自Santa Cruz公司;CCK-8 试剂盒购自上海碧云天生物技术有限公司;地塞米松(Dex)、米非司酮及二甲亚砜(DMSO)购自Sigma-Aldrich公司;Oligo (dT) Primer、M-MLV反转录酶、dNTP及Steady-Glo® Luciferase Assay system购自Promega公司;引物由生工生物工程(上海)股份有限公司合成。 1.2 人支气管细胞BEAS-2B的培养
将BEAS-2B细胞种于含有5%FBS、105 IU/L青霉素、105 IU/L链霉素的DMEM/F12培养液中,于37℃、5%CO2的培养箱中培养。BEAS-2B细胞生长到80%~90%融合后,培养液换成不含FBS的DMEM/F12,饥饿24 h。加入TNF-α(终浓度25 ng/mL)1 h,向细胞中添加Dex、CK和(或)米非司酮,继续培养24 h。 1.3 RANTES酶联免疫检测
收集BEAS-2B细胞上清液,按照RANTES ELISA Kit说明书进行测定。最后反应体系中加入终止液(H2SO4 3.6 mol/L),生成的产物用9602酶标仪(北京普朗仪器)在450 nm及490 nm分别读取光密度(D)值,根据标准曲线计算培养液中RANTES的含量(pg/mL)。 1.4 BEAS-2B细胞增殖测试
取BEAS-2B以细胞密度5×103/孔接种至96 孔板中,5% FBS 培养贴壁后换成含0.1% FBS 的DMEM/F12 培养液 (每孔100 μL) 培养24 h;弃去原培养液,换为100 μL含不同浓度CK的5% FBS DMEM/F12培养液干预24 h后,每孔加入CCK-8 试剂10 μL,置于37℃培养箱中孵育2 h;以酶标检测仪在单波长450 nm 处检测D450值。 1.5 RNA抽提、反转录及PCR反应
BEAS-2B细胞处理同1.2项下步骤,使用TRIzol试剂抽提细胞内的总RNA,在260 nm波长下用B-600紫外分光光度计测定其RNA含量,按照M-MLV反转录酶说明书进行反转录反应,以cDNA为模板进行PCR扩增。以β-actin为对照,PCR引物序列参考文献[14],RANTES: 5′-CGC TGT CAT CCT CAT TGC TA-3′(forward),5′-CAC ACA CTT GGC GGT TCT T-3′(reverse);β-actin:5′-GAC TAC CTC ATG AAG ATC-3′(forward),5′-GAT CCA CAT CTG CTG GAA-3′(reverse)。取10 μL PCR扩增产物,进行1.2%琼脂糖凝胶电泳分析,紫外线透射下拍照。 1.6 蛋白免疫印迹
用预冷PBS洗涤BEAS-2B细胞,细胞刮刀收集细胞,加入总蛋白抽提液,置冰上使其完全裂解。将细胞裂解液转入1.5 mL EP管中,在4℃10 000×g条件下离心20 min,吸取上清,煮沸5 min后冻存于-80℃备用。在280 nm波长处用B-600紫外分光光度计测定标准和样本蛋白的D值,根据标准曲线计算相应的各样品蛋白浓度。采用SDS-聚丙烯酰胺凝胶进行蛋白质电泳,依次进行半干法转膜,5%脱脂奶粉封闭,与各自的一抗和二抗孵育,最后使用显影定影试剂盒(碧云天)进行显影定影。 1.7 荧光素酶报告基因的测定
接种BEAS-2B细胞于6 cm细胞培养皿,6×105/皿,培养液为含5% 活性炭/葡萄糖处理的 FBS (CDT-FBS)的DMEM/F12。37℃,5%CO2继续培养24 h。用Lipofectamine 2000 将pAP-1-Luc质粒或pGRE-Luc质粒(2 μg/皿)转染入BEAS-2B。转染8 h后,细胞消化计数后以每孔8 000个细胞均匀接种至96孔培养板。加入用DMSO配制的化合物进行孵育(DMSO%<0.5%),培养24 h后,用Steady-Glo® Luciferase Assay system测定细胞中的荧光素酶活性。 1.8 统计学处理
实验数据应用GraphPad Prism 5.0软件进行曲线拟合与统计学分析,结果以x±s表示。多组间比较用One-way ANOVA,两组比较则采用双侧t检验,检验水准(α)为 0.05。 2 结 果 2.1 人参皂苷CK对TNF-α诱导的BEAS-2B细胞分泌RANTES的影响
25 ng/mL的TNF-α诱导BEAS-2B细胞分泌RANTES,从基础状态的(245.2± 21.7) pg/mL上升至(1 449.5 ± 56.3) pg/mL,增加了491.1%。经典糖皮质激素Dex在0.1 μmol/L浓度时抑制了RANTES的分泌,抑制率达到94.5%(P<0.001),与文献[14, 15]报道近似。CK剂量依赖性地抑制RANTES的分泌,3 μmol/L时CK对RANTES的抑制率达36.1%(P<0.01);10 μmol/L时CK对RANTES的抑制率达40.3%(P<0.01);30 μmol/L时CK对RANTES的抑制率达86.0%(P<0.001)。CCK-8实验显示,在高浓度(30 μmol/L)时CK对BEAS-2B细胞具有一定的增殖抑制效应,抑制率为21.2%(P<0.05);而在10 μmol/L及以下浓度时CK对BEAS-2B细胞没有增殖抑制效应。这些结果表明,CK对BEAS-2B中RANTES分泌抑制并不是由细胞增殖抑制引起的。
10、30 μmol/L人参皂苷CK 对BEAS-2B细胞中RANTES分泌有较显著的抑制作用。因此,在后续的实验中人参皂苷CK的剂量为10、30 μmol/L。 2.2 人参皂苷CK对TNF-α诱导的BEAS-2B细胞RANTES的mRNA及蛋白表达的影响
RT-PCR结果显示,10、30 μmol/L人参皂苷CK组RANTES mRNA表达量低于TNF-α组(图 1A)。蛋白质印迹实验也显示,10、30 μmol/L人参皂苷CK抑制BEAS-2B细胞内RANTES蛋白水平(图 1B)。这些结果表明,人参皂苷CK对RANTES mRNA转录水平有抑制效应,进而导致细胞内RANTES蛋白翻译下降。
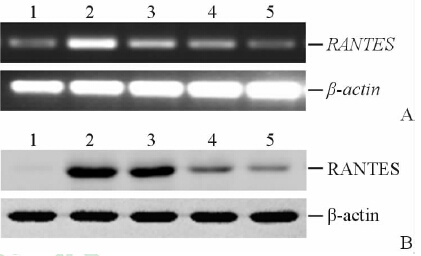
|
图 1 人参皂苷CK对TNF-α诱导的BEAS-2B细胞RANTES的mRNA及蛋白表达的影响 Fig 1 Effects of ginsenoside Compound K on RANTES mRNA and protein expression in TNF-α-treated BEAS-2B cells CK: Compound K; Dex: Dexamethasone. BEAS-2B cells were treated with CK or Dex for 24 h after TNF-α (25 ng/mL) stimulation for 1 h. The mRNA (A) and protein (B) levels of RANTES were detected by RT-PCR and Western blotting analysis,respectively. 1: Control; 2: TNF-α (25 ng/mL) induction; 3: TNF-α plus 10 μmol/L CK; 4: TNF-α plus 30 μmol/L CK; 5: TNF-α plus 0.1 μmol/L Dex |
应用基因瞬时转染技术,将pAP-1-Luc导入BEAS-2B细胞,结果发现10 μmol/L和30 μmol/L人参皂苷CK对AP-1的活化有抑制效应,10 μmol/L时抑制率为30.0%(P<0.05),30 μmol/L时抑制率达到了50.4%(P<0.001),推测CK可能通过抑制AP-1进而下调RANTES表达。 2.4 人参皂苷CK对GR转录激活的影响
结果表明,10 μmol/L和30 μmol/L人参皂苷CK可以诱导BEAS-2B细胞内GR的活化,尽管其GR激活效应低于Dex,CK在10 μmol/L时激活效应上升了472.5%(P<0.05),在30 μmol/L时激活效应上升了705%(P<0.01)。 2.5 GR在人参皂苷CK抑制BEAS-2B细胞分泌RANTES中的作用
结果(图 2)表明,在没有米非司酮存在的情况下,CK有效地抑制RANTES的分泌(P<0.01);在米非司酮存在的情况下,CK对RANTES的分泌抑制被翻转,表明人参皂苷CK通过激活GR抑制了BEAS-2B细胞中RANTES的分泌。
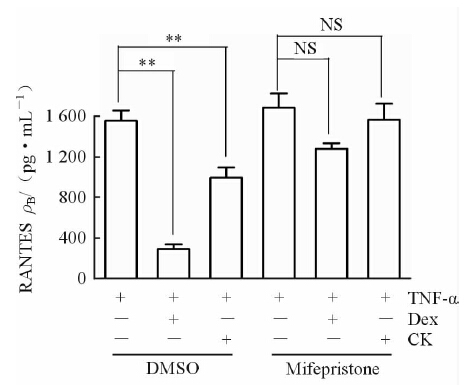
|
图 2 GR在人参皂苷CK抑制BEAS-2B细胞分泌RANTES中的作用 Fig 2 Role of GR in ginsenoside Compound K (CK) inhibiting RANTES secretion in TNF-α-treated BEAS-2B cells The concentration of RANTES in BEAS-2B supernatant was determined by ELISA method. TNF-α (25 ng/mL); Dex (0.1 μmol/L); CK (10 μmol/L); Mifepristone (1 μmol/L). **P<0.01 vs TNF-α induction. n=3,x±s |
哮喘患者的气道经常出现上皮损伤的现象[16]。嗜酸性粒细胞是哮喘气道炎症反应中的主要效应细胞。在变态反应性炎症部位,募集的嗜酸性粒细胞及其他效应细胞释放多种炎症因子、毒性蛋白及脂质介质,导致气道局部的组织结构发生病变和损伤[16]。
研究表明,在以嗜酸性粒细胞富集为特征的炎症性疾病中,支气管上皮细胞可分泌RANTES[15]。RANTES对多种变态反应性炎症细胞如CD45RO+记忆T淋巴细胞、嗜酸性粒细胞及肥大细胞均具有强力及选择性的趋化效应,能募集嗜酸性粒细胞等迁移至气道管腔黏膜部位,扩大炎症反应。并且,RANTES通过诱导炎症部位募集嗜酸性粒细胞等来激活2型辅助性T淋巴细胞[17]。荟萃分析表明,RANTES基因多态性与哮喘发作有密切的关联[4]。因此,抑制RANTES的表达、阻断嗜酸粒细胞的生成及活化可能成为治疗哮喘的一种途径。
人参皂苷CK作为多种原人参二醇型皂苷(Rb1、Rb2、Rc)的体内代谢产物,是体内吸收和发挥药效的真正实体分子[18]。CK在多种体内和体外实验模型中表现出良好的抗炎活性[19, 20],我们推测CK或许是人参及其提取物治疗哮喘的活性成分之一。本实验结果显示,在支气管上皮细胞中,CK剂量依赖性地抑制TNF-α诱导的RANTES分泌。并且,RANTES mRNA转录被CK有效抑制,表明CK至少部分在转录水平上调节RANTES的表达。
研究表明,RANTES基因5′侧翼区存在一系列转录调节因子的潜在结合位点,如AP-1等[21, 22]。作为一类重要的转录调节因子,AP-1在炎症反应中介导多种细胞因子的表达。AP-1由2个分别属于Jun家族和Fos家族的蛋白通过亮氨酸拉链形成同源或异源二聚体。炎症细胞因子(如TNF-α)通过JNK磷酸化c-Jun,促使Jun家族和Fos家族形成活性二聚体。活化的AP-1与靶基因启动子区域的AP-1应答元件结合,激活目标基因的转录[23]。我们的结果提示,CK可抑制AP-1对其应答元件的结合,进而抑制下游靶基因RANTES的转录。
GR通过与AP-1的c-Jun亚单位之间以直接的蛋白-蛋白相互作用方式,阻止AP-1与其应答元件的结合,从而阻断AP-1的信号转导[23]。GRE驱动的荧光素酶报告基因结果表明,在支气管上皮细胞中,CK展现出GR激动剂的特质,在10 μmol/L和30 μmol/L浓度时,GR转录激活活性分别提高了4.7倍和7.1倍。我们推断,人参皂苷CK结合并激活BEAS-2B细胞内GR,活化的GR以蛋白-蛋白的相互作用方式抑制AP-1的活性,效应之一是抑制了BEAS-2B细胞分泌RANTES。于是,我们应用GR拮抗剂米非司酮检验这一假设。本实验运用GR强效类固醇类拮抗剂米非司酮,揭示CK对BEAS-2B细胞中RANTES的分泌抑制是由GR介导的。这可能是人参及其提取物抑制哮喘、改善炎症的机制之一。当然,CK对哮喘病理进程中重要的其他炎症致病因子,如eotaxin、粒-巨噬细胞集落刺激因子 (GM-CSF)等的效应,将是下一步研究的目标。
| [1] | Royce S G,Li X,Tortorella S,Goodings L,Chow B S,Giraud A S,et al.Mechanistic insights into the contribution of epithelial damage to airway remodeling.Novel therapeutic targets for asthma[J].Am J Respir Cell Mol Biol,2014,50:180-192. |
| [2] | Hu J Y,Zhang J,Cui J L,Liang X Y,Lu R,Du G F,et al.Increasing CCL5/CCR5 on CD4+ T cells in peripheral blood of oral lichen planus[J].Cytokine,2013,62:141-145. |
| [3] | Marques R E,Guabiraba R,Russo R C,Teixeira M M.Targeting CCL5 in inflammation[J].Expert Opin Ther Targets,2013,17:1439-1460. |
| [4] | Wen D,Du X,Nie S P,Dong J Z,Ma C S.Association between RANTES gene polymorphisms and asthma:a meta-analysis[J].PLoS One,2014,9:e90460. |
| [5] | Bårnes C B,Ulrik C S.Asthma and adherence to inhaled corticosteroids:current status and future perspectives[J].Respir Care,2014,60:455-468. |
| [6] | Babayigit A,Olmez D,Karaman O,Bagriyanik H A,Yilmaz O,Kivcak B,et al.Ginseng ameliorates chronic histopathologic changes in a murine model of asthma[J].Allergy Asthma Proc,2008,29:493-498. |
| [7] | Lim Y J,Na H S,Yun Y S,Choi I S,Oh J S,Rhee J H,et al.Suppressive effects of ginsan on the development of allergic reaction in murine asthmatic model[J].Int Arch Allergy Immunol,2009,150:32-42. |
| [8] | Ebeling C,Wu Y,Skappak C,Gordon J R,Ilarraza R,Adamko D J.Compound CVT-E002 attenuates allergen-induced airway inflammation and airway hyperresponsiveness,in vivo[J].Mol Nutr Food Res,2011,55:1905-1908. |
| [9] | Kim D Y,Yang W M.Panax ginseng ameliorates airway inflammation in an ovalbumin-sensitized mouse allergic asthma model[J].J Ethnopharmacol,2011,136:230-235. |
| [10] | Jung I D,Kim H Y,Park J W,Lee C M,Noh K T,Kang H K,et al.RG-Ⅱ from Panax ginseng C.A.Meyer suppresses asthmatic reaction[J].BMB Rep,2012,45:79-84. |
| [11] | Li J,Zhong W,Wang W,Hu S,Yuan J,Zhang B,et al.Ginsenoside metabolite compound K promotes recovery of dextran sulfate sodium-induced colitis and inhibits inflammatory responses by suppressing NF-kappaB activation[J].PLoS One,2014,9:e87810. |
| [12] | Yang C S,Ko S R,Cho B G,Shin D M,Yuk J M,Li S,et al.The ginsenoside metabolite compound K,a novel agonist of glucocorticoid receptor,induces tolerance to endotoxin-induced lethal shock[J].J Cell Mol Med,2008,12(5A):1739-1753. |
| [13] | Cuong T T,Yang C S,Yuk J M,Lee H M,Ko S R,Cho B G,et al.Glucocorticoid receptor agonist compound K regulates Dectin-1-dependent inflammatory signaling through inhibition of reactive oxygen species[J].Life Sci,2009,85:625-633. |
| [14] | Momoi A,Murao K,Imachi H,Sayo Y,Nakamura H,Hosokawa H,et al.Thiazolidinedione inhibits production of RANTES in a cytokine-treated human lung epithelial cell line[J].FEBS Lett,1999,452:301-304. |
| [15] | Stellato C,Beck L A,Gorgone G A,Proud D,Schall T J,Ono S J,et al.Expression of the chemokine RANTES by a human bronchial epithelial cell line.Modulation by cytokines and glucocorticoids[J].J Immunol,1995,155:410-418. |
| [16] | Roisman G L,Peiffer C,Lacronique J G,Le Cae A,Dusser D J.Perception of bronchial obstruction in asthmatic patients.Relationship with bronchial eosinophilic inflammation and epithelial damage and effect of corticosteroid treatment[J].J Clin Invest,1995,96:12-21. |
| [17] | Lambrecht B N,Hammad H.Asthma:the importance of dysregulated barrier immunity[J].Eur J Immunol,2013,43:3125-3137. |
| [18] | Lee J,Lee E,Kim D,Lee J,Yoo J,Koh B.Studies on absorption,distribution and metabolism of ginseng in humans after oral administration[J].J Ethnopharmacol,2009,122:143-148. |
| [19] | Park E K,Shin Y W,Lee H U,Kim S S,Lee Y C,Lee B Y,et al.Inhibitory effect of ginsenoside Rb1 and compound K on NO and prostaglandin E2 biosyntheses of RAW264.7 cells induced by lipopolysaccharide[J].Biol Pharm Bull,2005,28:652-656. |
| [20] | Liu K K,Wang Q T,Yang S M,Chen J Y,Wu H X,Wei W.Ginsenoside compound K suppresses the abnormal activation of T lymphocytes in mice with collagen-induced arthritis[J].Acta Pharmacol Sin,2014,35:599-612. |
| [21] | Yeligar S M,Machida K,Tsukamoto H,Kalra V K.Ethanol augments RANTES/CCL5 expression in rat liver sinusoidal endothelial cells and human endothelial cells via activation of NF-kappa B,HIF-1 alpha,and AP-1[J].J Immunol,2009,183:5964-5976. |
| [22] | Tavakkoly-Bazzaz J,Amiri P,Tajmir-Riahi M,Javidi D,Khojasteh-Fard M,Taheri Z,et al.RANTES gene mRNA expression and its -403 G/A promoter polymorphism in coronary artery disease[J].Gene,2011,487:103-106. |
| [23] | Ratman D,Vanden Berghe W,Dejager L,Libert C,Tavernier J,Beck I M,et al.How glucocorticoid receptors modulate the activity of other transcription factors:a scope beyond tethering[J].Mol Cell Endocrinol,2013,380:41-54. |
 2015, Vol. 36
2015, Vol. 36


