发作性交感神经功能亢进(paroxysmal sympathetic hyperactivity,PSH)是一类继发于颅脑损伤后的常见综合征[1],一般以阵发性的交感神经活动过度(如血压、心率、呼吸次数增加,高热、大汗、肌张力增高)为最常见临床表现[2],多继发于颅脑外伤、缺氧性脑病、脑出血和脑积水,部分患者可继发于脑肿瘤、颅内感染甚至低血糖症等,其中继发于脑外伤者约占全部PSH患者的79.4%[3, 4]。若处理不当,该类患者可发生高热性脑病、颅外器官功能衰竭甚至死亡[4]。然而,PSH发病机制还不明确,尚无统一规范且优选的治疗策略。目前临床医生常根据个人经验进行药物干预,治疗效果往往不确定,导致患者住院时间延长、预后差。我科从收治的大量PSH患者中总结治疗经验,其中,人工冬眠疗法作为控制外伤后高热、应激等不良反应的传统手段在临床中已有较长的应用历史,并见诸于报道[5]。同时,在文献交流以及临床探索中又逐渐总结出以普萘洛尔、加巴喷丁联合高压氧为主要手段的新型治疗方法,同样收到了良好的效果。本研究采用前瞻性方法观察我院2011年5月至2014年3月期间同期治疗的48例PSH病例,对PSH的临床特点进行总结分析,比较两种方法在治疗PSH中的异同,为PSH规范治疗方案的最终形成提供参考。
1 对象和方法 1.1 研究对象选择2011年5月至2014年3月在第二军医大学长征医院诊治的颅脑外伤患者。采用前瞻性研究方法,招募颅脑外伤后发生PSH的患者,填写基线调查表(包括人口学特点、健康状况及实验意愿等),并根据患者年龄区间、性别、入院格拉斯哥昏迷指数(Glasgow Coma Scale,GCS)评分以及是否实施手术情况配比纳入治疗A组和治疗B组(对照组)各24例。其中,男39例,女9例,年龄14~59岁,均在脑外伤后出现PSH发作。住院期间根据神经外科手术记录和住院观察记录填写实验调查表,记录患者住院期间症状发作情况以及治疗药物、方法等。本研究已通过伦理学审查。
PSH诊断标准,诊断PSH需要出现以下7项中的5项,且至少每天发作1次:(1)体温≥38.5℃;(2)心率≥130次/min;(3)呼吸频率≥20次/min;(4)收缩压≥160 mmHg(1 mmHg=0.133 kPa);(5)肢体过度活动;(6)大汗;(7)特殊肢体姿势(如僵硬、去皮层或去脑强直)。
排除标准:患者继往存在高血压、自发性脑出血或同时合并脊髓损伤、脑积水、颅内感染及肿瘤者。
1.2 治疗方法 1.2.1 一般治疗和高压氧治疗一般治疗:患者按一般入院流程进行处理,对于达到手术指征的患者行手术治疗,术后予必要的营养支持、辅助呼吸、预防肺部感染和应激性溃疡、维持水电解质酸碱平衡、控制颅内压等治疗,已出现肺部感染者予经验性应用抗生素,并根据痰培养结果调整用药,规范治疗。
高压氧治疗:患者开始康复治疗后进入第二军医大学高压氧中心接受高压氧治疗,使用100%浓度的氧气以6.89 kPa/min的速度上升至1.5倍标准大气压(151.99 kPa),持续120 min后以6.89 kPa/min的速度进行适当减压。每天治疗1次,持续10 d为1个完整的疗程。间隔5 d后开始第2个疗程。
1.2.2 A组治疗方案 在一般治疗和高压氧治疗的基础上,以组合药物作为主要研究治疗。根据患者发作时间p、频率和程度,首选普萘洛尔、加巴喷丁、苯二氮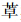 类药物联合治疗,普萘洛尔一般20~ 60 mg,4~6次/d;加巴喷丁起始用量300~900 mg/d,逐渐增加至3 600 ~4 800 mg/d,二者均为胃肠道给药;同时,在PSH患者发作时予静脉注射地西泮5~10 mg。
类药物联合治疗,普萘洛尔一般20~ 60 mg,4~6次/d;加巴喷丁起始用量300~900 mg/d,逐渐增加至3 600 ~4 800 mg/d,二者均为胃肠道给药;同时,在PSH患者发作时予静脉注射地西泮5~10 mg。
在一般治疗和高压氧治疗的基础上,以冬眠疗法作为对比研究治疗。氯丙嗪50 mg,异丙嗪50 mg,哌替啶100 mg,加入5%葡萄糖液或生理盐水中静脉滴注。同时给予冰敷或冰毯降温,以冰帽降低脑温至28℃而体温保持32℃,每4 h时追加用药氯丙嗪25 mg、异丙嗪25 mg。每6~8 h可暂时解除冬眠进行饮食,一次冬眠治疗持续2~3 d,冬眠治疗完成后给予患者24~48 h休息后再次进行冬眠治疗。冬眠过程中予以正常治疗及护理,并有专人密切监测患者血压、肛温、脉搏、呼吸及尿量变化。
1.3 观察指标基线评估患者性别、年龄、是否已接受手术及入院GCS评分情况。比较住院期间A组与B组中患者肺部感染持续时间、平均住ICU时间、平均住院时间(包括康复医院内治疗时间)及营养状态等情况;随访1年,以12个月时患者GCS评分及格拉斯哥预后(Glasgow Outcome Scale,GOS)评分评价患者预后。
手术情况、住院时间及住ICU时间等由医院信息系统查询得到,肺部感染评估根据临床表现(症状和体征)、影像学检查结果、血常规、生化及痰培养检验结果确定。应用体质量改变百分比[即(平时体质量-实际体质量)/平时体质量×100%]评价患者的短期营养状况:1周体质量改变百分比1%~2%为中度体质量丧失,>2%为重度体质量丧失;1个月体质量改变百分比≤5%为中度体质量丧失,>5%为重度体质量丧失;3个月体质量改变百分比≤7.5%为中度体质量丧失,>7.5%为重度体质量丧失;6个月体质量改变百分比不超过10%为中度体质量丧失,>10%为重度体质量丧失。
1.4 统计学处理应用SPSS 16.0软件进行统计分析。患者年龄、住院天数、肺部感染天数等计量资料以 x±s表示。 肺部感染及中、重度体质量丧失两项情况的比较用χ2检验;PSH患者基线比较、住院期间患者肺部感染天数、住院天数和ICU停留天数以及治疗前后发作时间和次数等为偏态分布或方差不齐,故采用Mann Whitney秩和检验;随访GCS和GOS评分为等级资料,采用Mann Whitney秩和检验。所有统计结果均为双侧检验,检验水准(α)为0.05。
2 结 果 2.1 PSH患者临床特征48例PSH患者平均年龄为(27.48±9.62)岁;入院GCS评分在3~5分者28例(58.3%),6~8分者20例(41.7%);PSH发作患者中出现大汗、特殊肢体姿势、心动过速、呼吸急促、血压升高症状者分别为47例(97.9%)、41例(85.4%)、47例(97.9%)、39例(81.3%)、38例(79.2%),所有PSH患者发作均有肢体过度活动及体温过高表现。症状一般出现于原发疾病后2~14 d,其中3~7 d内出现者36例(75.0%);每日发作次数在3次及3次以内者5例(10.4%),4次及4次以上者43例(89.6%)。按照分组原则入组后,两组各24例患者。A组年龄(27.46±9.71)岁,男20例、女4例,手术治疗17例;B组年龄(27.50±9.73)岁,男19例、女5例,手术治疗17例。两组间年龄、性别、手术治疗情况及入院GCS评分差异均无统计学意义。
2.2 两组住院期间一般情况比较 如表 1所示,住院期间A组患者多为中度体质量丧失,重度体质量丧失患者中治疗A组要少于治疗B组,两组间仅平均住院时间差异有统计学意义(P<0.05)。|
|
表 1 住院期间A组与B组患者一般情况比较 Tab 1 Questionnaire survey findings of management mode |
如表 2所示,治疗2周后,两组患者每日发作次数与治疗前相比差异均无统计学意义;A组每日发作总时间明显缩短,与治疗前比较差异有统计学意义(P<0.05)。
|
|
表 2 A组与B组短期治疗效果比较 |
如表 3所示,12个月随访观察期内2例患者失访(均为治疗A组)。在完成随访的46例患者中,A组GOS评分结果优于B组(P<0.05)。共40例患者生存,A组与B组各20例。这40例患者GCS评分统计结果并不连续,GCS 5分、8分、10~12分区间内无PSH患者,两组GCS评分差异无统计学意义。
|
|
表 3 A组与B组随访结果比较 |
PSH临床表现为阵发性交感神经活动过度,如高热、多汗,肌张力增高,心率、血压、呼吸频率上升,瞳孔扩张,一般同时有去脑或去皮质姿势、肌痉挛等;外界刺激(如疼痛、翻身等)均可诱发。在本组患者中,PSH患者平均年龄为(27.48±9.62)岁,并且GCS评分均在3~8分内;所有PSH患者均有肢体过度活动及体温过高表现,同时结果表明颅脑外伤后PSH患者多在伤后3~7 d出现首次发作,每日发作次数多为4次以上,根据GOS评分可知PSH大部分预后较差。以上结果与文献报道[4]基本一致,文献报道中患者平均年龄为20~25岁,发病人群更为年轻,其具体机制还有待进一步明确。
目前PSH的主要治疗方式为对症药物的应用[6, 7]。本研究对比分析以普萘洛尔、加巴喷丁、苯二氮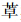 类药物联合治疗为主(A组)和以冬眠疗法为主(B组)治疗PSH的疗效,两组患者的性别、年龄、实施手术情况及GCS评分均无明显差异,有利于客观评价不同治疗方法对患者的影响。本研究中,A组采用的治疗方案可以大幅降低PSH发作总时间,部分缩短患者住院时间,由此我们认为不论在近期症状控制还是远期康复效果上,药物联合对PSH有重要的治疗作用,该结果与文献[8]报道一致,其保护作用可能与加巴喷丁的神经系统抑制作用有关,而住院时间的缩短可能是因交感神经兴奋受到抑制从而减少了机体能量消耗及器官损害所致。同时我们需要认识到有些PSH治疗药物可能存在安全性问题,如可乐定应用可能导致血压过低、心率下降、窒息甚至休克。吗啡可明显改善PSH症状,但其连续使用3~5 d即产生耐药性,1周以上可能成瘾。基于以上考虑,本研究中并未使用这些药物。
类药物联合治疗为主(A组)和以冬眠疗法为主(B组)治疗PSH的疗效,两组患者的性别、年龄、实施手术情况及GCS评分均无明显差异,有利于客观评价不同治疗方法对患者的影响。本研究中,A组采用的治疗方案可以大幅降低PSH发作总时间,部分缩短患者住院时间,由此我们认为不论在近期症状控制还是远期康复效果上,药物联合对PSH有重要的治疗作用,该结果与文献[8]报道一致,其保护作用可能与加巴喷丁的神经系统抑制作用有关,而住院时间的缩短可能是因交感神经兴奋受到抑制从而减少了机体能量消耗及器官损害所致。同时我们需要认识到有些PSH治疗药物可能存在安全性问题,如可乐定应用可能导致血压过低、心率下降、窒息甚至休克。吗啡可明显改善PSH症状,但其连续使用3~5 d即产生耐药性,1周以上可能成瘾。基于以上考虑,本研究中并未使用这些药物。
颅脑外伤后患者存在活跃的糖异生,PSH的频繁发作又加重了能量消耗,虽然根据营养情况比较结果,A组方案可使重度体质量丧失患者的比例降低,但值得注意的是,研究中全体PSH患者均存在中度以上的体质量丧失,因此有文献建议应早期对PSH患者进行营养补充[9]。B组方案同样存在一定的PSH治疗作用,患者2周后PSH发作次数及总时间均有下降,但其总体作用不如A组药物明显。第12个月时A组患者GOS评分结果优于B组(P<0.05),可以认为早期采用该治疗方法能提高患者后期生存质量;同样,文献中也强调早期干预对PSH具有重要意义[10, 11]。同时,根据随访GCS评分结果,A组方案可能对患者意识状态改善有帮助,但可能由于样本量较少,两组间GCS评分结果并无统计学差异,因此这一推论还有待大样本试验加以证实。
此外,我院长期采用高压氧治疗PSH患者,在改善患者预后方面有良好的效果[12]。在临床实践中发现许多患者可自发从昏迷中恢复,认知功能迅速改善,这种脑损伤的恢复表明一些受损的大脑细胞功能可以在一段时间后自我修复。最近的研究显示,高压氧治疗可以促进慢性脑损伤患者的功能恢复[13, 14, 15]。根据我们此前的报道[12],也可推测高压氧治疗可能刺激不活跃的细胞恢复正常。PSH的发生与脑核心部位损伤密切相关,包括下丘脑、丘脑或中脑[16]。这些结构损伤往往伴随着严重的意识障碍,临床观察表明PSH发作可在自发的意识恢复情况下停止,这表明失去功能的神经元有恢复潜力。通过各种方法修复这些失去功能的神经元,可以改善患者的神经功能,同时也减轻了PSH发作。因此我们认为高压氧治疗可作为PSH干预的重要手段。
PSH多见于年轻患者,往往颅脑损伤较重,需要尽早药物干预。以普萘洛尔、加巴喷丁等药物配合高压氧康复的治疗方法可一定程度改善PSH患者的预后,在缩短住院时间、提高患者生存状态方面优于冬眠合剂治疗。
| [1] | Blackman J A,Patrick P D,Buck M L,Rust R S Jr. Paroxysmal autonomic instability with dystonia after brain injury [J]. Arch Neurol,2004,61: 321-328. |
| [2] | Baguley I J,Perkes I E,Fernandez-Ortega J F,Rabinstein A A,Dolce G,Hendricks H T; Consensus Working Group. Paroxysmal sympathetic hyperactivity after acquired brain injury: consensus on conceptual definition,nomenclature,and diagnostic criteria [J]. J Neurotrauma,2014,31: 1515-1520. |
| [3] | Srinivasan S,Lim C C,Thirugnanam U. Paroxysmal autonomic instability with dystonia [J]. Clin Auton Res,2007,17: 378-381. |
| [4] | Perkes I,Baguley I J,Nott M T,Menon D K. A review of paroxysmal sympathetic hyperactivity after acquired brain injury [J]. Ann Neurol,2010,68: 126-135. |
| [5] | Sherman A L,Wang M Y. Hypothermia as a clinical neuroprotectant [J]. Phys Med Rehabil Clin N Am,2014,25: 519-529,vii. |
| [6] | Rabinstein A A,Benarroch E E. Treatment of paroxysmal sympathetic hyperactivity [J]. Curr Treat Options Neurol,2008,10: 151-157. |
| [7] | Baguley I J,Heriseanu R E,Gurka J A,Nordenbo A,Cameron I D. Gabapentin in the management of dysautonomia following severe traumatic brain injury: a case series [J]. J Neurol Neurosurg Psychiatry,2007,78: 539-541. |
| [8] | Choi H A,Jeon S B,Samuel S,Allison T,Lee K. Paroxysmal sympathetic hyperactivity after acute brain injury [J]. Curr Neurol Neurosci Rep,2013,13: 370. |
| [9] | Caldwell S B,Smith D,Wilson F C. Impact of paroxysmal sympathetic hyperactivity on nutrition management after brain injury: a case series [J]. Brain Inj,2014,28: 370-373. |
| [10] | Lump D,Moyer M. Paroxysmal sympathetic hyperactivity after severe brain injury [J]. Curr Neurol Neurosci Rep,2014,14: 494. |
| [11] | 谢翠英,许汪斌. 阵发性交感神经过度兴奋的治疗进展 [J]. 临床合理用药杂志,2012,5: 166-167. |
| [12] | Lv L Q,Hou L J,Yu M K,Ding X H,Qi X Q,Lu Y C. Hyperbaric oxygen therapy in the management of paroxysmal sympathetic hyperactivity after severe traumatic brain injury: a report of 6 cases[J]. Arch Phys Med Rehabil,2011,92: 1515-1518. |
| [13] | Golden Z,Golden C J,Neubauer R A. Improving neuropsychological function after chronic brain injury with hyperbaric oxygen [J]. Disabil Rehabil,2006,28: 1379-1386. |
| [14] | Harch P G,Fogarty E F,Staab P K,Van Meter K. Low pressure hyperbaric oxygen therapy and SPECT brain imaging in the treatment of blast-induced chronic traumatic brain injury (post-concussion syndrome) and post traumatic stress disorder: a case report [J]. Cases J,2009,2: 6538. |
| [15] | Hardy P,Johnston K M,De Beaumont L,Montgomery D L,Lecomte J M,Soucy J P,et al. Pilot case study of the therapeutic potential of hyperbaric oxygen therapy on chronic brain injury [J]. J Neurol Sci,2007,253(1-2): 94-105. |
| [16] | Baguley I J,Heriseanu R E,Cameron I D,Nott M T,Slewa-Younan S. A critical review of the pathophysiology of dysautonomia following traumatic brain injury [J]. Neurocri Care,2008,8: 293-300. |
 2015, Vol. 36
2015, Vol. 36


