格雷夫斯病(Graves’disease,GD)是一种与自身免疫相关的甲状腺功能障碍疾病,主要表现为弥漫性甲状腺肿和甲状腺功能亢进。其中25%~50%的患者伴有眼部症状,称之为格雷夫斯眼病(Graves’ ophthalmopathy,GO)[1]。慢性自身免疫性甲状腺炎的患者也会出现该眼部症状,因此也可称之为甲状腺相关性眼病(thyroid associated ophthalmopathy,TAO)[2, 3]。病变主要累及眼外肌及脂肪结缔组织,如平滑肌、横纹肌、脂肪组织、结缔组织及泪腺部等,在不同的人群、病变的不同时期,可表现出甲状腺内分泌轴(甲状腺、垂体及下丘脑所分泌的内分泌素或其相互作用)的异常。并且由于病程及全身免疫、内分泌状态的不同,患者可表现为眼部体征与甲状腺功能异常的不同步,且临床上甲状腺功能可亢进、正常或低下。TAO是一种潜在的能影响视力的疾病,其困扰医生与科学家近两个世纪。在过去的20年里,该病的发病机制研究已经有了重大进展,如在细胞因子(如干扰素γ)的影响下眼眶成纤维细胞分泌氨基葡聚糖,使其在眼外肌和脂肪组织周围堆积[4],引起眼球突出、复视等。那么为何一部分GD患者会发展为GO而另一部分GD患者不会呢?目前仍是未解之谜。
红细胞分布宽度(red cell distribution width,RDW)是一个反映多种慢性疾病炎性反应的重要指标,其参数可指示红细胞大小差异[5]。目前RDW在多种红细胞破坏或减少疾病中已被用于辅助标记,并可在某些疾病中作为独立危险因素[6, 7, 8]。RDW的升高与体内炎症状态同步也有助于印证这一点[9]。随着最近的不断研究发现,RDW有着更加广泛的临床意义[10],但尚未见RDW与TAO关系的研究。本研究试图了解RDW与TAO病情的关系,旨在通过简单较容易获得的RDW值来评估Graves病的进展。
1 资料和方法 1.1 资料采集52例GD患者资料采集于2014年10月至2015年3月我院眼科及内分泌科住院的GD患者,以此作为观察组,其中男性18 例、女性34 例,年龄(46.21±10.95)岁;另选取22例于本院健康体检的人群作为对照组,其中男性8 例、女性14 例,年龄(44.78±9.67)岁。GD患者根据有无GO分为两组。对照组与GD组年龄性别匹配,无甲状腺疾病史,其甲状腺超声结果均提示正常。另对所有参与者按是否抽烟分为吸烟、戒烟、不吸烟3组,评估吸烟对RDW的影响。
1.2 诊断标准和排除标准 1.2.1 GO的诊断标准根据NO SPECS进行分级:0级,无症状或体征;1级,只有体征而无症状;2级,软组织受累(有症状及体征);3级,眼球突出>正常上限3 mm,有或无症状;4级:眼外肌受累(常伴有复视及其他症状体征);5级:角膜受累;6级:视力变化。达到3级以上则为GO[11]。
1.2.2 GD的诊断标准(1)血清总甲状腺素(T4)、三碘甲状腺原氨酸(T3)、游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)、反T3(rT4)升高;(2)促甲状腺激素(TSH)降低;(3)可检出甲状腺刺激抗体(TSAb)等相关抗体。符合以上任何1条并结合临床表现(如怕热、多汗、易激动以及特殊眼征,弥漫性甲状腺肿等)即可确诊。
1.2.3 排除标准(1)肝脏/肾脏功能不全;(2)近6个月使用过类固醇或免疫抑制剂;(3)怀孕;(4)感染活动期;(5)过敏史;(6)肿瘤病史;(7)患者既往有免疫缺陷症;(8)不明原因的发热或者体质量减轻等未解决的疾病。
1.3 实验室资料采集所得实验室数据均在禁食后12 h获得。静脉血取自前臂肱静脉,甲状腺功能通过FT3、FT4和TSH水平的变化进行评估。甲状腺功能正常的参考范围值:总T3 1.34~2.73 nmol/L,总T4 78.4~157.4 nmol/L,FT3 2.23~5.35 pmol/L,FT4 9.00~25.00 pmol/L,TSH 0.40~4.67 mIU/L。
1.4 眼科评估所有GD患者的眼部检查由同一人测得,包括眼球突出度和临床活动性评分(CAS)。采用赫特尔(氏)眼球突出计(Hertel’s exophthalmo-meter readings,HER)测定眼球突出度。CAS评分标准:(1)自发性球后疼痛;(2)眼球向四周转动时疼痛;(3)眼睑充血;(4)结膜充血;(5)结膜水肿;(6)泪阜肿胀;(7)眼睑水肿。 以上7项各1分,CAS评分≥3分为TAO活动期,CAS评分≤2分为TAO稳定期[12]。
1.5 统计学处理所有正态分布的数据用 x±s 表示,而非正态分布数据用中位数(median)与最小值(min)和最大值(max)表示。因组内的不均匀分布,故用非参数测试检验。定量数据之间的比较采用Mann-Whitney U检验,定性数据之间的比较则采用χ2检验。影响RDW的独立因素采用Kruscall Wallis 方差分析。评估RDW之间和其他指标的相关性用Spearman 检验进行评估。检验水准(α)为0.05。
2 结 果 2.1 各组间甲状腺功能、RDW和HER值的比较GD患者(有GO组和无GO组)的FT3水平高于对照组 (P值分别为0.024、0.049 ),TSH水平低于对照组( P值分别为0.002、0.033 )。在GD患者中,TSH、FT3和FT4水平在有GO症状和无GO症状的患者之间相似,差异无统计学意义(P值分别为0.231、0.542、0.336 )。RDW在GD患者(有GO组和无GO组)高于对照组(P值分别为0.000 1、0.005 ),且在GD患者中有GO组比无GO组更高(P=0.046 8)。在GD患者中,有GO组的HER值高于无GO组(P=0.004)。详见表 1。
|
|
表 1 GD患者和对照组的甲状腺功能、RDW和HER值的比较 |
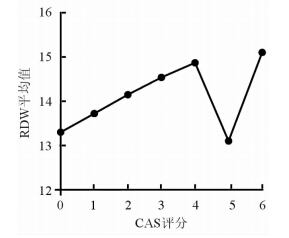
分析GD组的CAS评分,其中有14例患者评分为0,11例患者评分为1,9例患者评分为2,7例患者评分为3,5例患者评分为4,1例患者评分为5,5例患者评分为6。RDW在患者CAS评分分别为0、1、2、3、4、5、6时的平均数分别为13.30、13.72、14.15、14.54、14.87、13.10、15.10。可以发现,患者的RDW与CAS评分呈现平行增加,除了CAS评分为5分的GD患者(图 1)。这可能与该组患者数较少(仅1例患者)有关。
|
图 1 GD患者CAS评分与RDW平均值的关系 CAS:临床活动性评分;GD:格雷夫斯病(Graves’ disease);RDW:红细胞分布宽度 |
RDW是一个反映血循环中红细胞大小变化的参数,描述了红细胞体积异质性[13],通常全血细胞计数即可取得该参数值。迄今为止,RDW已成为用来评估营养不良性贫血和引起血细胞破坏的相关疾病的血液学指标,可用于评估心血管疾病(包括心力衰竭、外周动脉疾病、心肌梗死、心绞痛)危险系数、预测特发性肺纤维化患者的预后等[14, 15, 16]。
GO对于GD患者来说仍是一大挑战。影响GO的危险因素包括:基因因素,环境因素,吸烟,自身存在促甲状腺激素受体抗体,高龄,压力,碘的摄入量,131I治疗和甲状腺功能减退射频消融后等[17, 18]。尽管目前GO的具体发病机制尚不明确,但越来越多的证据支持眼眶成纤维细胞为发病的靶细胞,由于自身免疫机制引起眼眶成纤维细胞正常功能紊乱[19],从而引起一系列眼部症状的发生。有研究称在GO患者的眼眶脂肪细胞中发现TSH受体表达增加[20]。眼眶脂肪细胞和成纤维细胞产生的细胞因子如白介素6(IL-6)可促进B细胞增殖、分化并刺激眼眶组织产生TSH受体抗体(TRab)[20]。TRab有两种分型:TSH结合抑制性免疫球蛋白(TSH binding inhibitor immunoglobulin,TBII)和甲状腺刺激性免疫球蛋白(thyroid stimulating immunoglobulin,TSI)。相关报道[21]也已证实TRab与GO病情发展相关,其中TSI参与抗炎反应并与CAS评分呈正相关[21, 22, 23]。然而目前生物学测试法检测TRab亚型很难执行,因此大多仅用于揭示GO发展机制,临床运用较少。GO患者发病初期主要采用NO SPECS分级、CAS评分、眼眶磁共振成像来判断[11, 12, 24]。但这种检测方法在急性发作期不够灵敏,易导致治疗上的滞后,而TAO患者必须在急性炎症期及早发现,并给予相应的免疫抑制治疗产生有效应答,效果更佳。本研究发现GD患者RDW高于对照组,并且在GD患者中有GO的患者RDW高于无GO的患者。进一步分析RDW与GD患者CAS评分的关系,发现除了CAS评分为5分的GD患者(该组仅1例患者),患者的RDW与CAS评分呈现平行增加。根据本研究发现,推测RDW可辅助预测患者病情的发展。
吸烟是GO发展严重程度的一个危险因素[6, 25],但本研究没有发现吸烟与否和GO发病有较明显的关联。在本研究中发现,在GD患者中吸烟组、戒烟组和不吸烟组这3个组之间的RDW差异也没有统计学意义。
本研究有一定局限性。首先,由于CAS评分较高、病情较严重的患者近6个月内使用类固醇或免疫抑制剂,不符合数据采集标准,故而排除。因此收集到较严重的(即CAS评分高)患者例数较少。其次,由于该研究是横断面研究,故对GO发展的起始时间和持续时间不明确。另由于眼眶磁共振费用较高,多数患者不能承受,相关数据资料未录入本研究。
综上所述,本研究发现RDW与GD病情严重程度有关。该结果证实可通过RDW的测量间接判断GD的病情发展。今后还可以对同一GO患者不同病情阶段的RDW值进一步研究调查,以此来辅证这一观点。
| [1] | Li Y,Rahmanian M,Widström C,Lepperdinger G,Frost G I,Heldin P.Irradiation-induced expression of hyaluronan (HA) synthase 2 and hyaluronidase 2 genes in rat lung tissue accompanies active turnover of HA and induction of types Ⅰ and Ⅲ collagen gene expression [J].Am J Respir Cell Mol Biol,2000,23:411-418. |
| [2] | Hiromatsu Y,Eguchi H,Tani J,Kasaoka M,Teshima Y.Graves' ophthalmopathy: epidemiology and natural history[J].Intern Med,2014,53:353-360. |
| [3] | Bahn R S.Graves' ophthalmopathy[J].N Engl J Med,2010,362:726-738. |
| [4] | Prabhakar B S,Bahn R S,Smith T J.Current perspective on the pathogenesis of Graves' disease and ophthalmopathy[J].Endocr Rev,2003,24:802-835. |
| [5] | Bonaque J C,Pascual-Figal D A,Manzano-Fernández S,González-Cánovas C,Vidal A,Muñoz-Esparza C,et al.Red blood cell distribution width adds prognostic value for outpatients with chronic heart failure[J].Rev Esp Cardiol (Engl Ed),2012,65:606-612. |
| [6] | Bartalena L,Marcocci C,Tanda M L,Manetti L,Dell'Unto E,Bartolomei M P,et al.Cigarette smoking and treatment outcomes in Graves' ophthalmopathy[J].Ann Intern Med,1998,129:632-635. |
| [7] | Tonelli M,Sacks F,Arnold M,Moye L,Davis B,Pfeffer M; for the Cholesterol and Recurrent Events (CARE) Trial Investigators.Relation between red blood cell distribution width and cardiovascular event rate in people with coronary disease[J].Circulation,2008,117:163-168. |
| [8] | Vayá A,Hernández V,Rivera L,Hernández J L,Lago A,España F,et al.Red blood cell distribution width in patients with cryptogenic stroke[J].Clin Appl Thromb Hemost,2015,21:241-245. |
| [9] | Song C S,Park D I,Yoon M Y,Seok H S,Park J H,Kim H J,et al.Association between red cell distribution width and disease activity in patients with inflammatory bowel disease[J].Dig Dis Sci,2012,57:1033-1038. |
| [10] | Dogan S,Celikbilek M,Zararsiz G,Deniz K,Sivgin S,Guven K,et al.Red blood cell distribution width as a non-invasive marker for the assessment of inflammation in non-alcoholic steatohepatitis[J].Hepatogastroenterology, 2015,62:393-398. |
| [11] | Werner S C.Modification of the classification of the eye changes of Graves' disease: recommendations of the Ad Hoc Committee of the American Thyroid Association[J].J Clin Endocrinol Metab,1977,44: 203-204. |
| [12] | Mourits M P,Prummel M F,Wiersinga W M,Koornneef L.Clinical activity score as a guide in the management of patients with Graves' ophthalmopathy[J].Clin Endocrinol(Oxf),1997,47:9-14. |
| [13] | Harrington A M,Ward P C,Kroft S H.Iron deficiency anemia,beta-thalassemia minor,and anemia of chronic disease: a morphologic reappraisal[J].Am J Clin Pathol,2008,129:466-471. |
| [14] | Isik T,Kurt M,Ayhan E,Tanboga I H,Ergelen M,Uyarel H.The impact of admission red cell distribution width on the development of poor myocardial perfusion after primary percutaneous intervention[J].Atherosclerosis,2012,224:143-149. |
| [15] | Kim J,Kim K,Lee J H,Jo Y H,Rhee J E,Kim T Y,et al.Red blood cell distribution width as an independent predictor of all-cause mortality in out of hospital cardiac arrest[J].Resuscitation,2012,83:1248-1252. |
| [16] | Ye Z,Smith C,Kullo I J.Usefulness of red cell distribution width to predict mortality in patients with peripheral artery disease[J].Am J Cardiol,2011,107:1241-1245. |
| [17] | Bartalena L,Marcocci C,Bogazzi F,Manetti L,Tanda M L,Dell'Unto E,et al.Relation between therapy for hyperthyroidism and the course of Graves' ophthalmopathy[J].N Engl J Med,1998,338:73-78. |
| [18] | Tanda M L,Piantanida E,Liparulo L,Veronesi G,Lai A,Sassi L,et al.Prevalence and natural history of Graves' orbitopathy in a large series of patients with newly diagnosed Graves' hyperthyroidism seen at a single center[J].J Clin Endocrinol Metab,2013,98:1443-1449. |
| [19] | Bahn R S.Clinical review 157: pathophysiology of Graves' ophthalmopathy: the cycle of disease[J].J Clin Endocrinol Metab,2003,88:1939-1946. |
| [20] | Kazim M,Goldberg R A,Smith T J.Insights into the pathogenesis of thyroid-associated orbitopathy: evolving rationale for therapy[J].Arch Ophthalmol,2002,120:380-386. |
| [21] | Gerding M N,van der Meer J W,Broenink M,Bakker O,Wiersinga W M,Prummel M F.Association of thyrotrophin receptor antibodies with the clinical features of Graves' ophthalmopathy[J].Clin Endocrinol (Oxf),2000,52:267-271. |
| [22] | Eckstein A K,Plicht M,Lax H,Hirche H,Quadbeck B,Mann K,et al.Clinic results of anti-inflammatory therapy in Graves' ophthalmopathy and association with thyroidal autoantibodies[J].Clin Endocrinol(Oxf,2004,61:612-618. |
| [23] | Lytton S D,Ponto K A,Kanitz M,Matheis N,Kohn L D,Kahaly G J.A novel thyroid stimulating immunoglobulin bioassay is a functional indicator of activity and severity of Graves' orbitopathy[J].J Clin Endocrinol Metab,2010,95:2123-2131. |
| [24] | Van der Zee J S,Aalberse R C.Immunochemical characteristics of IgG4 antibodies[J].N Engl Reg Allergy Proc,1988,9:31-33. |
| [25] | Prummel M F,Wiersinga W M.Smoking and risk of Graves' disease[J].JAMA,1993,269:479-482. |
 2015, Vol. 36
2015, Vol. 36


