2. 陕西省人民医院医务处, 西安 710068
2. Department of Medical Affair, Shaanxi Provincial People's Hospital, Xi'an 710068, Shaanxi, China
帕金森病(Parkinson disease,PD)是一类常见的中枢神经系统慢性退行性疾病,随着年龄增加其发病率逐渐增高,主要影响50岁以上人群[1]。PD的病理学特征是发生于黑质多巴胺能神经元的变性与坏死,造成向纹状体转运的多巴胺减少,临床表现为静止性震颤为特征的运动功能障碍[2]。PD患者发生多巴胺能神经元损伤的机制被认为与包括遗传在内的多种因素相关,其中神经元线粒体功能障碍在PD所致神经元变性中起到关键作用[3]。许多以神经细胞氧化应激及线粒体功能障碍为靶点的化合物,在离体及在体实验中被证明对多巴胺能神经元具有保护作用[4]。
传统中药丹参是唇形科植物甘西鼠尾草的干燥根,被传统医学广泛应用于心绞痛、心肌梗死、卒中等心脑血管疾病的预防与治疗[5]。丹参提取物包含18种以上具有生物活性的化合物,可分为脂溶性和水溶性两类,其中丹酚酸B(salvianolic acid B,SalB)是含量较高、活性较强的一种水溶性成分[6]。以往研究表明,SalB具有抗氧化、保护缺血再灌注损伤、防治动脉粥样硬化等作用[7, 8],其抗肿瘤作用也在多种人类肿瘤细胞系中得到证实[9]。一项研究表明,SalB可通过其抗氧化活性,对6-羟多巴胺所致SH-SY5Y细胞凋亡发挥保护作用[10]。但SalB对PD相关损伤神经元的保护作用机制仍不明确。因此,本研究采用1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)处理PC12细胞,建立PD的离体细胞模型,观察SalB对细胞线粒体功能的影响,并探讨其可能的作用机制,为临床应用提供理论依据。
1 材料和方法 1.1 主要试剂及仪器实验用PC12细胞由北京生物化学与细胞生物学研究所提供;胎牛血清由杭州四季青公司提供;DMEM细胞培养基由Gibco公司提供;线粒体膜电位染料Rh123、胰蛋白酶由Sigma公司提供;线粒体ATP合成试剂盒由BD公司提供;Opa-1、Mfn-1、Drp-1、Fis-1和β-actin抗体由Cell Signaling公司提供;RT-PCR及蛋白质印迹检测试剂盒由Sigma公司提供。
1.2 实验分组及处理实验分为3组:正常对照组、PD模型组、SalB处理组。正常对照组PC12细胞常规培养,PD模型组PC12细胞加入100 μmol/L MPP+制备PD模型,SalB处理组PC12细胞在损伤后2 h加入50 μmol/L SalB共培养。
1.3 细胞线粒体功能的测定 1.3.1 线粒体膜电位检测线粒体膜电位水平采用Rh123荧光染色法进行测定。PC12细胞被接种于共聚焦细胞爬片上,经过各种处理后,加入10 μmol/L Rh123染料在黑暗中37℃培养箱中孵育1 h。孵育完成后,避光弃去孵育液,在共聚焦荧光显微镜下检测荧光强度,结果表示为与正常对照组荧光强度的百分比。
1.3.2 线粒体ATP合成检测线粒体ATP合成检测采用BD公司提供的商品化试剂盒进行。PC12细胞经过各种处理后,采用梯度离心法分离出线粒体,加入30 μL缓冲试剂A和B,室温下孵育10 min。反应在酶标仪中进行记录,以加入0.1 mmol/L ADP为开始,记录5 min,结果表示为与正常对照组ATP合成速率的百分比。
1.4 PCR法测定细胞线粒体DNA含量线粒体DNA含量检测采用RT-PCR法进行。提取PC12细胞DNA作为内参,用于检测线粒体DNA的引物序列为:正义5′-ATA TTT TCA CTG CTG AGT CCC GTG G-3′;反义5′-AAT TTC GGT TGG GGT GAC CTC GGA G-3′。
1.5 实时定量RT-PCR测定线粒体生物发生相关转录因子表达扩增曲线反应条件:95℃预变性5 min;95℃变性20 s,60℃退火30 s,72℃延伸20 s,在此阶段进行荧光信号采集,共40个循环;溶解曲线反应条件:60~95℃每循环温度升高0.5℃,维持20 s,采集荧光信号,共71个循环。所用引物序列:PGC-1正义5′-GTG CAG CCA AGA CTC TGT ATG G-3′;反义5′-GTC CAG GTC ATT CAC ATC AAG TTC-3′。NRF-1正义5′-TTA CTC TGC TGT GGC TGA TGG-3′,反义5′-CCT CTG ATG CTT GCG TCG TCT-3′; TFAM正义5′-GAA AGC ACA AAT CAA GAG GAG-3′,反义5′-CTG CTT TTC ATC ATG AGA CAG-3′; GAPDH正义5′-GGG TCA GAA GGA TTC CTA TG-3′,反义5′-GGT CTC AAA CAT GAT CTG GG-3′。结果以与正常对照组各基因表达水平的倍数值表示。
1.6 蛋白质印迹法测定线粒体融合与分裂相关蛋白根据蛋白定量结果,按照每孔加样量为40 μg蛋白进行上样,并取一泳道加入预染Marker。常规电泳、湿转、牛奶封闭后,分别加入抗Opa-1、Mfn-1、Drp-1和Fis-1的一抗,4℃孵育过夜,对应二抗室温孵育1 h,化学发光,使用Image J软件对压片后各蛋白条带进行分析,计算相对表达量。
1.7 统计学处理采用SPSS 16.0统计软件,计量资料以x±s表示,多组间均数比较使用单因素方差分析(ANOVA),检验水准(α)为0.05。
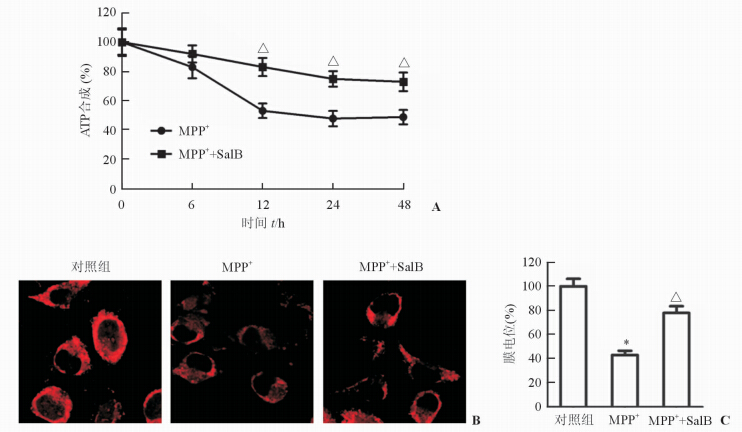
2 结 果 2.1 SalB对MPP+所致PC12细胞线粒体功能损伤的影响结果表明:与PD模型组相比,SalB处理组细胞在损伤后12、24、48 h可显著抑制MPP+所致的PC12细胞线粒体ATP合成能力下降(图 1A)。线粒体膜电位变化检测结果(图 1B、1C)表明:MPP+显著降低PC12细胞线粒体膜电位水平,SalB可抑制MPP+所致线粒体膜电位的降低。
|
图 1 SalB可减轻MPP+所致PC12细胞线粒体功能障碍 A:ATP合成能力的测定;B:线粒体膜电位测定的Rh123染色(Original magnification: ×200);C:线粒体膜电位的测定结果.*P<0.05与正常对照组比较;△P<0.05与PD模型组(MMP+)比较. n=3,x±s |
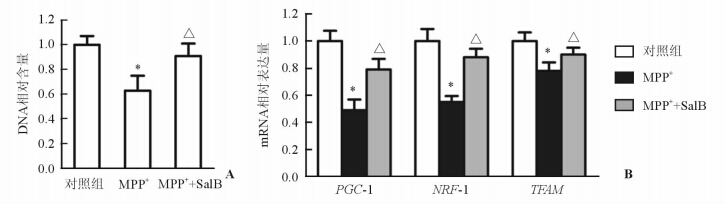
结果(图 2A)表明:MPP+处理后PC12细胞线粒体DNA含量显著降低(P<0.05),SalB可明显抑制线粒体DNA含量的降低(P<0.05)。线粒体生物发生相关基因PGC-1、NRF-1和TFAM的表达结果表明:MPP+处理后PGC-1、NRF-1、TFAM mRNA表达较正常对照组降低,而SalB可明显增加MPP+处理后这些基因的表达(P<0.05)。
|
图 2 SalB保护MPP+处理后线粒体生物发生 A:线粒体DNA含量测定结果;B:线粒体生物发生相关基因的表达.*P<0.05与正常对照组比较;△P<0.05与PD模型组(MMP+)比较. n=3,x±s |
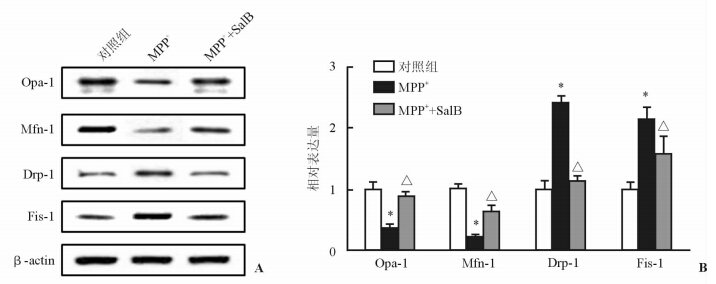
蛋白质印迹检测结果(图 3)表明:MPP+处理后,线粒体融合相关蛋白Opa-1和Mfn-1的表达较对照组降低,而线粒体分裂相关蛋白Drp-1和Fis-1的表达明显增高(P<0.05)。与PD模型组相比,SalB可抑制MPP+所致的Opa-1和Mfn-1的表达降低,并降低Drp-1和Fis-1的表达增加(P<0.05)。
|
图 3 SalB调控MPP+损伤后线粒体融合、分裂相关蛋白表达 A:蛋白质印迹图; B:定量分析结果. *P<0.05与正常对照组比较; △P<0.05与PD模型组(MMP+)比较. n=3,x±s |
线粒体因为在人类疾病中扮演重要角色而受到广泛关注,线粒体功能障碍是PD的重要致病因素之一[11]。线粒体是ROS的重要来源,由于ROS可直接损伤线粒体酶、导致线粒体DNA突变、改变线粒体膜通透性,使得线粒体极易受到氧化应激损伤。多种与PD发生发展相关的重要分子,如PINK1、DJ-1、α突触核蛋白等,均与线粒体的结构或功能密切相关[12]。此外,多种特定的线粒体DNA多态性或单倍型被报道与PD的发病风险相关,而研究发现线粒体DNA或线粒体DNA聚合酶-G的突变可导致帕金森运动障碍[13, 14]。同样,线粒体功能障碍与PD所致神经细胞损伤的相关性也被流行病学资料所证实,这些资料表明许多以线粒体为靶点的神经毒剂可导致PD发生[15]。本研究发现,MPP+处理可造成线粒体膜电位下降和线粒体ATP合成障碍,这些结果表明MPP+所致的PC12细胞损伤与线粒体功能密切相关。
线粒体是细胞能量代谢的重要调节子,较高的线粒体数量和质量被认为对细胞具有保护作用。线粒体ATP合成的增加是评估线粒体功能提高的重要指标,在病理状态下,细胞可通过增加线粒体生物合成来实现ATP合成增加[16]。线粒体生物发生被定义为线粒体的增殖与分裂,可在损伤因素或外界环境刺激下激活,受到多种信号通路的调控[17]。当刺激因素超过阈值时,线粒体电子传递链受到破坏,表现为膜电位下降和ATP合成障碍,进而导致细胞色素C等促凋亡因子释放,Bcl-2家族蛋白表达异常,最终导致细胞凋亡[17]。研究表明,多种核基因编码的特异性转录因子与线粒体生物发生相关,如PGC-1、NRF-1和TFAM等[18]。在本研究中,MPP+处理造成线粒体DNA和这些转录因子表达的明显降低,而SalB可明显逆转这些变化。这些结果强烈提示,SalB对PC12细胞线粒体功能的保护作用很可能与维持线粒体生物发生相关。
线粒体在细胞受到刺激时发生适应性功能调整的重要方式之一是线粒体网络结构的变化,这一过程包括了线粒体分裂和融合两种方式[19]。这些动态的过程在神经细胞中特别重要,因为它们处在漫长的有丝分裂后静止期,具有较高的能量需求。研究表明线粒体分裂和融合相关蛋白的表达异常与中枢神经系统疾病密切相关[20]。在脊椎动物中,多种高相对分子质量GTP酶类,如Opa-1、Mfn-1、Drp-1和Fis-1等,参与了线粒体融合和分裂过程的调控[21]。 这些分子是影响线粒体形态的重要因素,它们还可通过caspase相关的信号途径参与调控细胞凋亡。通过激活Mfn-1或Opa-1的方式抑制线粒体碎裂可减少细胞凋亡,而使用Drp-1的拮抗剂mdivi-1可抑制tBid所致的线粒体细胞色素C释放[22, 23]。在本研究中我们发现,MPP+处理PC12细胞后,Opa-1和Mfn-1表达降低,而Drp-1和Fis-1表达升高,表明损伤后线粒体融合减少而分裂增加。SalB处理可显著拮抗MPP+引起的这些分子表达的变化,说明SalB对PC12细胞线粒体功能的保护作用与其对线粒体融合和分裂过程的调节相关。
综上所述,本研究发现,一种丹参的活性提取成分SalB可显著减轻MPP+所致的PC12细胞线粒体损伤,这种保护作用可能是通过对线粒体生物发生和线粒体融合与分裂相关蛋白的调控而实现。
| [1] | Dexter D T,Jenner P. Parkinson disease: from pathology to molecular disease mechanisms[J].Free Radic Biol Med,2013, 62: 132-144. |
| [2] | Hirsch E C.Mechanism and consequences of nerve cell death in Parkinson's disease[J].J Neural Transm Suppl,1999,56:127-137. |
| [3] | Beal M F. Mitochondria, oxidative damage, and inflammation in Parkinson's disease[J].Ann N Y Acad Sci,2003,991:120-131. |
| [4] | Feng W, Wei H, Liu G T. Pharmacological study of the novel compound FLZ against experimental Parkinson's models and its active mechanism[J].Mol Neurobiol,2005,31(1-3):295-300. |
| [5] | Cao W, Guo X W, Zheng H Z, Li D P, Jia G B, Wang J. Current progress of research on pharmacologic actions of salvianolic acid B[J].Chin J Integr Med,2012,18:316-320. |
| [6] | Tang M K, Ren D C, Zhang J T, Du G H. Effect of salvianolic acids from Radix Salviae miltiorrhizae on regional cerebral blood flow and platelet aggregation in rats[J].Phytomedicine,2002,9:405-409. |
| [7] | Chen T, Liu W, Chao X, Zhang L, Qu Y, Huo J, et al. Salvianolic acid B attenuates brain damage and inflammation after traumatic brain injury in mice[J].Brain Res Bull,2011,84:163-168. |
| [8] | Chen S C, Lin Y L, Huang B, Wang D L, Cheng J J. Salvianolic acid B suppresses IFN-γ-induced JAK/STAT1 activation in endothelial cells[J].Thromb Res,2011,128:560-564. |
| [9] | Wang Z S, Luo P, Dai S H, Liu Z B, Zheng X R, Chen T. Salvianolic acid B induces apoptosis in human glioma U87 cells through p38-mediated ROS generation[J].Cell Mol Neurobiol,2013,33:921-928. |
| [10] | Tian L L, Wang X J, Sun Y N, Li C R, Xing Y L, Zhao H B, et al. Salvianolic acid B, an antioxidant from Salvia miltiorrhiza, prevents 6-hydroxydopamine induced apoptosis in SH-SY5Y cells[J].Int J Biochem Cell Biol,2008,40:409-422. |
| [11] | Abou-Sleiman P M, Muqit M M, Wood N W. Expanding insights of mitochondrial dysfunction in Parkinson's disease[J].Nat Rev Neurosci,2006,7:207-219. |
| [12] | Dodson M W,Guo M.Pink1, Parkin, DJ-1 and mitochondrial dysfunction in Parkinson's disease[J].Curr Opin Neurobiol, 2007, 17:331-337. |
| [13] | Luoma P T, Eerola J, Ahola S, Hakonen A H, Hellstrom O, Kivisto K T, et al., Mitochondrial DNA polymerase gamma variants in idiopathic sporadic Parkinson disease [J].Neurology, 2007,69: 1152-1159. |
| [14] | Pyle A, Foltynie T, Tiangyou W, Lambert C, Keers S M, Allcock L M, et al. Mitochondrial DNA haplogroup cluster UKJT reduces the risk of PD[J]. Ann Neurol, 2005, 57:564-567. |
| [15] | Mandel S, Weinreb O, Amit T, Youdim M B. Mechanism of neuroprotective action of the anti-Parkinson drug rasagiline and its derivatives [J]. Brain Res Brain Res Rev, 2005, 48:379-387. |
| [16] | Zhu J, Wang K Z, Chu C T. After the banquet: mitochondrial biogenesis, mitophagy, and cell survival[J].Autophagy,2013,9: 1663-1676. |
| [17] | Onyango I G, Lu J, Rodova M, Lezi E, Crafter A B, Swerdlow R H. Regulation of neuron mitochondrial biogenesis and relevance to brain health [J]. Biochim Biophys Acta, 2010, 1802: 228-234. |
| [18] | Kroemer G. Mitochondrial control of apoptosis: an overview[J].Biochem Soc Symp, 1999, 66:1-15. |
| [19] | Szabadkai G, Simoni A M, Chami M, Wieckowski M R, Youle R J, Rizzuto R. Drp-1-dependent division of the mitochondrial network blocks intraorganellar Ca2+ waves and protects against Ca2+-mediated apoptosis[J]. Mol Cell,2004,16:59-68. |
| [20] | Van Laar V S, Berman S B. Mitochondrial dynamics in Parkinson's disease[J]. Exp Neurol, 2009, 218: 247-256. |
| [21] | Martinou J C, Youle R J. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J].Dev Cell,2011,21: 92-101. |
| [22] | Otera H, Ishihara N, Mihara K. New insights into the function and regulation of mitochondrial fission[J].Biochim Biophys Acta, 2013,1833:1256-1268. |
| [23] | Lackner L L, Nunnari J. Small molecule inhibitors of mitochondrial division: tools that translate basic biological research into medicine[J]. Chem Biol, 2010, 17:578-583. |
 2015, Vol. 36
2015, Vol. 36


