2. 广州中医药大学附属广东省中医院泌尿外科, 广州 510120;
3. 英德市人民医院泌尿外科, 英德 513000
2. Department of Urology, Guangdong Provincial Hospital of Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510120, Guangdong, China;
3. Department of Urology, Yingde People's Hospital, Yingde 513000, Guangdong, China
泌尿系结石(urolithiasis)是与遗传、环境和饮食习惯等多因素相关的疾病,高发病率和高复发率是临床面对的两大挑战[1, 2, 3]。增加液体的摄入能降低尿液中致石因子的浓度,预防结石形成[4]。但饮用水的质量高低又直接关系到结石的形成与否。水质硬度是指饮用水中钙、镁离子的摩尔总和,其中钙离子起主要作用,以CaCO3计算,软水中CaCO3含量为40×10-6(Ca2+:18 mg/L,Mg2+:22 mg/L),而硬水中CaCO3含量为440×10-6(Ca2+:195 mg/L,Mg2+:244 mg/L)[5]。有研究发现增加饮用水硬度能预防泌尿系结石形成[6],但也有研究表明增加饮用水硬度可增加结石形成风险[7, 8],饮用水硬度对结石形成究竟起促进作用还是抑制作用,目前仍有争议。本研究拟通过观察低于硬水标准下不同钙、镁浓度比例饮用水对相对高草酸尿症大鼠肾草酸钙结石成石及代谢的影响,探讨饮用水中钙、镁离子在高草酸尿症环境下的成石效应。
1 材料和方法 1.1 动物分组及造模SPF级雄性Sprague-Dawley大鼠(180~220 g)42只,购于广东省医学实验动物中心[动物生产许可证号:SCX(粤)2013-0002];不同钙、镁浓度比例饮用水,由英德市人民医院提供,经韶关市质监局鉴定。大鼠适应性饲养1周后,按照随机数字表法将其随机分成7组:空白组、模型组、高钙低镁组、中钙低镁组、低钙低镁组、低钙中镁组和低钙高镁组,每组6只。空白组大鼠饮用纯净水,高草酸尿症模型组大鼠采用经典乙二醇(ethylene glycol,EG)诱导,浓度为0.1%饮用水。干预组大鼠在模型组基础上给予不同钙、镁浓度比例的饮用水,高钙低镁组、中钙低镁组、低钙低镁组、低钙中镁组、低钙高镁组钙镁浓度比分别为360/10、120/10、10/10、10/40、10/80(mg/L)。各组大鼠在相同环境下(25℃空调恒温,12 h白昼循环)饲养,给予相同的标准颗粒饲料自由进食。动物使用符合动物保护有关条例,并通过广东省中医院伦理委员会审核。
1.2 标本收集和检测实验第8周后先收集3 h晨尿检测尿结晶,再收集24 h尿液(预先加入0.02%叠氮化钠预防细菌生长),测定尿量、pH值后将尿液分成2份,用离心机以1 500 r/min(r=6 cm)离心10 min除去杂物,其中1份尿液标本加入1 mol/mL HCl (20∶1稀释)酸化至pH=2.0,待测 尿草酸及尿枸橼酸,另一份未经酸化处理的尿液标本用全自动生化分析仪检测尿钙、尿镁。大鼠经10%水合氯醛腹腔内注射麻醉,经腔静脉采血2~4 mL,全自动生化分析仪检测血肌酐、尿素氮、血钙、血镁。用4℃生理盐水经腹主动脉原位灌注冲洗肾脏,冲洗干净后摘取肾脏,无菌滤纸吸干水分,称质量,左肾用4%多聚甲醛固定,常规作H-E染色、石蜡切片,偏光显微镜镜下观察肾组织草酸钙结晶情况。
1.3 尿草酸及尿枸橼酸测定 1.3.1 样品前处理精密量取样品尿液1 mL,HCl酸化调节至pH=2.0,样品以12 000 r/min(r=6 cm)高速离心10 min,取上清液定容至25 mL,经过Cleanert IC-RP柱和0.22 μm尼龙滤膜过滤,即可得到供试品。
1.3.2 色谱条件采用高亲水性、高柱容量的Dionex IonPac AS11(250 mm×4 mm)阴离子分析柱,Dionex IonPacAG11-HC (50 mm×4 mm)阴离子保护柱,以氢氧化钠溶液为淋洗液,梯度淋洗,速度1.2 mL/min,每次进样25 μL。
1.3.3 标准品溶液的配制及标准曲线的绘制分别精密称取优级纯草酸、枸橼酸适量,以超纯水分别配制成草酸根离子、枸橼酸根离子浓度均为2.0 mg/mL的储备液。精密量取上述2种储备液各1份,置同一10 mL量瓶,以超纯水稀释至刻度,摇匀,即得草酸根离子、枸橼酸根离子浓度分别为2.89、5.78、11.56、14.45、28.9、57.8 μg/mL和 25.895、51.79、103.58、129.475、258.95、517.9 μg/mL 的2种离子的混合标准溶液。草酸标准曲线相关系数r=0.999 9,枸橼标准曲线r=0.999 7,草酸和枸橼峰值下面积和其浓度呈良好的线性关系(图 1)。
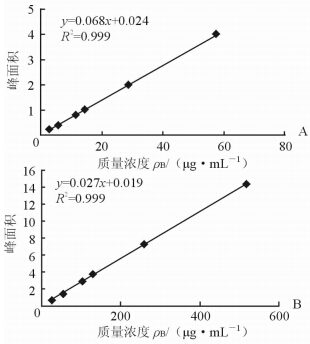
|
图 1 离子色谱法测定24 h尿草酸(A)、24 h尿枸橼酸(B)浓度的标准曲线 |
取B12尿液样品0.5 mL (含草酸根离子129.24 μg/mL)于5 mL离心管中,平行5份,HCL酸化调节pH=2.0,加入适量草酸标准溶液(含草酸根离子64.62 μg)。取C13尿液样品0.5 mL(含枸橼酸根离子273.58 μg/mL)于5 mL离心管中,平行5份,HCL酸化调节pH=2.0,加入适量枸橼酸标准溶液(枸橼酸根离子浓度136.92 μg)。按上述方法、色谱条件进行测定,草酸根、枸橼酸根离子的平均回收率分别为100.53%、104.26%。
1.3.5 草酸、枸橼酸浓度计算标准品尿样本峰值出现时间基本一致,峰与峰间分离良好,未见拖尾现象(图 2)。根据线性回归方程分别将草酸及枸橼酸的峰下面积转化为草酸浓度。24 h尿草酸排泄量(mg/24 h)=尿草酸浓度(mg/mL)×24 h尿量(mL);24 h尿枸橼酸排泄量(mg/24 h)=尿草酸浓度(mg/mL)×24 h尿量(mL)。
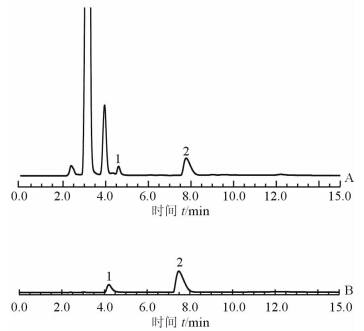
|
图 2 离子色谱法测定草酸、枸橼酸样品(A)及标准品(B)的峰图 1:草酸;2:枸橼酸 |
采用PASW18.0软件进行统计学分析,数据以 x±s 表示,多组间均数的比较采用方差分析(ANOVA),检验水准(α)为0.05。
2 结 果 2.1 大鼠一般及血液生化指标的比较结果(表 1)表明:低钙低镁组、低钙中镁组大鼠肾质量均较模型组大鼠增加(P<0.05),低钙中镁组大鼠血尿素氮较空白组、模型组大鼠增加(P<0.05)。各组大鼠体质量变化、摄水量、24 h尿量、血钙、血镁和血肌酐等的比较差异无统计学意义。
|
|
表 1 不同钙、镁比例饮用水干预8周后大鼠一般情况及血液生化指标的比较 |
结果(图 3)表明:低钙中镁组大鼠24 h尿镁排泄量较空白组增加(P<0.05)。24 h尿草酸排泄量方面,模型组、低钙低镁组、低钙中镁组、中钙低镁组较空白组增高(P<0.01或P<0.05);与模型组比较,除低钙低镁组外,其余干预组24 h尿草酸排泄量均低于模型组(P<0.01)。干预组随钙镁含量增高,24 h尿草酸排泄逐渐减少,组间比较差异无统计学意义。尿钙、24 h尿枸橼酸排泄各组间比较差异无统计学意义。
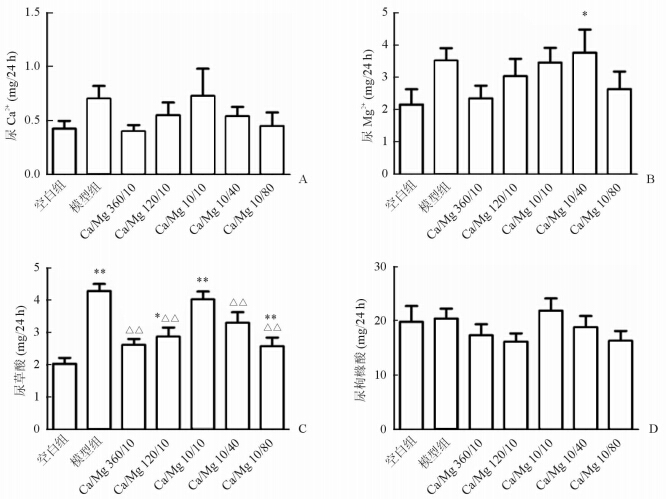
|
图 3 各组大鼠24 h尿钙(A)、尿镁(B)、尿草酸(C)、尿枸橼酸(D)排泄量的比较 *P<0.05,**P<0.01与空白组比较; △△P<0.01与模型组比较. n=6,x±s |
各组尿结晶均为阴性。结果(图 4)表明:各组肾组织病理学检查均未见结晶形成,肾小球、肾小管细胞大小正常,排列整齐、规则,肾小管管腔无扩张,管腔内无坏死脱落样物质。

|
图 1 各组大鼠尿结晶及肾脏显微镜下H-E染色图 Original magnification: ×100 |
肾结石的形成是多因素多步骤的缓慢过程,与遗传、环境、膳食结构、饮用水、地理因素等密切相关,而饮用水中所含矿物质和饮水量对结石的形成有重要影响[4]。水质硬度是指饮用水中钙、镁离子的总和,其中钙离子起主要作用,主要指CaCO3含量。软水定义为Ca2+、Mg2+含量低于40×10-6 (Ca2+:18 mg/L,Mg2+:22 mg/L),而硬水Ca2+、Mg2+含量大于440×10-6(Ca2+:195 mg/L,Mg2+:245 mg/L)[5]。广东粤北结石高发的石灰岩地区水质硬度检测(二胺四乙酸二钠容量法)显示其硬度为560.0~681.4 mg/L(韶关市质监局提供),而这显著高于东北长春地区水质硬度[Ca2+: (90.49±103.93) mg/L,Mg2+: (31.37± 41.19) mg/L][9]。Coen等[7]研究发现低钙饮用水组(钙含量<20 mg/L)受试者肾草酸钙结石风险指数显著低于高钙饮用水组(钙含量370 mg/L),提示低钙含量饮用水更适合用于预防肾结石的形成及复发。Bellizzi等[8]也通过随机对照试验发现与软水(Ca2+:22 mg/L)相比,硬水(Ca2+:225 mg/L)能够显著提高尿钙浓度,从而增加肾结石患病风险。相反的结论却出现在Rodgers等[6]的临床研究中。Curhan等[10]发表的一项前瞻性研究调查了45 619例男性,通过4年的随访发现,高钙饮食反而降低了肾结石的发生率。饮用水的硬度对结石形成究竟起促进作用还是抑制作用?由于4篇临床研究设计观察的时间、人群分组、干预组钙镁总量(水的硬度)均不一致,所以不能仅就结论比较。基于此我们设计低于硬水标准下的不同钙镁比例大鼠饮用水,最高硬度370 mg/L (Ca2+:360 mg/L;Mg2+:10 mg/L),钙镁比例分别为360/10、120/10、10/10、10/40、10/80 (mg/L),以观察不同硬度水及钙镁比例对相对高草酸尿症大鼠结石形成及代谢的影响。
高草酸尿是草酸钙结石形成最主要的危险因素[11]。为了减少高浓度高草酸尿及造模导致肾脏氧化损伤对成石及代谢的干扰,我们首次采用浓度为0.1%乙二醇饮用水造模,形成一个相对高草酸尿症但肾脏无结石结晶形成,肾脏无氧化损伤,各项生理、生化指标正常的模型大鼠,而不同于经典全量草酸钙结石造模(1%乙二醇饮水+2%氯化铵 2 mL/d灌胃)。在这种模型下观察不同钙镁比例的饮用水对相对高草酸尿症大鼠成石及相关风险指标的影响,更能显示钙镁比例单独作用的权重,又接近人体成石的机制和规律。研究结果显示:造模组与空白组比较大鼠肾脏质量、24 h尿量、饮水量、尿钙、尿镁、血钙、血镁、血肌酐、尿素氮差异均无统计学意义;肾脏病理显示:空白组和造模组均未见结晶形成,肾组织无病理学异常表现;24 h尿草酸方面,造模组(4.28±0.54) mg/24 h高于空白组(2.16±1.17) mg/24 h(P<0.01),说明采用低浓度0.1%乙二醇饮水诱导造模达到实验要求。而这种造模下高草酸尿水平低于经典草酸钙结石造模的高草酸尿水平[(10.51±3.93) mg/mL][12]。
由于草酸在草酸钙结石形成中的作用比钙作用大10倍以上[13],所以不同钙镁比例饮用水对草酸代谢的影响是本研究观察的重点指标。研究显示:除低钙低镁组(Ca2+/Mg2+=10/10,饮用水硬度为20 mg/L<40 mg/L,属于软水)以外,其余各组24 h尿草酸排泄量均显著低于模型组(P<0.01),说明水的硬度可以影响草酸代谢。干预组随着饮用水钙镁含量(硬度)的升高,大鼠24 h尿草酸排泄量依次减少。这个规律与Massey等[14]研究显示的结石患者摄入低钙即低硬度饮食时,尿液草酸的排泄量会增加是一致的。由此可见,低钙饮食患者结石复发率高的原因可能与继发性高草酸尿症有关。大鼠24 h尿钙及血钙、血镁水平各组间没有统计学差异,说明相对高草酸尿造模、低于硬水标准的不同钙、镁比例饮用水均不影响大鼠钙镁代谢。Kohri等[15]通过体外晶体抑制实验研究了镁对不同浓度草酸钙结晶的抑制作用,镁可抑制低于2 mmol/L浓度的草酸钙结晶生长,但在高浓度下,却可促进草酸钙结晶的生长。结合本研究结果分析高草酸浓度或量必须达到结晶水平且结晶体浓度也要达到一定饱和度,钙镁的增加才会成为结石的促进因素。本研究低钙中镁组虽较空白组尿镁升高(P<0.05),但在其他干预组均并未见类似结果,说明尿镁升高的结论还不能确定,不排除可能为实验误差。对大鼠24 h尿枸橼酸排泄量的研究显示各组大鼠之间差异均无统计学意义,表明尿枸橼酸作为结石的保护因素之一,它是相对独立的,不会受高草酸尿造模及不同钙、镁比例饮用水的影响。
尿结晶结果显示各组均未见尿结晶形成,肾脏病理学检查也未见草酸钙结晶形成。前期研究[12]采用1%乙二醇灌胃形成大鼠肾草酸钙结石模型,检测尿结晶及肾脏结石形成。1%乙二醇造模大鼠尿草酸浓度[(10.51±3.93)mg/mL]显著高于本次研究造模(0.1%乙二醇)大鼠尿草酸浓度。因此,我们认为尽管高草酸尿症被公认为是草酸钙结石形成的高危促进因素且作用大于Ca2+,但只有在草酸浓度升高到一定水平时才能显示其成石作用。Robertson等[16]的研究也显示轻度高草酸尿症比轻度高钙尿症更为危险,因为尿液草酸的浓度与尿液草酸钙结晶的过饱和水平有关,尿液草酸浓度的增加对于改变尿液草酸钙饱和水平的影响比尿钙浓度增加的作用大15倍。
综上所述,本研究首次观察低于硬水标准的不同钙镁比例饮用水对相对高草酸尿症大鼠成石及代谢的影响,在结石形成这个复杂的多因素相互影响的缓慢过程中,相对高草酸尿症造模[(4.28±0.54)mg/24 h]对大鼠体内钙和镁的代谢、尿结晶及成石没有影响;在饮用水硬度低于硬水标准下,水的硬度影响24 h尿草酸排泄,随钙镁总量(硬度)升高24 h尿草酸排泄量减低;单纯高草酸尿症成石需草酸浓度或量达到一定水平才能显示钙镁的成石作用;而尿枸橼酸作为结石的保护性因素,它是相对独立的,不受造模及不同钙、镁比例饮用水影响。由于结石形成是一个多环节、长期的病理过程,我们的研究需要在高于硬水标准、高草酸尿浓度标准、干预时间等方面进一步设计研究。
| [1] | Coe F L, Evan A, Worcester E. Kidney stone disease[J].J Clin Invest,2005,115:2598-2608. |
| [2] | Pearle M S, Calhoun E A, Curhan G C. Urologic diseases in America project: urolithiasis[J]. J Urol, 2005, 173:848-857. |
| [3] | Edvardsson V O, Indridason O S, Haraldsson G, Kjartansson O, Palsson R. Temporal trends in the incidence of kidney stone disease[J].Kidney Int,2013,83:146-152. |
| [4] | Ferrari P, Piazza R, Ghidini N, Bisi M, Galizia G, Ferrari G. Lithiasis and risk factors[J].Urol Int, 2007,79 Suppl 1:8-15. |
| [5] | Schwartz B F, Schenkman N S, Bruce J E, Leslie S W, Stoller M L. Calcium nephrolithiasis: effect of water hardness on urinary electrolytes[J].Urology,2002,60:23-27. |
| [6] | Rodgers A L.The influence of South African mineral water on reduction of risk of calcium oxalate kidney stone formation[J].S Afr Med J,1998,88:448-451. |
| [7] | Coen G, Sardella D, Barbera G, Ferrannini M, Comegna C, Ferazzoli F, et al. Urinary composition and lithogenic risk in normal subjects following oligomineral versus bicarbonate-alkaline high calcium mineral water intake[J].Urol Int,2001,67:49-53. |
| [8] | Bellizzi V, De Nicola L, Minutolo R, Russo D, Cianciaruso B, Andreucci M, et al. Effects of water hardness on urinary risk factors for kidney stones in patients with idiopathic nephrolithiasis[J].Nephron,1999,81 (Suppl 1):66-70. |
| [9] | 崔 博,陈岐辉,董世娜,郑学清.吉林省尿石症高发地区饮用水微量元素及主要阴离子检测[J].吉林大学学报:医学版,2010,36:599-601. |
| [10] | Curhan G C, Willett W C, Rimm E B, Stampfer M J. A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones[J].N Engl J Med,1993,328:833-838. |
| [11] | Tiselius H G. Epidemiology and medical management of stone disease[J].BJU Int, 2003,91:758-767. |
| [12] | 向松涛,周建甫,甘 澍,荣向路,李 静,王树声.广金钱草水提取液对大鼠肾草酸钙结石形成的影响[J].中华实验外科杂志,2013,30:1166. |
| [13] | Patel P K, Patel M A, Vyas B A, Shah D R, Gandhi T R. Antiurolithiatic activity of saponin rich fraction from the fruits of Solanum xanthocarpum Schrad. & Wendl. (Solanaceae) against ethylene glycol induced urolithiasis in rats[J].J Ethnopharmacol,2012,144:160-170. |
| [14] | Massey L K, Sutton R A. Modification of dietary oxalate and calcium reduces urinary oxalate in hyperoxaluric patients with kidney stones[J].J Am Diet Assoc,1993,3:1305-1307. |
| [15] | Kohri K, Garside J, Blacklock N J. The role of magnesium in calcium oxalate urolithiasis[J].Br J Urol,1988,61:107-115. |
| [16] | Robertson W G, Hughes H. Importance of mild hyperoxaluria in the pathogenesis of urolithiasis——new evidence from studies in the Arabian peninsula[J].Scanning Microsc,1993,7:391-401. |
 2015, Vol. 36
2015, Vol. 36


