2. 第二军医大学东方肝胆外科医院基因-病毒治疗实验室, 上海 200438
2. Laboratory of Viral and Gene Therapy, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
肝内胆管癌(ICC)是指起源于肝内小胆管(包括二级胆管)的胆管上皮细胞恶性肿瘤,胆管癌恶性程度高,手术难度大,术后易复发,远期疗效差[1]。淋巴结转移是影响肝内胆管癌预后的最重要因素之一[2, 3],血清肿瘤标记物也被认为是影响预后的重要因素[4, 5]。肿瘤大小对预后的影响仍有争议,有学者认为R0切除以5 mm为临界值分组,肿瘤大小对预后没有影响[6]。分期系统对肿瘤大小界定以及对预后的影响,也存在争议[7, 8, 9]。目前针对术后指标对手术预后的影响报道很少。 因此,本研究回顾性分析2009年3月至2014年3月本院189例行肝脏切除手术的肝内胆管癌患者的临床资料,从患者一般情况、肿瘤特点及术前术后肝功能最常见6项指标(总胆红素、直接胆红素、白蛋白、丙氨酸转氨酶、碱性磷酸酶、γ-谷氨酰转移酶)着手,探讨影响肝内胆管癌切除术后患者生存率的危险因素,为后续研究奠定基础。
1 资料和方法选取我院2009年3月至2014年3月行肝脏根治性切除手术的肝内胆管癌患者共412例,术后均经病理报告明确诊断。排除围手术期死亡患者(本研究统计病例实际无围手术期死亡患者),排除病理结果混合型肝癌,指标缺失超过5项以及失访(电话失去联系或拒绝回答)的患者,随访病例的死亡原因均为外科因素(非其他疾病,如心脏疾病等),最终入组患者为189例。所有患者术前均被告知本研究相关情况及所需要记录的检查指标,均签署知情同意书,后定期随访。患者入组及随访情况见图 1。
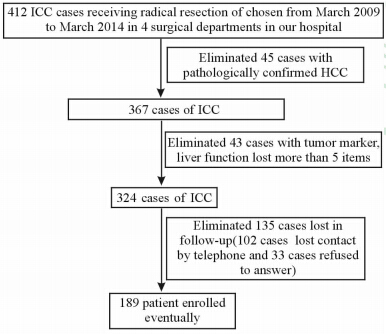
|
图 1 患者入组标准及数据删失情况 Fig 1 Inclusion criteria and censored data of the patients |
所有患者均行术前实验室检查,包括乙肝三抗、丙肝抗体、肝功能检查(包括白蛋白、总胆红素、直接胆红素、丙氨酸转氨酶、γ-谷氨酰转移酶、碱性磷酸酶等)、肿瘤指标(包括CEA、CA19-9)等。术后1、3、5 d均行肝功能检查。将术前白蛋白记为Albumin,术后1、3、5 d白蛋白分别为Albumin 1,Albumin 3,Albumin 5。总胆红素(TBIL 1,TBIL 3,TBIL 5)、直接胆红素(DBIL 1,DBIL 3,DBIL 5)、 丙氨酸转氨酶(ALT 1,ALT 3,ALT 5)、γ-谷氨酰转移酶(GGT 1,GGT 3,GGT 5)、碱性磷酸酶(AKP 1,AKP 3,AKP 5)同样按此方法规定。
1.3 影像学检查术前主要通过B超、计算机X线断层摄影(CT)、磁共振成像(MRI)、磁共振胰胆管成像(MRCP)、内窥镜胰胆管逆行造影(ERCP)、经皮肝穿刺胆管造影(PTCD)、PET-CT排除远处转移等诊断,以病理诊断作为确诊标准。本研究中所分析的病理特点包括肿瘤个数、肿瘤大小、肿瘤分化、淋巴结转移。
1.4 生存时间及随访总生存时间(OS)是本研究唯一的终点指标,随访采用电话回访。随访截止时间为2015年1月15日,生存时间为手术日期到死亡日期或随访截止时间。
1.5 统计学处理采用SPSS 21.0软件进行统计分析,对于单因素为连续性变量的分组,其中肿瘤指标临界值采用正常范围最大值,其他单因素使用X-tile软件分组,该软件分析连续性变量,找寻出最佳临界值分组单因素。 用Kaplan-Meier方法计算生存率,Log-Rank法检验各影响因素是否具有统计学意义。将单因素分析中有统计学意义的影响因素进行双变量相关性分析:有相关性的因素,选取其中一个。将这些差异有统计学意义且不具有相关性的影响因素纳入Cox风险回归模型进行多因素分析,评估影响预后的危险因素。危险因素的影响程度用风险比(hazard ratio,HR)表示。 检验水准(α) 为0.05。
2 结 果 2.1 随访情况共随访189例患者,随访时间截止于2015年1月15日。死亡84例,存活105例。患者中位年龄57岁,中位生存时间17.5个月,术后1、3年生存率分别为78.84%、12.90%。
2.2 手术切除前后各项临床指标与预后的相关性分析单因素分析结果(表 1)表明:患者性别、年龄、肿瘤分化程度、白蛋白、术前总胆红素、术前直接胆红素以及术前丙氨酸转氨酶对预后无明显影响,而肿瘤指标、肿瘤个数、肿瘤大小及淋巴结转移情况,术后1、3、5 d总胆红素、直接胆红素、丙氨酸转氨酶,术前及术后1、3、5 d的γ-谷氨酰转移酶与碱性磷酸酶影响胆管癌切除患者术后预后(P<0.05)。
|
|
表 1 肝内胆管癌患者基本临床情况以及预后相关因素的单因素分析 Tab 1 Clinical data of 189 intrahepatic cholangiocarcinoma patients and univariate analyses of factors of overall survival after radical excision |
分析结果表明:总胆红素与直接胆红素每一次检查均具有相关性;术后第1天(TBIL 1)与术后第3天(TBIL 3)相关(r=0.867,P<0.001),并与术后第5天(TBIL 5)相关(r=0.772,P<0.001)。丙氨酸转氨酶术后第1天(ALT 1)与术后第3天(ALT 3)相关(r=0.867,P<0.001),术后第5天(ALT 5)与其他时间无相关性(r<0.600,P<0.001);γ-谷氨酰转移酶与碱性磷酸酶术后每次的检查结果均具有相关性,选取γ-谷氨酰转移酶,γ-谷氨酰转移酶术前(GGT)与术后第1天(GGT1)相关(r=0.800,P<0.001),并与术后第3天(GGT3)相关(r=0.673,P<0.001)。
2.4 多因素分析结果进入Cox模型的单因素为:肿瘤个数、肿瘤大小、淋巴结转移、CA19-9、TBIL 1、ALT 1、ALT 5、GGT、GGT 5,这9个因素间无相关性。影响预后的Cox模型多因素分析:将9个对预后有影响的因素通过Cox模型进行多因素分析,结果显示CA19-9、肿瘤个数、肿瘤大小、淋巴结转移、术后第1天总胆红素(IBIL1)、术后第5天丙氨酸转氨酶(ALT 5)以及术前谷氨酰胺酶(GGT)是影响预后的独立因素(表 2,图 2)。
|
|
表 2 预后有关因素的多变量分析 Tab 2 Multivariate analyses of factors related to overall survival of intrahepatic cholangiocarcinoma patients after radical excision |
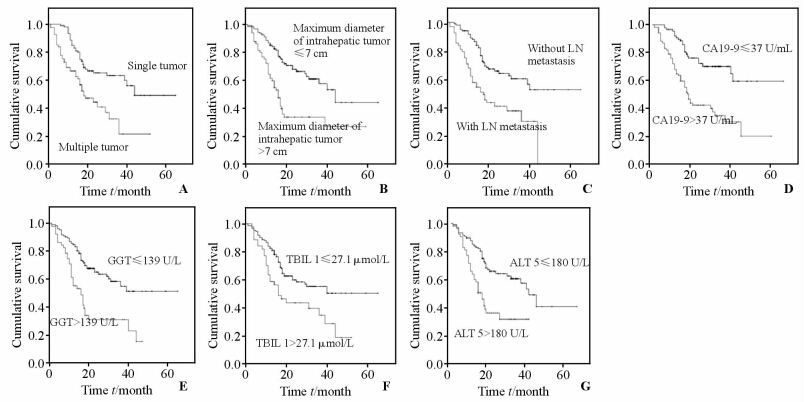
|
图 2 各相关因素对患者总生存时间的影响 Fig 2 Independent predictors of overall survival (OS) of patients with intrahepatic cholangiocarcinoma after radical excision A: OS in patients with single and multiple tumors; B: OS in patients with maximum diameter of intrahepatic tumor (s) ≤7 cm and >7 cm; C: OS in patients without and with lymph node (LN) metastasis; D: OS in patients with CA19-9 > 37 U/mL and with CA19-9≤37 U/mL; E: OS in patients with GGT≤139 U/L and with GGT>139 U/L; F:OS in patients with TBIL 1≤27.1 μmol/L and TBIL 1>27.1 μmol/L; G: OS in patients with ALT 5≤180 U/L and ALT 5>180 U/L |
ICC是一类恶性程度很高的原发性肝脏肿瘤。外科手术切除是胆管癌患者获得长期生存的唯一治疗措施,由于ICC患者没有特殊的临床症状,早期诊断率低,发现时多为晚期,导致其手术切除率低。但造成ICC患者术后生存率低的原因目前还不清楚。因此,了解影响胆管癌切除术后患者生存率的预后因素显得极为重要。根据国内外学者报道,肝内胆管癌预后与诸多因素相关,包括肿瘤组织类型、肿瘤内微血管密度、肿瘤大小、分化、胆管侵犯类型、是否血管侵犯、是否远处转移、治疗方式等[10, 11]。
有文献报道,多发肿瘤会导致不良预后[12]。AJCC癌症分期手册(7版)中明确指出,肿瘤数目对预后有直接影响。本研究中,多发肿瘤有83例,多因素分析显示肿瘤数目是预后的独立影响因素。淋巴结转移也是ICC患者预后的独立影响因素,与其他研究[13, 14]结果一致。ICC肿瘤直径,多种分期系统对其存在争议,LCGSJ分期认为直径大于2 cm、肿瘤多发均是影响ICC预后的独立危险因素[7]。AJCC提出的6版TNM分期系统认为肿瘤直径大于5 cm的ICC患者预后较差,但这个分期系统是基于HCC的数据来制定的,对ICC的适用范围有限[8]。也有其他研究则认为肿瘤直径并不是影响预后的独立危险因素[8, 9]。这些分期系统的主要分歧在于是否将肿瘤大小作为ICC分期的参考指标,以及如果作为参考指标,这一临界值该如何界定的问题。本研究对象为肝内胆管癌根治性切除患者,针对根治性切除手术的肿瘤大小,本研究使用X-tile软件分组,临界值为7 cm时分组所得P值为最佳P值,可以看到,以7 cm分组,行肝内胆管癌根治性切除患者肿瘤大小不论在单因素分析还是多因素分析中均有意义。
本研究结果发现CA19-9与预后有关,CA19-9是一种高分子糖蛋白,抗原决定簇为含唾液酸的神经节苷脂,胆管癌患者中血清CA19-9升高(>37 U/mL)的敏感性、特异性分别为88.15%、92%,对胆管癌患者的诊断有较高价值,且血清CA19-9在监测术后复发中也具价值。多项研究表明,CA19-9是胆管癌(包括ICC)预后的独立危险因素[1]。碱性磷酸酶和γ-谷氨酰转移酶是肝脏胆管疾病的敏感指标[15],也是肝内胆管癌的预后指标[16]。
有研究表明,胆管癌术前高胆红素是影响预后的重要因素[17, 18]。本研究可能因根治性切除患者病情处于相对早期或中期,肝脏一般情况相对较好,少数患者术前有黄疸,也减黄至了胆红素较低的水平,所以术前胆红素对预后无影响。白蛋白由肝脏合成,可以反映肝脏功能,但术前患者一般情况可,术后一般均有补充白蛋白,所以检测的白蛋白结果不仅由肝脏合成,还有外界直接输入人体的白蛋白,因此我们单因素分析显示白蛋白不是影响预后的因素。对于胆红素及酶类的分组,本研究仍采用X-tile找寻临界值的方法,肝功能临床所用临界值主要用于肝损伤的标记,但关于预后可能有其他影响肝功能的因素,X-tile找寻临界值,可以最大限度发现和预后有关的因素。肝功能相对肿瘤指标临床意义不同,所指的临床结果不同,所以我们对于肿瘤指标所取临界值,以临床规定的临界值为准,而对于肝功能的临界值,若以临床临界值判定,那么对预后的判断可能会有差别。
肿瘤术后肝转氨酶和总胆红素升高是影响患者康复的重要因素。肝脏手术会造成肝脏损伤,导致胆红素和转氨酶升高。主要损伤肝功能的原因为:(1)输血造成血细胞破坏,此外滞留于创面及腹腔内的血细胞破坏、吸收,也可使血清胆红素升高。(2)虽然是胆管细胞癌,但手术切除肝脏肿瘤,会切除部分有功能的肝细胞,缝合、结扎的压迫使部分肝组织缺血坏死,肝细胞数量减少;肝脏部分切除术后,肝内毛细胆管和小胆管结扎,缝合,扭曲变形,引起肝内胆道梗阻;周围肝组织水肿压迫使胆汁排泄不畅,导致血清胆红素升高。(3)在复杂的肝脏外科手术中,为有效控制术中出血,不可避免地需要阻断入肝血流,但随着肝脏血流阻断时间延长,肝门开放后就会损害残肝增殖修复能力,引起缺血再灌注损伤[19]。同样,术中大量失血导致有效循环血量不足,致使肝脏血流灌注不足,肝组织缺血缺氧,降低了肝细胞解毒功能,大量输血又导致缺血再灌注损伤,加重肝功能损害[20]。(4)低血压可使交感神经兴奋而加重损伤,有研究证实抑制交感神经可减轻肝损伤,有利于卵圆细胞集聚和肝细胞再生修复[22]。虽然术中出血量与术后黄疸相关系数较低,但出血愈多,造成机体电解质紊乱和体内肝细胞营养因子丢失概率愈高。出血可以在术中或术后通过输血补充,但肝细胞营养因子只能通过机体内部合成,如肝细胞生长因子(HGF)、转化生长因子α(TGF-α)、表皮生长因子受体(EGFR)均与肝脏损伤后再生修复有关[22];(5)肠外营养(基本在术后)虽能提供机体所需要的能量,但在一定程度上会造成肝损伤[23]。此外,有研究表明,异体输血不仅会升高胆红素,且存在免疫抑制,这会导致肿瘤易复发,预后不良等[24, 25]。
本研究显示,单因素分析术后1、3、5 d胆红素均与预后有关,但相关性分析显示,这3个时间点的胆红素具有相关性。血清胆红素是一个反映肝功能、体内溶血以及肝外梗阻等机体异常状态的一项指标,尚不十分敏感,不能及时反映肝功能变化,掌握患者术后肝功能变化尚不能离开转氨酶的评估。一般认为,肝脏切除术的缺血再灌注损伤会造成转氨酶迅速升高[13],肝脏切除术后转氨酶一般都会升高,且多在术后24 h达到峰值,并在术后6~7 d下降至接近术前水平。丙氨酸转氨酶主要存在于肝细胞胞质中,因其在肝内活性高,只要有1%的肝细胞破坏,即可使血清中丙氨酸转氨酶升高,故为反映急性肝功能损害的最敏感指标。本研究术后丙氨酸转氨酶第1天最高,后逐渐下降,由此可推测,术后肝功能在逐渐恢复(入组患者术后均为出现肝衰竭,不存在“胆酶分离”等情况)。此外,针对肝脏手术,可以尽量减少肝脏的创伤,如术中尽量减少残余肝组织量的丢失,尽量减少失血量,控制间歇性入肝血流阻断时间,尽量减小肝脏创面等,可以减少肝细胞受损以及肝内各级胆管受破坏。
本研究在对患者的长期随访中,损失了135例(其中电话失去联系102例,拒绝回答33例),损失率为32.77%,可能会造成失访偏倚。43例患者因指标缺失(术前术后肝功能指标缺失大于5项)而排除入组,损失率为10.44%,可能会造成选择偏倚。肿瘤大小、直径、淋巴结转移情况及术前CA19-9、γ-谷氨酰转移酶是胆管癌预后的重要因素。同样,术后肝功能情况(术后第1天的总胆红素和术后第5天的丙氨酶转氨酶)也是胆管癌预后的重要因素。术中尽量减少对肝脏的创伤,减少对肝内小胆管、毛细胆管的破坏,如尽量减少切除的正常肝组织,尽量减小创面、减少术中出血,控制间歇性入肝血流阻断时间,围手术期加强保肝治疗,尽早行肠内营养,均可改善预后。
| [1] | Ohtsuka M, Ito H, Kimura F, Shimizu H, Togawa A, Yoshidome H, et al. Results of surgical treatment for intrahepatic cholangiocarcinoma and clinicopathological factors influencing survival[J].Br J Surg,2002,89:1525-1531. |
| [2] | Yamashita Y, Taketomi A, Morita K, Fukuhara T, Ueda S, Sanefuji K, et al. The impact of surgical treatment and poor prognostic factors for patients with intrahepatic cholangiocarcinoma: retrospective analysis of 60 patients[J].Anticancer Res, 2008,28(4C): 2353-2359. |
| [3] | Uenishi T, Kubo S, Yamazaki O, Yamada T, Sasaki Y, Nagano H, et al. Indications for surgical treatment of intrahepatic cholangiocarcinoma with lymph node metastases[J].J Hepatobiliary Pancreat Surg,2008,15:417-422. |
| [4] | Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Surgical outcome and prognostic factors in intrahepatic cholangiocarcinoma[J].World J Surg,2008,32:2675-2680. |
| [5] | Morimoto Y, Tanaka Y, Ito T, Nakahara M, Nakaba H, Nishida T, et al. Long-term survival and prognostic factors in the surgical treatment for intrahepatic cholangiocarcinoma[J].J Hepatobiliary Pancreat Surg,2003,10:432-440. |
| [6] | Murakami S, Ajiki T, Okazaki T, Ueno K, Kido M, Matsumoto I, et al. Factors affecting survival after resection of intrahepatic cholangiocarcinoma[J].Surg Today,2014,44:1847-1854. |
| [7] | Yamasaki S. Intrahepatic cholangiocarcinoma: macroscopic type and stage classification[J].J Hepatobiliary Pancreat Surg,2003,10:288-291. |
| [8] | Nathan H, Aloia T A, Vauthey J N, Abdalla E K, Zhu A X, Schulick R D, et al. A proposed staging system for intrahepatic cholangiocarcinoma[J].Ann Surg Oncol,2009,16:14-22. |
| [9] | Okabayashi T, Yamamoto J, Kosuge T, Shimada K, Yamasaki S, Takayama T, et al. A new staging system for mass-forming intrahepatic cholangiocarcinoma: analysis of preoperative and postoperative variables[J].Cancer,2001,92:2374-2383. |
| [10] | Guglielmi A, Ruzzenente A, Campagnaro T, Pachera S, Valdegamberi A, Nicoli P, et al. Intrahepatic cholangiocarcinoma: prognostic factors after surgical resection[J].World J Surg,2009,33:1247-1254. |
| [11] | Yang J, Yan L N. Current status of intrahepatic cholangiocarcinoma[J].World J Gastroenterol,2008,14:6289-6297. |
| [12] | Nathan H, Aloia T A, Vauthey J N, Abdalla E K, Zhu A X, Schulick R D, et al. A proposed staging system for intrahepatic cholangiocarcinoma[J].Ann Surg Oncol,2009,16:14-22. |
| [13] | Jiang W, Zeng Z C, Tang Z Y, Fan J, Sun H C, Zhou J, et al. A prognostic scoring system based on clinical features of intrahepatic cholangiocarcinoma: the Fudan score[J].Ann Oncol,2011,22:1644-1652. |
| [14] | Luo X, Yuan L, Wang Y, Ge R, Sun Y, Wei G. Survival outcomes and prognostic factors of surgical therapy for all potentially resectable intrahepatic cholangiocarcinoma: a large single-center cohort study[J].J Gastrointest Surg,2014,18:562-572. |
| [15] | Bhudhisawasdi V, Muisuk K, Areejitranusorn P, Kularbkaew C, Khampitak T, Saeseow O T, et al. Clinical value of biliary alkaline phosphatase in non-jaundiced cholangiocarcinoma[J].J Cancer Res Clin Oncol,2004,130:87-92. |
| [16] | Eun J R, Jang B I, Lee J Y, Kim K O, Lee S H, Kim T N, et al. Clinical characteristics of intrahepatic cholangiocarcinoma and prognostic factors in patients who received non-surgical treatment[J].Korean J Gastroenterol,2009,54:227-234. |
| [17] | Chevret S, Trinchet J C, Mathieu D, Rached A A, Beaugrand M, Chastang C. A new prognostic classification for predicting survival in patients with hepatocellular carcinoma. Groupe d'Etude et de Traitement du Carcinome Hépatocellulaire[J].J Hepatol, 1999,31:133-141. |
| [18] | Pol B, Campan P, Hardwigsen J, Botti G, Pons J, Le Treut Y P. Morbidity of major hepatic resections: a 100-case prospective study[J].Eur J Surg,1999,165:446-453. |
| [19] | Tsuruma T, Sahara H, Takenouchi M, Yagihashi A, Iwayama Y, Shima H, et al. Synthetic sulfonolipids deduced from sulfonoquinovosyl diacylglycerols of sea urchin reduces hepatic ischemia-reperfusion injury in rats[J].Transplant Proc,2004,36: 1965-1969. |
| [20] | Poon R T, Fan S T, Lo C M, Liu C L, Lam C M, Yuen W K, et al. Improving perioperative outcome expands the role of hepatectomy in management of benign and malignant hepatobiliary diseases: analysis of 1222 consecutive patients from a prospective database[J].Ann Surg,2004,240:698-708. |
| [21] | Oben J A, Roskams T, Yang S, Lin H, Sinelli N, Li Z, et al. Sympathetic nervous system inhibition increases hepatic progenitors and reduces liver injury[J].Hepatology,2003,38:664-673. |
| [22] | Apte U M, Limaye P B, Ramaiah S K, Vaidya V S, Bucci T J, Warbritton A, et al. Upregulated promitogenic signaling via cytokines and growth factors: potential mechanism of robust liver tissue repair in calorie-restricted rats upon toxic challenge[J].Toxicol Sci,2002,69:448-459. |
| [23] | 黎介寿.临床营养支持的发展趋势[J].肠外与肠内营养, 2010,17: 1-4. |
| [24] | Blajchman M A. Immunomodulation and blood transfusion[J]. Am J Ther,2002,9:389-395. |
| [25] | Bordin J O, Blajchman M A. Immunosuppressive effects of allogeneic blood transfusions: implications for the patient with a malignancy[J].Hematol Oncol Clin North Am,1995,9:205-218. |
 2015, Vol. 36
2015, Vol. 36


