2. 第二军医大学药学院药理学教研室, 上海 200433;
3. 第二军医大学东方肝胆外科医院药材科, 上海 200438
2. Department of Pharmacology, School of Pharmacy, Second Military Medical University, Shanghai 200433, China;
3. Department of Pharmacy, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养素家族成员之一,其在中枢神经系统发育过程中起重要作用,同时也能维持成熟的中枢及周围神经系统神经元的正常功能[1]。BDNF生物半衰期较短,局部使用很快被稀释和代谢,需反复大剂量应用,大大限制了其临床应用。缓释微球给药系统能够包裹药物使其逐步释放,具有高效、无毒、安全、缓释给药、作用持久等优点,为解决这一问题带来新的希望。
聚乳酸-羟基乙酸共聚物(PLGA)具备良好的生物相容性、可吸收性、缓降解性并且可随人体新陈代谢排出体外,在植入性生物医学材料或药物载体等领域备受关注[2]。本研究以生物降解PLGA为载体材料,采用复乳化溶剂挥发法制备BDNF-PLGA缓释微球,并通过大鼠坐骨神经钳夹损伤模型,观察BDNF-PLGA缓释微球对大鼠坐骨神经损伤的作用,以期为周围神经损伤的临床治疗提供实验依据。
1 材料和方法 1.1 材料 1.1.1 实验动物SD大鼠,雄性,180~200 g,SPF级,购于上海斯莱克实验动物有限责任公司[实验动物生产许可证号:SCXK(沪)2012-0002],饲养于第二军医大学实验动物中心[实验动物使用许可证号:SYXK(沪)2012-0003]。大鼠在温度为22~25℃、相对湿度为40%~70%的动物房内饲养,光照时间随自然变化,供给常规颗粒饲料和灭菌过滤水,自由饮食饮水。
1.1.2 药品及试剂BDNF(Prospec TechnoGebe,批 号:115PBDNF06);PLGA(LA∶GA=50∶50,Mw= 34 000,德国Boehringer Ingelheim公司);聚乙烯醇(PVA1788,北京有机化工厂);二氯甲烷(AR,国药集团化学试剂有限公司);水合氯醛(国药集团化学试剂有限公司,批号:T20120120);注射用青霉素钠(山东鲁抗医药股份有限公司,批号:B120519)。
1.1.3 仪器CAP26P型电子分析天平(德国赛多利斯公司);S-450D超声波乳化仪(美国Branson公司);CS1222电子恒速搅拌器(上海医械专机厂);Allegra 64R台式高速冷冻离心机(美国Beckman公司);LGJ冷冻干燥机(解放军军事医学科学院实验仪器厂);NeuroMax1004肌电图/诱发电位仪(加拿大艾太克公司)。
1.2 BDNF-PLGA缓释微球制备[3, 4, 5]采用复乳化溶剂挥发法制备微球,将BDNF冻干粉(25 μg)溶解于100 μL 10 mmol/L pH 7.4的磷酸盐缓冲液,作为内水相。取50 mg PLGA加至2 mL二氯甲烷中,充分溶解后加入内水相,冰浴条件下超声乳化60 s(功率60 W),再加入4 mL 2%( 质量体积分数)聚乙烯醇(PVA)溶液中,冰浴条件下超声乳化90 s(功率60 W)。将上述复乳转移至30 mL 0.1% PVA溶液中,室温条件下搅拌(600 r/min)至二氯甲烷蒸发完全,形成PLGA载药微球的胶体溶液。微球胶体溶液于4℃、14 700×g离心30 min,收集微球,纯化水洗涤3次,经真空冷冻干燥48 h,即得[6, 7]。
1.3 模型制备、分组及给药将48只大鼠随机分为假手术组、模型组、BDNF组和BDNF-PLGA缓释微球组,每组12只。坐骨神经钳夹损伤模型制备参照文献[8, 9, 10, 11]方法并稍作改进。将大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉后,侧卧位固定在操作台上。右后肢外侧剃毛,用75%乙醇消毒皮肤后,沿坐骨神经走向纵行切口,暴露坐骨神经干,在梨状肌下缘1.5 cm处,用特制的无齿纹式钳钳夹坐骨神经,钳夹强度统一咬合至第1齿,钳夹持续时间5 min,造成2 mm长度的损伤。坐骨神经损伤部位远端与损伤部位末端的交界处用9-0无创尼龙线标记。假手术组仅暴露坐骨神经,不做钳夹处理。术后缝合伤口,肌内注射青霉素钠预防伤口感染,8万U/只,每天1次,连续3 d。
坐骨神经损伤后立即在损伤神经局部注射给药1次,BDNF组剂量为1 mL/kg(BDNF 30 μg/mL),BDNF-PLGA缓释微球组剂量为1 mL/kg(活性BDNF含量30 μg/mL),模型组给予等量的生理盐水。每周注射给药1次,共给药4次。
1.4 观察指标 1.4.1 大体观察术后观察大鼠饮食、精神状态、步态、伤口情况及足部变化。
1.4.2 神经功能评分参照5分制改良Tarlow评分标准[12]进行神经功能行为学评分。5分:正常步态,在快速旋转的基础上能持重且无平衡失调和足趾拖拉等现象;4分:前后肢能协调运动,但出现踝或足趾控制失调,步态及支重状态改变;3分:动物主动支重但伴有不协调的步态;2分:动物后肢三大关节出现不协调运动;1分:非反射性运动,踝部不存在运动;0分:迟缓性瘫痪。
1.4.3 神经电生理检查术后第4周,大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉后,暴露其右后肢坐骨神经,切断梨状肌,充分暴露坐骨神经中枢端,并向下暴露至腓神经入肌点,将肌电图/诱发电位仪电极针分别置于神经损伤处(尼龙线标记)的近端及远端刺激,腓肠肌接收,游标卡尺测量两电极间距离,测定神经传导速度(NCV)、波幅、潜伏期和复合肌动作电位(CMAP)波幅。
1.4.4 组织病理学观察在大鼠电生理检查完成后,取下右侧损伤坐骨神经部位,放入10%中性甲醛溶液中固定;常规脱水、石蜡包埋,切片。然后分别进行H-E染色和P-BG组合染色法[13]特殊染色,观察神经纤维病理形态学变化。
1.5 统计学处理采用SPSS 13.0软件进行统计学分析。实验数据用x±s表示;NCV、波幅、潜伏期及CMAP波幅、恢复率的比较采用单因素方差分析(One-way ANOVA),神经功能评分的比较采用非参数秩和检验(Mann-Whitney U检验)。检验水准(α)为0.05。
2 结 果 2.1 各组一般状况的比较术后未出现大鼠死亡,术后次日大鼠饮食量偏少,从第4日开始,饮食恢复正常。假手术组大鼠活动正常,其他各组大鼠在术后1周内大体状况相近,均出现右后肢拖步爬行,踝、趾下垂,站立不稳,不能自主运动,且各组大鼠右后肢均有轻度红肿。10 d后上述患肢症状逐渐缓解,伤口相继愈合。术后2周,模型组大鼠足趾出现屈曲反应,踝关节活动明显受限;BDNF-PLGA缓释微球组大鼠伤侧后肢蜷曲程度较轻,可活动,但跛行明显;BDNF组大鼠的情况较模型组有改善,但不如BDNF-PLGA缓释微球组好。术后3周,BDNF组大鼠行动能力较模型组明显增强,但仍有跛行;BDNF-PLGA缓释微球组大鼠行动能力较模型组明显改善,行走姿态有较轻度的跛行。术后4周,模型组术侧肢体仍不能完全自由活动,仍有跛行;BDNF组大鼠行动较模型组明显改善,但步态不协调;BDNF-PLGA缓释微球组大鼠活动已不受限,基本恢复正常。
2.2 各组坐骨神经功能的比较假手术组大鼠无坐骨神经功能障碍,活动均正常。术后1周,模型组、BDNF组和BDNF-PLGA缓释微球组3组情况相近,大鼠术侧下肢行走困难,跛行明显。术后2周,BDNF-PLGA缓释微球组大鼠坐骨神经功能评分大于模型组,差异有统计学意义(P<0.05)。术后3周,与模型组比较,BDNF-PLGA缓释微球组大鼠坐骨神经功能显著恢复,差异有统计学意义(P<0.01);BDNF组大鼠坐骨神经功能有所恢复,但差异无统计学意义。术后4周,BDNF组大鼠坐骨神经功能较模型组恢复明显(P<0.05),BDNF-PLGA缓释微球组大鼠坐骨神经功能基本恢复正常。实验观察期,BDNF-PLGA缓释微球组大鼠坐骨神经功能恢复明显快于BDNF组,在术后3周、4周时,BDNF-PLGA缓释微球组大鼠坐骨神经功能评分高于BDNF组(P<0.05,P<0.01)。结果见表 1。
|
|
表 1 大鼠坐骨神经损伤后不同时间各组的功能评分比较 Tab 1 Comparison of sciatic nerve function at different time points after injury in rats |
术后4周,模型组大鼠NCV和波幅降低,潜伏期延长,较假手术组差异有统计学意义(P<0.01)。与模型组比较,BDNF-PLGA缓释微球组能提高大鼠NCV、增大电位波幅、缩短潜伏期,差异均有统计学意义(P<0.01)。BDNF-PLGA缓释微球组大鼠改善NCV、波幅及潜伏期等指标均优于BDNF组,差异具有统计学意义(P<0.05)。详见表 2。
|
|
表 2 大鼠坐骨神经损伤后4周各组NCV、波幅、潜伏期及CMAP波幅和恢复率的比较 Tab 2 NCV,amplitude,latency period,CMAP amplitude and recovery rates four weeks after sciatic nerve injury in rats |
术后4周,模型组大鼠坐骨神经CMAP波幅较假手术组降低(P<0.01)。与模型组比较,BDNF-PLGA缓释微球组显著增大坐骨神经CMAP波幅,并提高CMAP恢复率,差异均有统计学意义(P<0.01)。BDNF-PLGA缓释微球组大鼠坐骨神经CMAP波幅和恢复率优于BDNF组,差异具有统计学意义(P<0.01)。结果见表 2。
2.4 各组组织形态学结果比较假手术组:神经纵切面神经纤维排列整齐,纵向平行排列,间隔均匀,基质淡红染,无炎性细胞浸润。模型组:可见髓鞘和轴突等结构破坏,髓神经纤维的髓鞘明显肿胀、碎裂,并伴有空泡化形成,空泡明显变性,但神经内膜的结构尚完整。BDNF组:神经纤维中可见多数大小不等的空泡,部分区域出现脱髓鞘样变,可见个别轴突裸露。BDNF-PLGA缓释微球组:神经纤维具有完整鞘膜,排列基本均匀,可见少量不明显的空泡样变性,髓神经纤维的髓鞘稍有轻度肿胀。见图 1。
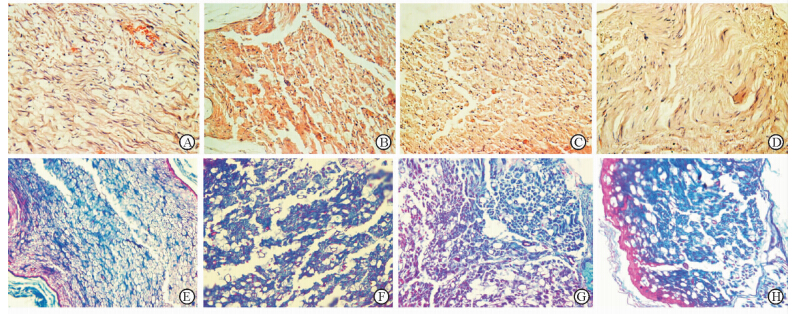
|
图 1 大鼠坐骨神经组织病理学观察 Fig 1 Pathological observation of rat sciatic nerve tissue A-D:Hematoxylin-eosin (H-E) staining;E-H:Phloxine-Brilliant green combine-staining. A,E: Sham group;B,F: Model group;C,G: BDNF group;D,H: BDNF-PLGA sustained release microspheres group. BDNF-PLGA: Brain-derived neurotrophic factor (BDNF)-polylactic-co-glycolic acid (PLGA). |
大鼠坐骨神经损伤模型是研究周围神经损伤及再生的常用动物模型。神经传导电生理学检测是评定周围神经损伤程度、判断预后及评价再生质量的重要方法之一[14];神经电生理学检测常用指标主要有CMAP、NCV等。NCV是神经冲动传导速度的直接表现,反映出神经传导功能的变化。通过对NCV和波幅的检测可判断神经损伤后整个神经功能的修复程度以及药物对神经功能的修复作用,可以反映出该药物对神经损伤的可能治疗作用[15]。
本研究以大鼠坐骨神经钳夹损伤为模型,术后外源性局部给予BDNF-PLGA缓释微球,采用神经行为学观察评分、神经电生理检查以及损伤神经组织病理学观察,评价BDNF-PLGA缓释微球对坐骨神经损伤大鼠的神经保护作用。结果显示,BDNF-PLGA缓释微球明显改善坐骨神经损伤大鼠的一般活动状况,可有效地改善大鼠损伤神经功能,到第4周时基本恢复正常。经BDNF-PLGA缓释微球治疗后,大鼠损伤坐骨神经的NCV显著提高,电位波幅增大,潜伏期缩短,CMAP波幅增大,CMAP恢复率提高。BDNF-PLGA缓释微球可改善并恢复损伤坐骨神经髓鞘和轴索等结构破坏,减轻髓鞘肿胀、碎裂,减少神经纤维中的空泡及空泡变性等组织病理学改变。本实验中,BDNF-PLGA缓释微球对大鼠一般活动状况、神经功能评分、神经电生理检查和组织病理学观察等所有指标的改善作用均明显优于BDNF组。推测其原因,我们认为利用PLGA聚合体包载BDNF制备成BDNF-PLGA缓释微球,可提高并维持局部有效药物浓度,大大减少药物剂量,从而降低不良反应;同时将药物包裹在微球内部,可以防止药物在体内快速降解,在聚合体与损伤神经局部组织界面缓释生物活性,延长药物作用时间,从而显著提高治疗效果。
综上所述,BDNF-PLGA缓释微球可有效治疗大鼠坐骨神经损伤,具有坐骨神经保护作用。BDNF-PLGA缓释微球具有高效、无毒、安全、缓释给药作用持久等优点,在临床治疗或修复周围神经损伤方面有着广阔的应用前景,值得深入研究。
| [1] | Dunham J S, Deakin J F, Miyajima F, Payton A, Toro C T. Expression of hippocampal brain-derived neurotrophic factor and its receptors in Stanley consortium brains [J].J Psychiatr Res, 2009, 43:1175-1184. |
| [2] | Garbayo E, Montero-Menei C N, Ansorena E, Lanciego J L, Aymerich M S, Blanco-Prieto M J. Effective GDNF brain delivery using microspheres——a promising strategy for Parkinson's disease [J]. J Control Rel, 2009, 135:119-126. |
| [3] | Leo E,Bribara B,Forni F,Vandelli M A.In vitro evaluation of PLA nanoparticles containing a lipophilic drug in water-soluble or insoluble form [J]. Int J Pharm, 2004, 278: 133-141. |
| [4] | Cheng J, Teply B A, Sherifi I, Sung J, Luther G, Gu F X, et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery [J]. Biomaterials, 2007, 28:869-876. |
| [5] | Zhang J X, Zhu K J. An improvement of double emulsion technique for preparing bovine serum albumin-loaded PLGA microspheres [J].J Microencapsul, 2004, 21:775-785. |
| [6] | 储 藏,高 静,丁雪鹰,尹东峰,杨 鹏,高 申.脑源性神经营养因子PLGA纳米粒的处方工艺研究[J]. 解放军药学学报,2008,24:189-192. |
| [7] | 史国栋,贾连顺,袁 文,史建刚,谭俊铭,储 藏. 脑源性神经营养因子缓释注射纳米粒的制备及其释药特性评价[J].第二军医大学学报,2008,29:538-542. Shi G D, Jia L S, Yuan W, Shi J G, Tan J M, Chu C. Preparation of injectable sustained-release nanoparticles carrying brain-derived neurotrophic factor and evaluation of their drug releasing characteristics[J]. Acad J Sec Mil Med Univ, 2008,29:538-542. |
| [8] | 郑菊阳,樊东升,刘小璇,张 朔. 靶肌肉注射人间充质干细胞对坐骨神经损伤保护性作用的电生理研究[J].中国神经精神疾病杂志,2007,33:353-356. |
| [9] | 陈恒胜,伍亚民,龙在云,曾 琳,邵 阳,王永堂. 蛇毒神经生长因子对大鼠坐骨神经损伤功能修复的时效作用研究[J].中国矫形外科杂志,2003,11:104-105. |
| [10] | 杨 勤,张亚声.芪楮复筋方对大鼠坐骨神经损伤后再生和修复的作用[J].中西医结合学报,2009,7:848-854. |
| [11] | Patro I K, Chattopadhyay M,Patro N.Flunarizine enhances functional recovery following sciatic nerve crush lesion in rats[J].Neurosci Lett,1999,263(2-3):97-100. |
| [12] | 邵 阳,伍亚民,陈恒胜,李 民,廖维宏.神经生长因子对大鼠坐骨神经损伤的修复作用[J].中国临床药学杂志,2001,10:157-159. |
| [13] | 龚志锦,朱明华,郑建明,王建军,陶文照.P-BG显示神经髓鞘和结缔组织纤维组合染色法[J].解剖学杂志,2006,29:127-128. |
| [14] | 王亚先,杨令延,胡 文. 双极金属钩电极体表刺激大鼠坐骨神经电生理特性检测[J].交通医学,2012,26:10-12. |
| [15] | 徐锦芳,朱国伟,许信龙,杨小锋,沈 宏,刘伟国.天然细胞生长调控因子对大鼠坐骨神经损伤后再生和修复的神经电生理研究[J].浙江创伤外科,2004,9:5-7. |
 2015, Vol. 36
2015, Vol. 36


